 三甲
三甲
Ⅰ型联合II型TKI的靶向联合--阿伐替尼与舒尼替尼治疗难治性GIST病例分享
胃肠间质瘤(GIST)是胃肠道除胃癌和肠癌常见恶性肿瘤之一,基于其核心分子改变——KIT或血小板衍生生长因子受体α(PDGFRA)基因的功能获得性突变[1],靶向KIT/PDGFRA的酪氨酸激酶抑制剂(TKIs)成为GIST的重要治疗手段。然而TKI继发耐药常有发生,这成为目前GIST治疗的主要难题。对于多重耐药的GIST患者,TKI联合应用可能是比较有希望的方案。
近日,我们在Annals of Translational Medicine杂志(IF=3.616)上发表了一篇阿伐替尼(Ⅰ型TKI)联合舒尼替尼(Ⅱ型TKI)作为七线治疗有效控制疾病进展的GIST病例报告,可为选择联合TKI治疗持续进展的晚期GIST提供一定参考。
病例介绍
1. 患者基本情况
55岁女性患者,2018年4月因“腹部不适、腹胀2月”就诊于当地医院(广东省)。查CT示:右腹腔内约13.4cm×10.6cm肿块。诊断为腹部肿瘤。
2. 治疗经过
手术:2018年5月,当地医院予施行R0切除术。术后病理:十二指肠GIST,有丝分裂计数<5/50 HPF;免疫组化:CD117(+)、CD34(+)、DOG-1(+)和Ki-67(5%+);基因检测:KIT_exon 9_502_503dup。
一线治疗:患者术后持续口服伊马替尼(400mg qd)辅助治疗,规律随访。2020年7月23日(术后第27个月)CT示:膈下腹膜转移、腹部种植转移,提示疾病复发。2020年9月CT示:既往病灶增大,并伴有新的腹部和肝脏转移,证实伊马替尼治疗后疾病进展(PD)。
二线治疗:患者改用舒尼替尼(37.5mg qd)治疗。2021年2月(5个月后)评估示:肝脏(S7)转移灶变大,但其他病变仍保持稳定(图1)。同时患者主诉右上腹疼痛,夜间及深呼吸时加重,遂转至中山一院治疗。
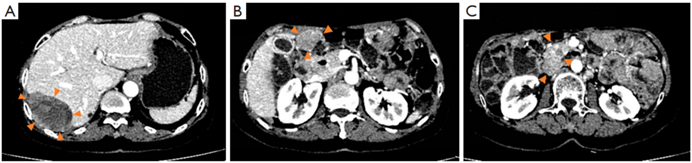
图1 2021.02腹部CT,(A)肝内S7段病灶,(B)腹膜病灶,(C)胰头下方病灶
二次手术:经多学科团队讨论,患者于2021年3月9日在接受复发GIST切除术(R1)。术后病理:肝S7段组织的有丝分裂计数>50/5mm2,Ki67(60%+);基因检测:除KIT exon 9突变外,还有KIT_exon16 p.L783V和TP53、POT1、SETD2突变。
三线治疗:患者于2021年4月(第二次手术后)开始改用瑞戈非尼,由于手足皮肤反应(HFS)等不良事件(AE),治疗剂量从160mg qd降至80mg qd。2021年8月(4个月后)CT示:肝脏和腹膜出现新发病灶(图2B),评估患者PD。
四线治疗:2021年8月患者开始接受瑞派替尼(150mg qd)治疗。1月后,CT显示病灶增大(图2C),评估患者PD。至此,所有针对GIST的标准靶向治疗均失败,也无合适的新药临床试验可进入。
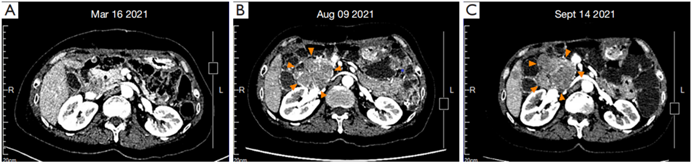
图2 (A)R1术后1周基线CT,胰头外无明显病灶;(B)瑞戈非尼治疗4个月后,肿瘤约5.1cm×6.5cm;(C)瑞派替尼治疗1个月后,肿瘤约6.9×6.5cm
五线治疗:鉴于瑞派替尼对KIT exon 9突变的抑制作用较弱,给予患者瑞派替尼(150mg qd)联合舒尼替尼(25mg qd)治疗。2021年10月12日(18天后)CT示:胰头旁的主病灶略有缩小,其他病灶保持不变,评估疗效为病情稳定(SD)。然而,患者不良反应明显,出现1-2级发热、3级HFS、2级牙龈出血和1级脱发,患者拒绝继续应用该双药联合方案。
六线治疗:考虑以上AE可能主要与舒尼替尼相关,遂建议用阿伐替尼替换。自2021年10月12日起,患者开始接受阿伐替尼(300mg qd)联合瑞派替尼(150mg qd)治疗。由于患者对AE的不耐受及出现眼底毛细血管出血,药物逐渐减量至阿伐替尼150mg qd、瑞派替尼100mg qd。2022年1月(3个月后)CT示:病灶均较前有所增大(图3),评估患者PD。
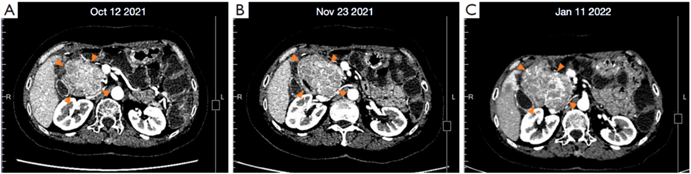
图3 2021.10.12~2022.01.11胰头旁肿瘤CT图像变化
七线治疗:综合考虑患者的基因突变型(伴有KIT exon 9及KIT_exon16突变)及各靶向药物的安全性。2022年1月12日起给予患者阿伐替尼(100mg qd)联合舒尼替尼(37.5mg qd)治疗。治疗期间,患者出现轻度面部及左下肢水肿(1级)、中度HFS(2级)和腹泻(2级),未出现骨髓抑制。因这些AE,患者间歇性停止用药9天,在症状自行缓解后恢复原剂量用药。
40天后,CT(图4,2022.03.01)示胰头旁的主病灶直径减少23%,靶病灶总直径减少15%,评估疗效为SD。根据RECIST 1.1标准,患者的6个靶病灶(3个腹膜转移病灶+3个肝转移病灶)中,除肝S8段转移灶略增大外,其他病灶均缩小。
遂继续维持阿伐替尼联合舒尼替尼方案。 此后2个月,患者发生的AE包括HFS(2-3级)、双下肢水肿(2级)、腹泻(1级)和白细胞降低(1级),患者因对AE不耐受间断短暂停止用药,一般服药10天,暂停1-2天,药物剂量不变。2022年5月6日CT提示病灶仍敏感,主病灶持续缩小达30%(图4)。根据RECIST 1.1标准,评估疗效为SD。全程诊治经过如图5所示。
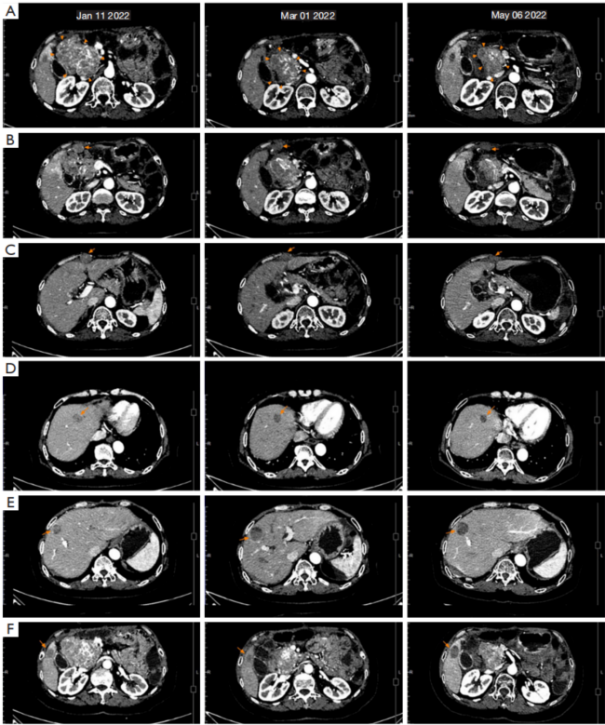
图4 2021.10.12~2022.01.11转移病灶CT图像变化,(A)胰头旁肿瘤;(B)腹膜病变1;(C)腹膜病变2;(D)肝S4转移;(E)肝S8转移;(F)肝S5转移
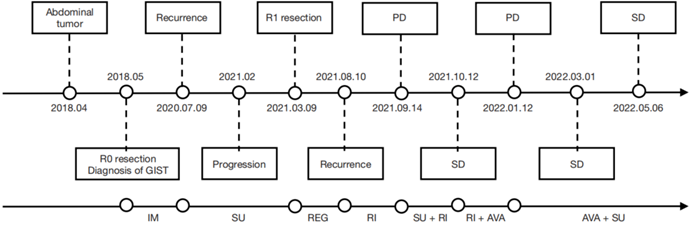
图5 患者临床诊疗时间轴,IM 伊马替尼,SU 舒尼替尼,REG 瑞戈非尼,RI 瑞派替尼,AVA 阿伐替尼
研究者说
TKI的出现彻底改变了GIST的治疗局面,患者预后得到改善,然而耐药问题不可避免地成为需要克服的新难题[2,3]。继发突变是耐药的重要机制,这些耐药性突变存在异质性,不同患者的继发性突变可能不同,同一病灶的不同部位也可能出现不同的突变[4]。虽然治疗GIST的靶向药物不断丰富,但是尚无理想的多靶点抑制剂能够涵盖所有的原发和继发突变。
本例患者为原发KIT exon 9突变,与KIT exon 11突变GIST相比,KIT exon 9突变GIST的预后更差,术后无复发生存期(RFS)更短,不同线数TKI治疗对肿瘤的控制时间也更短。大多数KIT exon 9突变GIST对高剂量伊马替尼及舒尼替尼治疗敏感,但PFS获益不一定令人满意。Heinrich MC等报道了一项对比瑞派替尼和舒尼替尼作为GIST二线治疗的临床研究,其亚组分析发现,对于KIT exon 9突变患者,舒尼替尼带来的PFS获益优于瑞派替尼[5]。该患者首次术后接受伊马替尼辅助治疗期间肿瘤复发,显示肿瘤对伊马替尼敏感性一般;后续接受舒尼替尼、瑞戈非尼、瑞派替尼作为第二、三、四线治疗,PFS均短于半年,肿瘤持续进展,反映其生物学行为高度恶性,耐药与继发突变(包括KIT_exon16 p.L783V和TP53、POT1、SETD2突变)最可能相关。
在各线靶向药物治疗失败的情况下,寻求标准治疗以外的治疗方案成为临床治疗难题。继发突变是GIST肿瘤患者出现继发耐药的最主要原因,有研究表明,TKI耐药GIST往往出现KIT以及PDGFRA基因的酪氨酸激酶结构域,包括ATP结合口袋突变和活化环(A-loop)突变[6-8]。而现有TKIs中,体外试验显示能够同时抑制ATP结合袋和活化环突变的药物是瑞派替尼,但其对原发的KIT exon 9突变效果不佳,机制仍不清楚。本例在单药治疗阶段的各线药物表现充分证明了上述过程。研究发现,A-loop突变会稳定KIT的活性结构,阻碍Ⅱ型TKI与变构袋的结合[9]。 因此,具有抗A-loop突变活性的Ⅰ型TKI与Ⅱ型TKI联合或许是耐药GIST有前景的治疗策略。同时,II型TKI中,舒尼替尼作为多靶点药物能够同时抑制血管生成,而且可能是当前几个常用靶向药中,对外显子9突变抑制效力最强的靶向药。一项Ⅰb/Ⅱa期的非随机临床试验证实了Ⅰ型+Ⅱ型TKI联合治疗GIST的疗效,患者同时接受PLX9486和舒尼替尼的单药推荐剂量治疗,有良好的疗效和可接受的耐受性[9]。我们推荐本例患者接受了阿伐替尼(Ⅰ型TKI)和舒尼替尼(Ⅱ型TKI)的联合治疗,既是基于理论上的依据,也是参考了上述临床试验的结果。
阿伐替尼是获批治疗GIST的唯一一个I型TKI,是一种口服的、强效选择性的KIT和PDGFRA抑制剂,已获批用于治疗PDGFRA exon 18突变(包括D842V突变)的不可切除性或转移性GIST患者[10,11]。阿伐替尼还具有抗KIT exon 17 D816V突变的活性[12]。此外,一项临床前研究的PDX模型显示,阿伐替尼对KIT exon 9突变(A502_Y503dup)肿瘤的抗肿瘤活性优于伊马替尼,与舒尼替尼相当[13]。因此,阿伐替尼除对PDGFRA exon 18突变的GIST有效外,对KIT exon 9突变、KIT exon 17突变的肿瘤也有一定的抑制作用。其常见不良反应(所有级别)包括贫血、水肿、恶心、疲劳/虚弱、认知功能障碍和呕吐。
舒尼替尼则是具有抗血管生成和抗肿瘤活性的口服多靶点TKI,可阻断包括KIT、PDGFRs、VEGFRs在内的多种RTKs[14]。常见不良反应包括血液学毒性、胃肠道反应、腹泻、蛋白尿、高血压、甲状腺功能异常、手足综合征、疲劳等。
从目前的治疗效果来看,该联合方案有效控制了多重耐药,治疗后第40天,胰头旁的主病灶直径减少23%,靶病灶总直径减少15%,治疗约4月后,主病灶缩小30%,至今病情稳定,PFS已超过8 月,且仍在获益(至2022年9月20日本文发稿时)。
最后,本病例还提醒我们TKI联合治疗的安全性需要重点关注。瑞派替尼联合舒尼替尼控制患者SD,但却因为无法耐受叠加的不良反应,不能继续治疗。后续为控制阿伐替尼联合舒尼替尼的不良反应,我们推荐了个体化的治疗剂量,同时当AE≥3级时,患者可间歇性停止治疗,待症状缓解后恢复治疗。
综上所述,GIST治疗过程中,耐药非常常见。当患者在TKI单药多线治疗进展(多重耐药)后,可以考虑不同靶向药物的联合治疗,同时需注意评估联合治疗的安全性,在安全性可接受的前提下,最大限度地提高GIST治疗疗效,改善患者的生存结局。未来值得开展前瞻性的临床研究以评估联合治疗疗效和安全性。
附注:中山大学附属第一医院胃肠外科中心正在开展有关GIST的多项临床研究,其中包括阿伐替尼治疗GIST(包括非PDGFRA突变)的多中心前瞻性真实世界研究(获得白求恩基金研究经费支持,ClinicalTrials.gov注册编号: NCT05461664,只要接受包含阿伐替尼治疗的治疗方案的GIST患者,均免费送检组织和连续多次监测的外周血高深度二代基因检测(NGS))。请有需要的患者留意,欢迎垂询:guoxd23@mail2.sysu.edu.cn,郭医生 。
本文(中文通讯稿)已经在 2022年10月5日中国医学论坛报今日肿瘤网页推送。2
参考文献:
1. Hirota S, Isozaki K, Moriyama Y, et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors.[J] .Science, 1998, 279: 577-80.
2. Gross S, Rahal R, Stransky N, et al. Targeting cancer with kinase inhibitors. J Clin Invest 2015;125:1780-9.
3. von Mehren M, Joensuu H. Gastrointestinal Stromal Tumors. J Clin Oncol 2018;36:136-43.
4. Parab TM, DeRogatis MJ, Boaz AM, et al. Gastrointestinal stromal tumors: a comprehensive review. J Gastrointest Oncol 2019;10:144-54.
5. Heinrich MC, Jones RL, Gelderblom H, et al. INTRIGUE: A phase III, randomized, open-label study to evaluate the efficacy and safety of ripretinib versus sunitinib in patients with advanced gastrointestinal stromal tumor previously treated with imatinib. J Clin Oncol 2022;40:359881.
6. Liegl B, Kepten I, Le C, et al. Heterogeneity of kinase inhibitor resistance mechanisms in GIST. J Pathol 2008;216:64-74.
7. 24. Kim JJ, Ryu MH, Yoo C, et al. Phase II Trial of Continuous Regorafenib Dosing in atients with Gastrointestinal Stromal Tumors After Failure of Imatinib and Sunitinib. Oncologist 2019;24:e1212-8.
8. 25. Serrano C, Mari?o-Enríquez A, Tao DL, et al. Complementary activity of tyrosine kinase inhibitors against secondary kit mutations in imatinib-resistant gastrointestinal stromal tumours. Br J Cancer 2019;120:612-20.
9. Wagner AJ, Severson PL, Shields AF, et al. Association of Combination of Conformation-Specific KIT Inhibitors With Clinical Benefit in Patients With Refractory Gastrointestinal Stromal Tumors: A Phase 1b/2a Nonrandomized Clinical Trial. JAMA Oncol 2021;7:1343-50.
10. Heinrich MC, Jones RL, von Mehren M, et al. Avapritinib in advanced PDGFRA D842V-mutant gastrointestinal stromal tumour (NAVIGATOR): a multicentre, open label, phase 1 trial. Lancet Oncol 2020;21:935-46.
11. Jones RL, Serrano C, von Mehren M, et al. Avapritinib in unresectable or metastatic PDGFRA D842V-mutant gastrointestinal stromal tumours: Long-term efficacy and safety data from the NAVIGATOR phase I trial. Eur J Cancer 2021;145:132-42.
12. Lübke J, Naumann N, Kluger S, et al. Inhibitory effects of midostaurin and avapritinib on myeloid progenitors derived from patients with KIT D816V positive advanced systemic mastocytosis. Leukemia 2019;33:1195-205.
13. Gebreyohannes YK, Wozniak A, Zhai ME, et al. Robust Activity of Avapritinib, Potent and Highly Selective Inhibitor of Mutated KIT, in Patient-derived Xenograft Models of Gastrointestinal Stromal Tumors. Clin Cancer Res 2019;25:609-18.
14. Demetri GD, Garrett CR, Sch?ffski P, et al. Complete longitudinal analyses of the randomized, placebo controlled, phase III trial of sunitinib in patients with gastrointestinal stromal tumor following imatinib failure. Clin Cancer Res 2012;18:3170-9.
本文是张信华版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论