 三甲
三甲
造血干细胞移植后肝窦隙阻塞综合征诊断与治疗中国专家共识(2022年版)
肝窦隙阻塞综合征(sinusoidal obstruction syndrome, SOS)也称肝静脉闭塞症(veno-occlusive disease, VOD),多发生于摄入某些毒性生物碱、高剂量放/化疗和器官移植的患者,是一种可危及生命的严重疾病。造血干细胞移植(HSCT)患者是SOS最主要的发病人群,SOS也是移植早期的重要合并症和死亡原因之一。本共识在参考该领域国外指南/共识的基础上,纳入国内的主要研究成果和临床经验,结合现时国情,为各移植单位SOS规范化诊疗提供指导性意见。
一、定义和流行病学
HSCT后SOS是指HSCT后早期发生的、预处理相关肝毒性导致的一类主要表现为黄疸、液体潴留、肝肿大等特征的临床综合征,重症患者病死率可高达80%[1,2,3]。
因患者特征、预处理方案、移植中心经验、诊断标准等差异,SOS发生率在不同研究中的差异较大。一项荟萃分析显示中位发生率为13.7%(0~62.3%)[4]。综合来看,自体HSCT(auto-HSCT)后发生率为3.1%~8.7%,异基因HSCT(allo-HSCT)为8.9%~14.0%[4,5,6,7,8]。儿童HSCT患者发生率略高于成人[9,10,11,12]。国内广西医科大学附属第一院报道allo-HSCT后SOS发生率为7.4%[13]。近年来发生率及严重程度总体有所下降,但某些药物(如CD33、CD22等单抗)的应用、增加强度预处理、二次移植等在一定程度上会增加患者发病风险。
二、发病机制
SOS的发病机制尚未明确,目前认为预处理方案相关肝毒性为首要病因。白消安(BU)、环磷酰胺(CTX)、全身放疗(TBI)等对窦隙内皮细胞(SEC)和肝细胞的毒性损伤是SOS发生的直接原因,肝小叶中心区域(肝腺泡3区)因缺乏谷胱甘肽(GSH)而更易发生损伤[14,15,16]。除预处理外,组织损伤产生的细胞因子、药物[钙调神经磷酸酶抑制剂(CNI)、造血生长因子、抗体药物等]、异源反应性T细胞、某些GSHS-转移酶相关基因突变、内源微生物代谢物的迁移及造血植入等也可导致或加重SEC损伤[17,18,19,20,21,22,23,24]。SEC损伤导致内皮细胞屏障破坏,窦壁完整性丧失,红细胞渗至狄氏(Disse)腔,引起内皮细胞分离,造成肝窦隙阻塞;此外,凝血-纤溶系统失衡可致微血栓形成,加重小叶中心静脉阻塞,最终形成窦后性门静脉高压。发展至重症者小叶中心坏死、纤维化,肝功能衰竭。鉴于内皮损伤在发病机制中的中心地位,也有学者将SOS纳入HSCT相关内皮损伤综合征范畴[25,26]。
三、危险因素
SOS发病危险因素一般分为患者相关和移植相关两类。前者主要包括:年龄、体能状况、移植前肝病史/肝功能异常、疾病进展状态、地中海贫血、铁过载、腹部放疗史、应用吉妥珠单抗(Gemtuzumabozogamicin)或奥加伊妥珠单抗(Inotuzumabozogamicin)[27,28,29]。后者主要包括:allo-HSCT(相比auto-HSCT)、HLA不合/单倍型移植、二次移植、移植物非去T细胞、含BU或TBI预处理、氟达拉滨、CNI联合西罗莫司预防GVHD等。
识别危险因素或构建前瞻性风险评估模型有助于SOS的早期预测和预防[30]。
四、诊断、分级及鉴别诊断
典型SOS多发生于HSCT后21 d内,迟发型可发生于21 d后。可隐匿发病,也可急骤进展。主要临床表现包括右上腹压痛、黄疸、痛性肝肿大、腹水、体重增加、水肿等。实验室检查可见高胆红素血症、转氨酶升高、难以解释的血小板减少等。影像学(推荐多普勒超声)检查可发现肝肿大、腹水、胆囊壁水肿、肝/门静脉血流减慢或反向血流、门静脉增宽等[31,32]。轻症患者呈自限性,重症者可出现肾、肺、心脏等多器官功能衰竭(MOF),预后凶险。
肝组织活检病理是诊断金标准,但在移植早期实施出血风险大,不常规推荐。有经验的单位可选择经颈静脉肝活检或测量肝静脉压力梯度(HVPG)辅助诊断。近年以瞬时弹性成像技术(TE)进行肝硬度检测(LSM),预测和诊断的敏感性及特异性较高[33,34,35]。
目前尚无具有预测或诊断意义的生物学标志物。纤溶酶原激活物抑制物-1(PAI-1)等血凝标志物有一定的预测价值,内皮细胞损伤及炎症标志物尚在探索中[36,37,38,39,40],不推荐常规检测。
SOS临床诊断多依据修订的西雅图(Seattle)标准[41]或巴尔的摩(Baltimore)标准[42]。2016年欧洲骨髓移植学会(EBMT)提出的SOS标准[3]具有较好的实用性,本共识推荐使用该标准,也可与前述2个标准并行使用。各诊断标准见表1。

儿童SOS的EBMT诊断标准[10]:无发生时间限定,至少满足2条下述表现:①难以解释的消耗性血小板减少和无效输注;②即使应用利尿剂,仍有难以解释的连续3 d体重增加或体重增加>5%基线值;③高于基线值的肝脏肿大(建议影像学确认);④高于基线值的腹水(建议影像学确认);⑤连续3 d胆红素高于基线值,或72 h内胆红素≥2 mg/dl。值得注意的是,16%~20%的儿童SOS为迟发型,近30%无黄疸表现[43,44]。
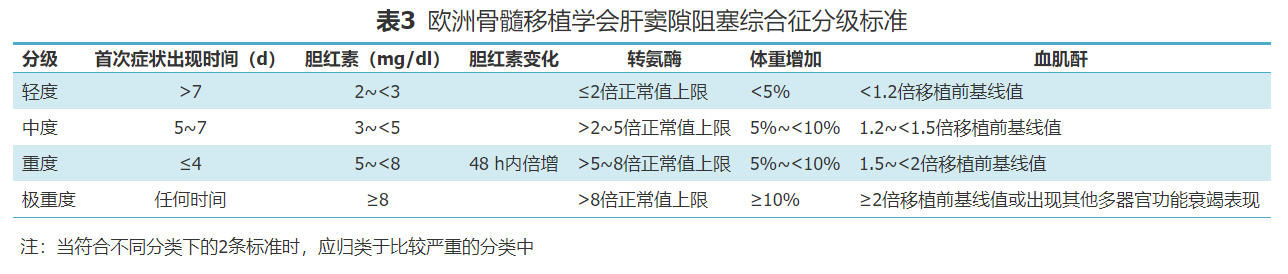
本共识推荐采用美国血液学会SOS分级标准[45](表2)及EBMT分级标准[3](表3)进行严重程度分级。

SOS需要与以下疾病鉴别:肝脏急性GVHD、病毒性肝炎、药物性肝损伤、毛细血管渗漏综合征(CLS)、移植相关血栓性微血管病(TA-TMA)等,鉴别要点见 表4 。


五、预防
1.一般原则:
避免SOS危险因素,包括祛铁治疗、避免肝炎活动期进行HSCT、预处理方案调整(减低强度、药代动力学指导BU用药、分次TBI等)、避免合用肝毒性药物、警惕某些药物应用(CD33/CD22单抗等)增加SOS风险;液体平衡管理(避免超负荷,同时维持有效血容、避免肾灌注不足);HSCT后早期应监测体重、腹围等变化。
2.预防药物:
①熊去氧胆酸(UDCA):随机对照临床试验(RCT)及荟萃分析显示UDCA可降低HSCT后SOS发生率[46,47,48,49]。部分研究未能观察到上述结果,但发现Ⅲ/Ⅳ度肝脏急性GVHD发生率明显下降,1年总生存(OS)率更优[50]。目前,UDCA在国内外已得到普遍应用[25,51,52]。推荐用法:UDCA 12~15 mg·kg-1·d-1,移植前开始服用,移植后100 d停药。②普通肝素或低分子量肝素:临床应用和试验研究较多,RCT及荟萃分析(包括儿童及成人)结论不一[7,53,54,55,56,57],国内应用较多。前列腺素E1(PGE1):相关RCT研究缺少一致性结论,国内应用较多。③中成药:复方丹参、复方川穹嗪等,国内部分移植中心有应用经验。④去纤苷(DF):提取自猪肠黏膜的一种单链多聚脱氧核苷酸复合物,机制尚未完全阐明。初步发现具有保护内皮、恢复血栓-纤溶平衡、抗凝及调节血小板活性等作用,不显著增加出血风险。DF是目前国外唯一获批的SOS治疗药物,尚未批准用于预防,但多个预防的RCT研究结果令人鼓舞[9,58,59]。荟萃分析显示,DF预防组SOS发生率显著低于对照组(4.7%对13.7%)[60]。除降低SOS发生率外,DF还可降低SOS相关死亡率及急性GVHD发生率[9,61,62]。推荐用法:DF 6.25 mg/kg,每6 h 1次,每次维持2 h静脉给药,自预处理开始用药,移植后30 d停药。
本共识建议,SOS高危患者,如有条件可选用DF预防,常规预防可选用UDCA、普通或低分子肝素、前列腺素E1及中成药等,也可联合用药,建议各中心根据各自经验选用[63]。鼓励积极开展相关的临床试验研究。
六、治疗
进行严重程度分级有利于分层治疗。约70%的轻症患者经暂停CNI等可疑药物并给予利尿、液体平衡管理等支持治疗即可恢复。暂停CNI时应审慎评估GVHD风险,必要时予糖皮质激素、霉酚酸酯、CD25单抗等药物替代。重度及极重度患者应立即启动特异性治疗。轻、中度患者接受支持治疗,严密观察并根据病情变化及时调整治疗方案,以防病情恶化。
1.支持治疗:
每日监测患者体重、腹围、尿量、出入量等,评估病情及治疗反应。去除可疑诱因,严格管理水钠摄入,利尿,输注白蛋白、血浆或成分血,维持循环血量和肾灌注。胸/腹腔大量积液时,可适度抽液以减轻压迫。低氧状态时给予氧疗或机械通气。必要时镇痛治疗,合并肾功能衰竭时进行血液透析或滤过治疗。重症患者建议转重症监护病房(ICU)或进行多学科会诊(MDT)。
2.特异性治疗:
常用药物包括DF、重组人组织型纤溶酶原激活物(rh-tPA)、糖皮质激素等。
(1)DF:DF是欧美国家唯一批准的重度SOS治疗药物,疗效和安全性已被多个较高质量的临床研究证实。完全缓解(CR)率为25.5%~55.0%,100 d生存率为38.2%~58.9%(不伴MOF者达71.0%),儿童疗效优于成人,主要不良事件为出血(肺、消化道)[64,65,66,67]。一项纳入140例SOS患者的上市后Ⅳ期研究结果显示,DF治疗后100 d生存率为58%,其中重度病例生存率为79%,极重度病例为34%[68]。推荐用法:6.25 mg·kg-1·h-1(2 h静脉滴注),依据治疗反应用药2~3周。有出血风险患者,可根据经验酌情减量。获得CR或发生严重出血时,可停药观察。
(2)rh-tPA:属丝氨酸蛋白酶,与纤维蛋白结合后,诱导纤溶酶原转化为纤溶酶,降解纤维蛋白,发挥溶栓活性。较早期的国外指南将其列为不能获得DF时的可选择药物之一,后基于较高的严重出血风险(近30%)而不再推荐[25]。近年国内陈峰等以低剂量rh-tPA(10 mg/d)为主方案治疗16例HSCT后重度/极重度SOS,CR率及100 d生存率均达到75%,无严重出血相关死亡[69,70]。
(3)糖皮质激素:早期应用有一定疗效。甲泼尼龙(MP)0.5 mg/kg,每日2次,反应率为63%,100 d生存率为58%[71]。Myers等[72]应用MP治疗儿童SOS(500 mg/m2,每日2次),反应率为66.7%。应用时应警惕增加感染风险。
(4)其他:对治疗无反应、进展的SOS患者,如有条件,可尝试经颈静脉肝内门体静脉分流术(TIPS)、肝移植等挽救治疗。
共识建议采取分层治疗策略,需特异性治疗的患者在支持治疗基础上可加用DF。目前DF尚未在国内上市,各中心可根据各自经验选择低剂量rh-tPA、糖皮质激素等治疗,鼓励开展相关的临床试验研究。
引自:中华血液学杂志, 2022,43(3) : 177-183. DOI: 10.3760/cma.j.issn.0253-2727.2022.03.001
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论