精选内容
-
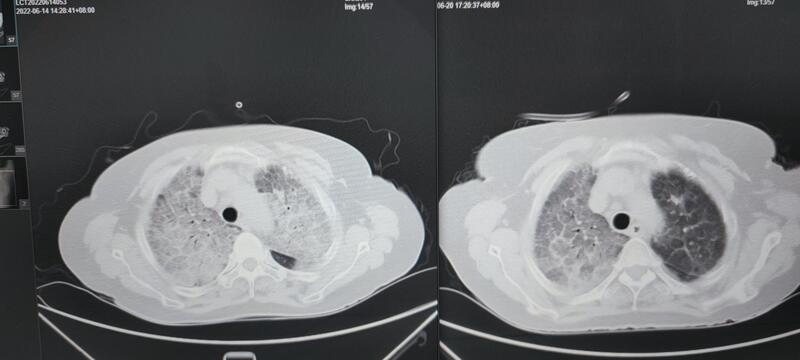
我中心大容量肺泡灌洗前后对比:
肺灌洗疗法适应症1、年龄65岁以下、无活动性肺结核、肺大泡、心脏病或其它实质脏器疾病的各期尘肺煤工尘肺、矽肺、铸工尘肺、电焊工尘肺、水泥尘肺等各种无机粉尘所致的各期尘肺及肺内粉尘沉着症。尘肺各期均有适应症,尤以0+、I期为最佳。2、肺泡蛋白沉积症。3、黏液黏稠症。4、慢性非局限性化脓性支气管扩张症。5、慢性以痰栓阻塞为主的感染性支气管炎。6、吸入性肺炎(含吸入粉末或液体状异物的清除)。7、放射性粉尘吸入。
 山东胸科医院呼吸内科科普号
山东胸科医院呼吸内科科普号 2022年06月20日
2022年06月20日 553
553
 0
0
 0
0
-
肺泡蛋白沉积症
一、概述肺泡蛋白沉着症(pulmonary alveolar proteinosis,PAP)是一种原因不明的肺泡腔内弥漫性蛋白沉积,由肺泡腔和远端气道内积聚大量富含磷脂蛋白质样物质为特征的罕见疾病。原发性PAP能够产生对抗粒细胞巨噬细胞集落刺激因子(GM-CSF)的抗体,证实PAP是一种自身免疫性疾病。1.病因:PAP分为原发性和继发性两种类型。原发性PAP好发于婴幼儿及儿童。病因未明。近年来认识到粒细胞-巨噬细胞集落刺激因子(GM-CSF)抗体在原发性PAP发病机制中起重要作用。继发性PAP多见于以下三种情况:①某些化学物质或矿物质的呼吸道吸入可诱发PAP,如大量粉尘吸入(铝、二氧化硅白陶土、钛等);②肺部感染,如肺部结核分枝杆菌、诺卡茵、真菌和肺孢子菌感染有时与PAP合并存在;③恶性肿瘤或其他免疫功能低下疾病,如淋巴瘤、急慢性白血病、HIV感染或艾滋病患者等均有同时合并PAP的报道。但值得注意的是,有时很难区分原发性抑或继发性。2.发病机制:PAP的发病机制尚不明确,大多认为本病可能由于机体内、外因素作用引起肺泡表面活性物质的产生、代谢、清除过程的某一些环节异常所致。3.病理生理:巨检显示肺脏有多发性淡黄或灰白色坚实结节,明显变硬,重量增加,肺的切面有黄白色液体流出。肺实变与代偿性肺气肿并存。光镜下肺泡结构基本正常,肺泡内充满细颗粒状、无结构的PAS染色阳性的蛋白样物质,在终末呼吸性细支气管腔内也可见到,但间质内不出现。肺泡Ⅱ型细胞增生、肥大,肺泡巨噬细胞呈泡沫状。除非继发感染很少出现炎症细胞。电镜下见肺泡Ⅱ型细胞胞浆内有特征性的呈同心圆排列的板层小体结构。二、临床表现1.症状体征:PAP可发生于各个年龄段,10~50岁多见。男女之比约2~4:1。起病十分隐匿,约1/3患者可无任何临床症状,仅在体检时发现。最常见的临床表现为渐进性的呼吸困难、轻中度干咳或咳白黏痰、团块状痰。乏力、胸痛、体重减轻也较常见。缓慢进展成为呼吸衰竭。发热偶见。体检很少有体征发现,有时肺底可闻及少量捻发音。临床症状与胸部X线表现不平衡是本病的特征之一。病程较长患者可见杵状指、发绀。2.并发症:可并发肺部感染和呼吸衰竭等。三、医技检查1.X线检查:典型的胸部X线表现为两侧肺门向外扩散的弥漫性边缘模糊的细小结节阴影,常融合成片状,但无肺水肿的Kerley B线,病灶间有代偿性肺气肿或小透亮区。可见纵隔增宽。2.CT检查:胸部高分辨CT(HRCT)对PAP有诊断价值,主要表现为两肺斑片状阴影,致密影中可见支气管充气征,边缘清晰,锐利,病灶与周围正常肺组织形成鲜明的对照,形成一种“地图”状改变;有时呈毛玻璃样改变,小叶间隙和间隔不规则增厚,表现为多角形态的“铺路石”或“碎石路样”(crazy pavlng appearance,CPA)征象,该征象被认为是PAP的特征性改变。3.其他辅助检查:肺功能表现为轻度限制性通气功能障碍和弥散障碍。大多数患者血清LDH和表面活性蛋白-A(SP-A)或表面活性蛋白-D(SP-D)升高。近来研究发现癌胚抗原(CEA)约半数在PAP患者中也有增高,并与疾病的严重程度相关,灌洗治疗后的CEA值均有下降。四、容易误诊的疾病应与特发性肺间质纤维化,肺泡癌,粟粒性肺结核,肺实质性疾病如病毒性肺炎、支原体肺炎、衣原体肺炎等疾病鉴别。五、治疗原则主要针对如何清除沉着于肺泡内蛋白样物质,近年来用双腔气管导管(Carlen导管)或纤支镜作一侧肺或肺叶的生理盐水灌洗,定期交替进行,近期疗效显示患者呼吸困难和肺功能均有改善,半数患者X线胸片可变清晰,远期效果则多数保持缓解状态,少数患者复发,常在6-24个月内,可再作肺灌洗。六、预后该疾病总体预后差。儿童大多在发病的数年内死亡,成人中虽有自愈病例报道,但时有复发,且约半数以上患者因为病情逐步进展,直至呼吸衰竭死亡,一般病程5—10年。
黄志亮医生的科普号 2019年04月28日
2019年04月28日 3560
3560
 0
0
 0
0
-
间质性肺病系列一--肺泡蛋白沉积症
老王曾在一个化工厂上班有十几年了,几年前出现咳嗽以及间断痰中带血,拍个胸片医生说得了支气管肺炎,于是抗感染止血镇咳药治疗后,症状好了一些,老王没有复查。这几年来老王咳嗽仍持续不停,并且出现了活动耐力下降的情况,同样的活现在常常感觉疲倦。于是他到了笔者的医院,肺部CT显示两肺散在斑片状低密度影,呈现出类似的铺路石样改变。临床上考虑是肺泡蛋白沉积症,于是给予行肺泡灌洗,洗出类似牛奶样的物质,行特殊的PAS染色阳性。后来继续进行多次的肺泡灌洗后,患者的症状明显好转。肺泡蛋白沉着症(PAP)是一种原因未明的少见疾病,其特点是肺泡内有不可溶性磷脂蛋白沉积,临床症状主要表现为气短、咳嗽和咳痰。该病于1958年首次报道,年发病率约百万之四,本院每年会诊断2~3例,但由于不少病人被漏诊估计实际病人数会更高。PAP根据病因可有特发性、继发性和先天性之分。特发性PAP现在又称为自身免疫性的肺泡蛋白沉积症,主要是由于体内存在某种自身抗体--抗GM-CSF中和性抗体,这占所有PAP的90%;由其他系统的疾病并发形成的,比如血液系统的疾病,这种类型叫继发性的肺泡蛋白沉积症;也有少部分与遗传因素有关,叫做先天性的肺泡蛋白沉积症。为了简单说明这个疾病的发病机制,我们要先了解肺的最基本的组织--肺泡是如何运作的。我们先将将肺泡想象成肥皂泡,肥皂泡有大有小,为什么肥皂泡能变得那么大,是由于泡沫的表面有一种张力叫表面张力。同样人体内的肺泡为了保证其在通气过程中始终保持球形状态也需要表面张力,而能维持表面张力的物质叫表面活性蛋白。这个表面活性蛋白是由肺泡II型细胞产生的,但也是在不停的代谢,当表面活性蛋白衰老失去功能后就由肺泡内的巨噬细胞吞噬消化,而巨噬细胞的功能是需要巨噬细胞集落刺激因子(简称GM-CSF)帮助下完成的。特发性PAP患者体内有GM-CSF抗体,导致肺泡内巨噬细胞不能有效的清除表面活性蛋白,结果是大量衰老失活的表面活性蛋白在肺泡内堆积,这些异常堆积的物质在显微镜下看着是蛋白质样的,因此命名为肺泡蛋白沉积症。该病发病年龄主要在20—50岁之间,大部分患者较年轻,男女比例相当。本病发展非常隐匿和缓慢,刚开始患者和医生都很难意识到是这种病。当肺泡里 面堆积了越来越多不应该存在的物质时,患者逐渐出现活动后喘息甚至呼吸困难等症状,部分症状轻微的患者是因为长期咳嗽不愈来就诊。还有些患者是偶然发现的,比如由于感冒或者肺炎拍胸片,片子显示肺部有异常,再细致检查后发现是这种病。不过本病的影像学表现具有特征性,因此诊断并不难,本病需要进行肺部CT,尤其是高分辨的CT。PAP的CT检查结果的特点如下:第一,双肺同时出现不清晰阴影,呈地图状分布,跟 世界地图一样板块结构非常明显,一块一块的;第二,肺部有铺路石样改变,就跟院子里面细石子或者小方砖一样。确诊本病需要进行支气管镜检查,严格意义上讲需要经过支气管镜取肺泡内组织做病理活检才能明确;但现在越来越多的医院通过支气管镜下肺泡灌洗获取沉淀物行PAS染色也可以临床诊断。正常人的肺泡灌洗液非常清亮透明,但肺泡蛋白沉积症患者的肺泡灌洗液会比较浑浊,像米汤或者石灰水,而且这种灌洗液放置一段时间后会产生沉淀。至于PAP的治疗,要根据病情严重程度而定,如果患者的呼吸功能基本正常,可以继续观察病情的变化,定期复查;如果患者的呼吸功能下降,应及时治疗。治疗的方法主要是肺泡灌洗治疗,所需的液体量非常大,一般是全肺灌洗,需要在手术室全麻状态下,把肺里的脏东西洗干净。经过一次肺泡灌洗后大部分患者在相当长的时间里能够维持正常的呼吸功能, 但是有的患者还是会复发,就需要重复灌洗。肺泡灌洗后的患者仍需要每隔三到六个月需要复查评估呼吸功能,内容包括血气分析,患者步行六分钟的活动能力以及影像学CT检查。如果呼吸功能下降比较明显,就要再灌洗。本文系沈凌医生授权好大夫在线(www.haodf.com)发布,未经授权请勿转载。
沈凌医生的科普号 2014年12月12日
2014年12月12日 6794
6794
 0
0
 1
1
-
肺泡蛋白沉积症继发感染
肺泡蛋白沉积症(pulmonaryalveolar proteinosis, PAP) 是一种少见疾病,以肺泡和细支气管腔内充满过碘酸雪夫(pedodicacid Schiff,PAS)染色阳性的富磷脂蛋白物质为特征的慢性肺疾病。目前认为粒细胞原巨噬细胞集落刺激因子(granulocyte-macrophagecolony-stimulating factor, GM-CSF)功能障碍导致巨噬细胞清除肺泡表面活性物质的能力下降是特发性PAP的可能发病机制【1】。近年研究发现【2】,GM-CSF是肺表面活性物质重要的调节因子,在先天性免疫系统及肺内的宿主防御中也具有至关重要的调节作用。因此,PAP患者易并发肺部感染,继发感染也是导致PAP死亡的重要原因。我们回顾性分析我院2001-2011年确诊的PAP伴感染的病例16例,同时以未伴发感染的PAP患10例作为对照研究,分析PAP继发感染患者的临床特征及诊疗过程,先报到如下:1.对象与方法1.1入选对象:入选的所有患者根据病史、体征、胸片或胸部CT检查,并结合支气管肺泡灌洗液(bronchoalveolarlavage fluid,BALF)及肺组织学活检结果符合PAP诊断标准。其中16例PAP继发感染的患者经痰涂片、痰培养、血清学检查或支气管肺泡灌洗液培养确诊的病原体感染。16例PAP继发感染的患者中,男性13例,女性3例,年龄:34-65岁,所以患者肺部均有感染病灶,其中1例伴有淋巴结结核,1例为支气管-肺泡化脓性感染。另外,10例PAP患者结合临床表现及痰培养、涂片或肺泡灌洗液培养等检查均未发现合并肺部感染依据,作为病例对照研究。1.2 方法:回顾性分析16例PAP继发感染患者的流行病学资料、临床表现、辅助检查、治疗措施及临床转归等;并以10例未继发感染的PAP患者为对照,分析PAP继发感染患者的临床所特有的特征。2统计方法采用SPSS13.0软件进行统计分析,数据以平均值±标准差(X±S)表示,两组间临床变量比较用t检验,若方差不齐,采用Mann-WhitneyU非参数检验,P<0.05表示差异有统计学意义。3结果3.1临床特征:16例PAP患者中,平均年龄为:46.6±7.6岁,平均病程约为:38.7±30月。男性占绝大数,比例为:81%,其中男性吸烟患者占总病例的比例为:69%。肺部感染的病原体多为机会性感染,其中结核分支杆菌最常见(7例),其次真菌感染(6例);细菌感染以G-杆菌多见,仅一例合并支气管-肺化脓性感染患者出现G+球菌及厌氧菌感染。在确诊病原体诊断上,主要以痰及BALF培养为主,结核分枝杆菌多能从痰涂片中找到抗酸杆菌确诊。16例继发肺部感染患者中,仅2例患者出现白细胞增高,且两例感染患者分别为白色念珠菌及霉菌感染,其中霉菌感染患者(WBC:15.8*109/L)近期接受过激素治疗。12例(75%)患者接受大容量全肺灌洗术,4例未行全肺灌洗患者中2例死亡。详见表1。3.2 PAP继发感染与疾病的严重性血清LDH及肿瘤标志物、动脉血氧分压、肺功能均可反映出PAP患者的疾病严重程度【3-5】。与未感染的PAP患者相比较,PAP继发感染患者血清LDH为60±110U/LVS 201±76U/L,PO2为61±11.6mmHgVS 86±12.4mmHg,具有显著性差异(P<0.05);而在肿瘤标志物及肺功能参数间,两者无统计学差异。见表2。3.3 WLL治疗PAP继发感染的疗效12例患者接受分期大容量全肺灌洗术,除1例出现病情加重外,其余症状均得到改善,其中一例支气管-肺泡化脓性感染患者,经WLL术后感染得以控制。12例患者术后动脉氧分压平均提高8.5mmHg,LDH平均下降25U/L,见图1。4.讨论PAP是一种少见病,根据PAP的发病机制及临床特征分为3类:先天性、特发性及继发性PAP,其中90%以上为特发性PAP。在PAP发病机制中可以明确的是,特发性PAP为一种自身免疫性疾病,由于血清中出现GM—CSF自身中和性抗体,与CM—CSF特异性结合,阻断了GM—CSF功能的发挥,导致肺泡巨噬细胞功能改变,使肺泡表面活性物质清除下降所致【6】。GM-CSF通路的阻断不仅仅影响到肺表面活性物质的代谢,也影响巨噬细胞的趋化性、细胞黏附性、抗原识别受体的表达、吞噬能力、对微生物杀伤能力等免疫功能方面明显受损【2】,以及肺泡腔内蛋白样物质沉积宜于病原体生长。因此,容易并发肺部感染是PAP的一个重要特征。我们研究发现,PAP患者易继发机会性感染,常见有结核分枝杆菌及真菌感染,此与黄慧等的研究相一致【7】,其报道的9例PAP继发感染患者均为机会性感染,其中4例为结核分枝杆菌,3例为真菌感染,及2例奴卡菌感染,其中一例奴卡菌合并巨细胞病毒感染。而我们16例患者痰及BALF标本中均未培养出奴卡氏菌属及病毒,这可能受我院检验技术的局限性有关。在临床上,血清 LDH, 血气中PaO2及PA-aO2常作为评价PAP患者疾病严重性的指标【5】。同时研究发现,血肿瘤标志物(CEA及NSE)和肺功能(VC、TLC及TLco)也与疾病的严重性明显相关【3-4】。我们研究发现,继发感染的患者 LDH 明显高于未继发感染者,同时PaO2明显下降,此提示感染是影响疾病严重性及预后的重要因素,尤其可能是机会性感染。临床上发现PAP继发的感染,由于机体全身免疫力降低及肺防御能力下降,抗感染治疗效果相对较差,咳喘等症状改善不明显而且易出现反复感染。本研究结果证实,WLL能够有效缓解症状,降低病情严重性,既能治疗原发病,也有利于肺部感染的控制。本研究中一例患者出现支气管-肺化脓性感染,痰培养提示混合性感染(甲型、乙型链球菌,产气球菌)且病原体对多种抗生素耐药,反复抗感染治疗病情仍进行性进展,行全肺大容量灌洗后,感染才得以控制。其可能机制为,WLL除了能机械切除支气管及肺泡内磷脂蛋白外,还可以恢复肺泡巨噬细胞、II型上皮细胞的功能,促进GM-CSF的分泌【8】。 PAP存在不同病原体感染的风险,既包括呼吸道普通致病原,也包括某些条件致病原,尤其是结核分枝杆菌和真菌。因此,对于影像学非典型表现的PAP患者,需警惕继发肺部感染可能,及早对痰、BALF及血清学等标本进行相关检测,早期确诊病原体类型,从而更针对性的进行抗感染治疗。对于感染难以控制的患者,WLL也不失为可选择的治疗方法之一。
张映铭医生的科普号 2012年08月13日
2012年08月13日 4727
4727
 2
2
 0
0
-
肺里沉积类似牛奶、豆浆样物质的疾病——肺泡蛋白沉积症
肺泡蛋白沉积症(Pulmonary Alveolar Proteinosis,PAP),也称作肺泡磷脂沉积症,是一种罕见的不明原因的疾病。PAP的最早报道见于1958年,是以肺泡腔内积聚大量的磷脂蛋白和类表面活性物质为特征,大量的肺内分流导致进行性低氧血症、咳嗽、呼吸困难和呼吸功能不全。诊断一、临床表现通常表现隐匿性呼吸困难、咳嗽、偶有咳白粘痰,胸痛和咯血少见,很少伴发热。肺部体征常不明显,可以在肺底部闻及爆裂音。肺部症状和体征与胸部X线表现不平行是本病的特征之一。二、辅助检查1. 化验检查:80%的病人的血清乳酸脱氢酶(LDH)增高。2. X线胸片/HRCT:显示两侧弥漫性的肺泡渗出伴间质渗出阴影,常分布于肺门周围,无胸水或肺门淋巴结肿大。胸部HRCT显示斑片样或片状磨玻璃样影或实变影,伴小叶间隔增厚,渗出影与周围正常肺组织形成明显的界限。3. 肺功能和血气分析:特征性生理功能改变是肺内分流导致的严重低氧血症, DLco降低和DLco/VA降低,肺活量或肺总量轻度降低,呼气流速正常。4. BAL:BAL回收液的外观和显微镜下表现具有特征性,灌洗液呈黄白色、混浊、稠厚,静置后沉淀分层,BAL的PAS染色阳性可以证实诊断。5. 组织活检:组织病理学特征是肺泡腔充满密集的类表面活性物质,这些物质能被过碘酸雪夫(PAS)试剂染成淡粉色。经纤维支气管镜检查进行TBLB和BAL经常能确立诊断。如果支气管镜检查还不能明确诊断,应该进行经胸腔镜肺活检。治疗1. 全肺灌洗是首选的治疗手段,通常在全身麻醉下借助Carlens双腔气管内导管进行,一般先用20—30L生理盐水(370C)灌洗病变严重侧的肺,等待几周后再灌洗另一侧肺。对于复发的病例可以进行反复的灌洗。全肺灌洗需要3—5个小时才能完成,耗时长,需要的技术条件高,并发症的发生率高。2. 经纤维支气管镜分段支气管肺泡灌洗 每次灌洗时分段灌洗一侧肺,每一肺段每次灌洗50-100ml,重复数次,全肺灌洗总量可达2000-4000 ml ,全过程历时1-2小时。
郭伟医生的科普号 2011年09月17日
2011年09月17日 4999
4999
 0
0
 0
0
相关科普号

马增霞医生的科普号
马增霞 副主任医师
山东省公共卫生临床中心
呼吸与危重症医学科
74粉丝1.4万阅读

郭伟医生的科普号
郭伟 主任医师
首都医科大学附属北京天坛医院
急诊科
180粉丝116.4万阅读

张映铭医生的科普号
张映铭 主任医师
南京市胸科医院
呼吸内科
29粉丝2.9万阅读
-

 推荐热度5.0胡洋 主任医师上海市肺科医院 呼吸科
推荐热度5.0胡洋 主任医师上海市肺科医院 呼吸科肺部结节 58票
咳嗽 19票
间质性肺疾病 18票
擅长:擅长支原体感染,支原体肺炎,新冠感染,新冠肺炎,间质性肺病、肺结节病、弥漫性泛细支气管炎、慢性阻塞性肺病、支气管扩张、支气管哮喘、肺部肿瘤、上呼吸道感染、肺部结节等疾病诊治。 -

 推荐热度4.7李霞 主任医师上海市肺科医院 呼吸科
推荐热度4.7李霞 主任医师上海市肺科医院 呼吸科间质性肺疾病 15票
慢阻肺 10票
肺部结节 9票
擅长:肺结节、肺部肿瘤,间质性肺病、肺纤维化、结节病、肺炎、支气管炎、支气管扩张、肺气肿、肺大泡、哮喘、弥漫性泛细支气管炎、肺动脉高压等疑难肺疾病和危重症的救治 -
 推荐热度4.4陈智鸿 主任医师上海中山医院 呼吸科
推荐热度4.4陈智鸿 主任医师上海中山医院 呼吸科哮喘 13票
间质性肺疾病 12票
咳嗽 8票
擅长:擅长呼吸道慢性炎症性疾病(慢阻肺、哮喘、支气管扩张、慢性咳嗽、过敏性鼻炎),间质性肺疾病(间质性肺炎、间质性肺病,结缔组织病相关肺疾病,肺纤维化,结节病,肺血管炎,嗜酸细胞性肺炎),肺小结节及肺部阴影诊断,肺血管疾病(急/慢性肺血栓栓塞,肺动脉高压)等的诊断和治疗。




