精选内容
-
原发性硬化性胆管炎PSC治疗新靶点:肠道菌群
原发性硬化性胆管炎(PSC)是一种罕见的自身免疫性肝病,其特征是肝内外胆管进行性炎性狭窄,胆管纤维化,可最终导致肝硬化及相关并发症。多项研究指出肠道菌群失衡可能参与PSC发病机制。菌群失调可以导致肠道上皮屏障受损和免疫失调,肠道细菌或细菌代谢产物通过门静脉直接进入肝脏,诱发胆管病变。肠-肝轴,特别是肠道菌群调节,成为PSC的新兴治疗靶点。近期,澳大利亚伊丽莎白女王医院Bogatic等人在《ALIMENTARYPHARMACOLOGY&THERAPEUTICS》发表了一篇综述论文,概述了各种肠道菌群调节方案在PSC治疗中潜在价值,主要包括口服抗生素、益生菌、饮食调控和粪便菌群移植(FMT)这几类菌群干预手段。口服抗生素/万古霉素万古霉素是一种糖肽类抗生素,口服时在胃肠道基本不吸收。既往口服万古霉素主要用于艰难梭菌和葡萄球菌性胃肠炎等肠道疾病。在PSC-IBD患者中,口服万古霉素可以诱导和维持溃疡性结肠炎缓解。万古霉素能够显著改变PSC-IBD患者的菌群组成,增加Blautia丰度和减少Bacteroides丰度。对万古霉素在PSC中的疗效认识源于1998年,当时Cox报道了三名PSC-IBD的儿童口服万古霉素后,症状和肝酶有所改善。另外有两项随机对照试验评估了万古霉素治疗PSC的疗效。Rahimpour等人将29名确诊PSC的成年患者随机分为两组:一组服用万古霉素125毫克,每天四次,另一组服用安慰剂,为期12周,只有万古霉素组出现Mayo风险评分下降。两组患者12周时ALP都没有显著变化,但万古霉素组患者在疲劳、瘙痒、腹泻和食欲减退等主观症状上显著减少。同时,万古霉素治疗耐受性很好。Tabibian等人将35名PSC成年患者随机分为四组:万古霉素125毫克或250毫克每天四次,或甲硝唑250毫克或500毫克每天三次,为期12周,低剂量和高剂量万古霉素组导致ALP下降(下降幅度分别为46%和40%),甲硝唑组没有出现ALP下降。低剂量万古霉素组Mayo风险评分显著降低(下降0.55)。Davies等人评估了14名PSC儿童口服万古霉素,万古霉素以50毫克/公斤/天的剂量开始,在肝酶和ESR正常化或不再改善时继续使用,10名儿童中有7名(71.4%)的ALT、GGT和ESR完全恢复正常,其他4名(28.6%)患者的相关指标有所改善但没有恢复正常。一名患者进行了治疗前后肝活检。显示胆管的炎症和纤维化有所改善。Abarbanel等人报告了14名儿童口服万古霉素,50毫克/公斤/天,治疗3个月后,血清GGT和ALT显著降低,这种改善效果能够维持到治疗12个月后。9名患者通过治疗前后MRCP或活检,显示万古霉素治疗后胆管炎症、纤维化获得改善。口服抗生素/甲硝唑甲硝唑是一种杀菌性抗生素,对革兰氏阴性和革兰氏阳性厌氧菌具有高度活性,用于治疗胃肠道的细菌和原虫感染,包括贾第虫病、阿米巴病、艰难梭菌和幽门螺杆菌。Farkkila等人开展的多中心双盲随机对照试验中,80名PSC患者被随机分配为两组,一组每天服用600-800毫克(根据体重)甲硝唑,一组服用安慰剂,经过36个月,与安慰剂组相比,甲硝唑组ALP下降幅度更显著,并显著Mayo风险评分。甲硝唑治疗患者中,分别有34.4%和43.8%出现组织学改善,显著多于安慰剂组。然而,治疗期间甲硝唑组患者耐受性较差,副作用发生率明显增加,主要是消化不良、恶心、眼痛、腹泻和食欲减退。综合来看,甲硝唑在PSC中的疗效数据不如万古霉素,其副作用可能将显著限制其长期使用。口服抗生素/利福昔明利福昔明是一种半合成广谱肠道特异性抗生素,服用后肠道基本不吸收,主要体现局部活性。利福昔明在治疗肝性脑病方面具有显著的临床疗效,可以减少肝硬化住院次数。利福昔明主要作用于肠道局部,能够降低整体肠道细菌密度。除了其杀菌和抑菌特性外,利福昔明对菌群功能还能产生一系列额外的影响,包括降低内毒素血症和减少潜在有毒的次级胆汁酸的形成。此外,它能通过诱导乳酸菌下调促炎细胞因子IL-6和TNF-α来减少肠道固有层炎症细胞浸润。Tabibian等人研究了16名PSC患者中利福昔明的安全性和有效性,所有患者加用550毫克口服利福昔明,每天两次,持续12周,没有发现利福昔明在降低血清ALP、AST、GGT、总胆红素、白蛋白、C反应蛋白、MayoPSC风险评分、疲劳和瘙痒症状评分等方面有明确效果。然而该研究规模较小,且没有设置对照组,因此在考虑将利福昔明作为PSC的潜在治疗药物之前,仍需要开展更大规模的研究。口服抗生素/阿奇霉素阿奇霉素是一种广谱大环内酯类抗生素,具有长半衰期和卓越的组织渗透性。关于阿奇霉素在PSC中的应用证据非常有限,仅一份病例报告描述了一名PSC患者在接受阿奇霉素治疗后,胆汁淤积相关症状和血清标志物的改善。Boner等人报告了一位45岁患有克罗恩病和PSC的女性,无意中持续使用阿奇霉素治疗支气管扩张症5个月后,胆汁淤积相关症状明显缓解,血清肝酶下降,并且在肝脏超声检查也有改善。停用阿奇霉素3周后,患者再次出现尿色加深和瘙痒复发,6周后发现肝酶升高。随后重新启动阿奇霉素,患者的症状和生化异常再次逆转。尚无其他报告或研究使用阿奇霉素治疗PSC。因此,阿奇霉素在PSC中的治疗价值仍然未知。益生菌在一项针对14名PSC-IBD患者的随机安慰剂对照交叉试验中,研究了含有四种乳杆菌和两种双歧杆菌的益生菌,ALP等肝功能指标或临床症状没有改善。粪菌移植粪菌移植(FMT)是将健康个体的粪便移植到患者身上用于治疗疾病的一种菌群调节方式。FMT目前主要用于复发性或难治性艰难梭菌感染的标准治疗,已有多个随机对照试验证明其有效性。另外,有证据表明FMT可以诱导溃疡性结肠炎缓解。第一例FMT治疗PSC的病例报告报道了一位38岁男性,他在等待肝移植期间反复出现复发性细菌性胆管炎,他接受了来自健康捐赠者的FMT,每周通过结肠镜治疗一次,持续4周,治疗完成后,患者的菌群发生改变,结构更类似于捐赠者的菌群,同时肝酶、胆红素和有毒胆汁酸(包括胆酸、脱氧胆酸和鹅去氧胆酸)显著降低。ALP从基线的456 IU/L降低到治疗后3个月的344IU/L,并在12个月后保持这一水平(352IU/L)。治疗完成后患者无发热和黄疸,并在1年后仍然能维持。Allegretti等人在2019年发表的涉及FMT在PSC中的使用的单一开放标签试验,这项研究中,10名PSC患者接受了来自单一捐赠者的一次性90毫升FMT,通过肠镜在右侧结肠给药,10名患者中有3名(30%)ALP比基线降低50%以上。菌群分析显示,所有患者的α多样性在FMT后1周开始增加,所有患者与捐赠者的菌群相似性增加。这种菌群改变在治疗后24个月仍能在很大程度上得以维持。总结万古霉素治疗PSC相关研究最多。口服万古霉素副作用少,并在两项随机对照试验中显示出降低ALP和Mayo风险评分有利结果。其他抗生素如甲硝唑、利福昔明、米诺环素和阿奇霉素有一定疗效但不甚明显,亟待进一步验证。FMT可以诱导UC的缓解,鉴于大多数PSC患者也合并UC,值得探索FMT这一治疗方法。这篇综述展示了肠道菌群调节治疗PSC治疗的希望,期待未来开发更多新的治疗方法和临床试验,为临床治疗带来新选择。参考文献:BogaticD,BryantRV,LynchKD,CostelloSP.Systematicreview:microbialmanipulationastherapyforprimarysclerosingcholangitis.AlimentPharmacolTher.2023Jan;57(1):23-36.
 陈燕飞医生的科普号
陈燕飞医生的科普号 2024年06月02日
2024年06月02日 157
157
 0
0
 1
1
-
原发性硬化性胆管炎PSC最佳治疗窗口期
原发性硬化性胆管炎(PSC)是一种慢性进展的自身免疫性疾病,主要影响肝内外胆管,会导致胆管纤维化。相比原发性胆汁性胆管炎PBC来说,PSC更为罕见。传统观念认为PSC没有药物可以治疗,熊去氧胆酸疗效也不确切。然而,近年来随着对疾病的认识更为深入,特别是对儿童期确诊PSC病例研究,传统治疗观念受到挑战。近期《Hepatology》发表了来自美国贝勒医学中心的Kellermayer博士等人的综述论文,作者提出PSC发展过程中存在一个特别适合接受治疗的窗口期,过了这个窗口期,大多数目前针对肠道微生物群或免疫抑制的干预措施收效甚微。这个治疗窗口期有可能是在结合胆红素水平开始上升之前的阶段,即在低SclerosingCholangitisOutcomesinPediatrics(SCOPE)评分阶段。此时加用抗炎、抗纤维化和/或微生物治疗可能是有效的。这个治疗窗口期预计是在PSC演变早期出现,最有可能在青春期之前的儿童患者,所以应加强对这部分患者的筛查和治疗。以下是这篇综述的全文,推荐有兴趣的专业人士阅读,文中较多名词缩写,可参考文后的缩写对应表。PSC疾病谱年龄相关性PSC的发病率和患病率在全球范围内有所不同,分别为每10万人年1-1.5例和6-16例。约20%的PSC患者在18岁之前确诊。PSC患者主要是男性(60-70%),诊断的高峰年龄在30-40岁之间,大约5%的病例中会合并炎症性肠病(IBD)的病程。随着影像技术的进步,最近的研究表明,超过8%的慢性结肠炎患者(溃疡性结肠炎[UC]和克罗恩病样表型)可能有亚临床PSC,特别是女性患者更多见。大多数PSC患者(60-90%)会合并IBD,IBD可能出现在PSC诊断前或诊断后,通常是合并UC(80-90%),而非克罗恩病。然而,与PSC相关的结肠炎具有独特的特征。PSC-IBD的特征是反向梯度炎症,病变主要位于右侧(80-90%),临床症状相对不明显,合并逆行性回肠炎,类似于回结肠克罗恩病样炎症(10-20%)。与单纯IBD相比,儿童PSC-IBD结肠炎病情较轻且不具侵袭性,即结肠炎的临床严重程度较低,不太会进展到需要结肠切除的情况。这可能是由于PSC-IBD遵循反向梯度表型,直肠或远端疾病较轻,导致大便异常不明显。但也是因为PSC-IBD儿童结肠炎症状轻,诊断常常被延误,导致亚临床炎症被低估,忽略肠镜检查。小胆管与大胆管PSCPSC包含小胆管(SD-PSC)和大胆管(LD-PSC)两种亚型。小胆管PSC(SD-PSC)特点是肝活检显示PSC的胆汁淤积和组织学特征,但影像学检查大胆管无异常。经典PSC一般是LD-PSC,胆管变化仅限于影像学MRCP上可见。17%至25%的“SD-PSC”患者合并IBD,平均8年左右可以进展为ERCP或MRCP可见的胆管异常,即LD-PSC。不合并IBD的孤立(非经典)SD-PSC具有不同的遗传起源,似乎不太可能发展为LD-PSC。PSC-AIH重叠PSC可以合并AIH(自身免疫性肝炎),称为“PSC-AIH重叠”或“自身免疫性硬化性胆管炎”(ASC)。专家更推荐使用“具有AIH特征的PSC”这一名称,而非PSC-AIH重叠,因为大多数病例是PSC的一种特殊形式。Ricciuto等人提出ASC是自身免疫性胆管炎(AC)的连续形式,随着时间的推移可以发展为硬化性胆管炎(SC),伴随着周围纤维化的进展,最终表现为经典PSC。发病年龄变异本文的核心观点是PSC与IBD和AIH关联与起病年龄相关。Catassi等人研究发现,92%患非常早发性IBD和PSC(VEO-PSC-IBD:平均3.7-5.9岁)的患者合并AIH重叠,明显高于年龄较大的儿童PSC和儿童IBD(PSC-PIBD)患者中合并AIH的发生率(66%)。欧洲队列研究也证实,VEO-PSC-IBD和PSC-PIBD队列中分别有93%和97%的患者最终出现LD-PSC。迄今为止最大规模的全球儿童PSC队列研究,记录了781名患者(中位年龄12岁),其中76%患有IBD,13%有SD-PSC,33%有AIH重叠。SD-PSC患者比LD-PSC的患者在诊断时年龄更小。SD-PSC在VEO-IBD患者中更为常见。研究还发现,约20%的儿童期发病AIH在30年内发展为PSC-AIH(10%)或PSC(10%),其中92%发展为PSC-IBD。基于上述结果,可以认为最初表现为单纯的AIH病例中也会存在亚临床PSC-AIH-IBD。另一项多中心回顾性研究比较了不同年龄段确诊PSC患者的临床特征,分为1-19岁、20-59岁和60-79岁三个阶段,发现随着确诊时年龄的下降,SD-PSC的比例增加(1-19岁:13%,20-59岁:5%,60-79岁:2%),PSC-AIH重叠频率增加(1-19岁:7%,20-59岁:5%,60-79岁:2%),PSC-IBD重叠发生率显著增加(1-19岁:85%,20-59岁:80%,60-79岁:67%)。与疾病程度较轻患者相比,等待肝移植的患者中AIH的患病率要明显低得多,表明临床活跃的AIH可能随着年龄的增长或PSC的进展而消退。诊断为肝硬化的成年PSC患者中合并IBD的比例也明显减少。疾病进展儿童与成人PSC患者相比,无事件生存率更高。相比儿童PSC患者,成年PSC患者在确诊时胆管病变更重。总的来说,与在成年或老年时期被诊断为LD-PSC的患者相比,SD-PSC和儿童PSC患者在诊断后20-30年时间中疾病进展缓慢。然而,合并各种并发症并进展到需要肝移植的年轻患者,特别是AIH治疗后仍不缓解的患者,更有可能经历移植后急性排异,由于慢性排异而发生移植失败的情况也较多。此外,许多肝移植后的儿童PSC患者会出现PSC复发。PSC病因谱PSC的发病机制并不十分清楚。基于PSC与IBD之间的强关联,无论首先出现的是PSC还是IBD,普遍的病因学观点是在PSC遗传背景下,环境因素驱动的末端回肠/近端结肠的肠道微生物群-免疫-肝脏轴发生紊乱,表现为“肠漏”,肠道来源的抗原或肠道菌群迁移到胆道系统,伴随着同时发生的胆汁酸代谢紊乱,共同导致对肝内外胆管的过度免疫攻击,随着时间的推移,引起继发性的胆管周围纤维化。肠道微生物群失调可能参与了这一自身免疫过程的持续和传播。除了遗传背景外,IBD发展三重环境打击理论也同样适用于PSC:在有PSC遗传倾向的患者中,产前环境影响可能诱发PSC的表观遗传启动因子(一重打击:PSC准备),随后是产后微生物群-肠道-肝脏-免疫轴变化(二重打击:PSC倾向),最后关键的触发因素启动疾病(三重打击:环境触发PSC)。PSC起病年龄影响并发症PSC逐渐进展可能导致胆道狭窄/胆汁淤积、肝硬化、继发肠道和肝脏恶性肿瘤、终末期肝病等情况,通常在确诊后15-20年内需要肝移植。儿童时期确诊患者有40%的概率在10年内会出现严重致命的并发症。PSC是一种癌前病变状态,会增加胆管癌和结直肠癌(CRC)的风险。PSC-IBD患者患CRC风险增高。尤其是儿童患者,因为他们起病早,将终生携带显著增加的CRC风险。PSC-UC是儿童患者早期死亡的高风险因素之一。这些并发症部分可能与临床结肠炎更轻微,病情不易被发现有关。总体而言,儿童PSC-IBD患者以及PSC-IBD患者比非PSC-IBD患者发生CRC的风险增加超过40倍。PSC-UC的病因以及其癌前性质的原因尚不清楚,对于有效预防和治疗是一个关键的知识空白。因此,即使结肠炎症状较轻,对于结肠和PSC患者,定期复查肠镜监测CRC也同样重要。PSC疾病发展论假说基于上述现有文献和经验,作者提出所有PSC病例可能源自于儿童早期对前肠起源的胆管和肝细胞(肝憩室)以及远端中肠起源的末端回肠和近端结肠(盲肠憩室和远端中肠)的自身免疫性炎症重叠,从儿童早期开始导致缓慢进展“隐匿性/亚临床”PSC。根据这一观点,非常早发的PSC(VEO-PSC)就是这种自身免疫重叠的临床典型,代表了PSC人群“冰山一角”。与之前PSC可能代表不同病因的混合疾病状态理论相反,作者提出所有PSC病例都可以统一在“自身免疫重叠起源”的概念下,PSC主导与其相关的所有其他自身免疫状况。支持这一观点的证据如下:1.作者引入了“憩室自身免疫”的概念模型,其胚胎起源来自肝憩室(在4-6周的胎龄期间产生肝芽、胆囊和腹侧胰腺芽)和盲肠憩室(产生盲肠和阑尾)。推测PSC是这种自身免疫最终表现,源于“SD-PSC”-“AIH”-“IBD”重叠。支持这一理论的发现是阑尾切除术,可能通过减少“免疫原性”组织的数量,延迟了PSC和PSC-IBD的发病。2.远端中肠衍生的末端回肠/近端结肠的肠道-微生物群-免疫-肝脏轴在PSC病理中发挥中心作用。3.自身免疫性硬化性胆管炎(ASC)也可纳入自身免疫性胆管炎(AC)的疾病谱中,会进展为硬化性胆管炎(SC)。Ricchiuto等人提出随着时间的推移,“SD-PSC”会伴随胆管周围纤维化增加,逐渐进展为PSC。4.PSC几乎只在非常早发的IBD(小于6岁)中以PSC-IBD-AIH重叠的形式出现,其中重叠的AIH组分随着PSC诊断时患者年龄的增长而逐渐减少。5.“儿童SD-PSC”可以发展成LD-PSC。支持这一观点的研究数据包括:约15%的儿童SD-PSC在5年内发展为LD-PSC,66%在30年内发展为LD-PSC。宿主遗传学区分了SD-PSC的两种形式(与IBD相关的“儿童”形式以及“孤立的、成人”形式)。表观遗传和免疫学变异,治疗干预,决定了儿童SD-PSC转化为LD-PSC的速度。6.AIH和IBD可以在没有治疗的情况下自发达到深度缓解状态,这对于重叠病例特别重要,尤其是在亚临床阶段,随着年龄的增长,“AIH”和“IBD”会逐渐自我缓解。7.与PSC治疗非常相关的是,在合并IBD和AIH的过程中存在一个治疗窗口,在胆管重大损伤出现之前,关键的治疗干预可能会改变疾病的过程和结果。8.一旦小胆管和大胆管发生显著的纤维化,PSC就会变成一个自我维持的纤维化过程,免疫治疗将失去效果。但目前一些在研的抗纤维化药物或包括抗生素疗法在内的组合疗法可能会有效。9.PSC诊断越晚,胆管病的并发症和恶性肿瘤出现得越快,这也支持在较晚确诊的患者中PSC长期隐匿/亚临床存在的观点。10.儿童PSC迅速进展通常预示着更高的肝移植后并发症风险,与年轻受体更强烈的自身免疫性相关,更容易发生PSC复发,以及移植物排异的情况。基于以上各点,作者假设所有PSC病例都源于儿童早期在盲肠/升结肠触发的事件,表现为“肠道菌群失调”和“肠漏”(亚临床结肠炎),导致微生物或代谢产物,包括胆汁酸,通过门静脉进入肝脏的汇管区,随后进入胆管。这些微生物和微生物衍生的代谢产物在肝脏和胆管中诱发损伤和炎症,并随后产生“憩室性”自身免疫性炎症反应,主要针对胆管(AC/ASC启动)。在ASC内的免疫反应随后将以不同的严重程度传播至肝细胞(导致“AIH”)和盲肠憩室衍生的上皮细胞(导致“IBD”:盲肠/近端慢性结肠炎,偶见末端回肠炎)。这种自身免疫反应在有遗传易感性、产前有触发因素、产后致敏的宿主中将会表现出来。在儿童时期,所有三种自身免疫反应都可能会消退,不表现出任何临床表型(亚临床状态)。6岁之前有临床表现和确诊的病例一般只是“冰山一角”,主要是倾向于纤维化的VEO重叠病例。在那些保持亚临床状态、自身免疫性炎症缓慢进展的病例中,ASC会进展到PSC,SD-PSC可能会随时间变化进展到LD-PSC,肠炎会进展到慢性“IBD”。在这个过程中,“IBD”或“AIH”可能会变得活跃,但这些都是PSC主导驱动的合并IBD和AIH的亚型(即PSC-IBD,PSC-AIH)。在发生显著纤维化和胆道梗阻之前的早期阶段,PSC是可逆的,可以表现为进展或相对静止,理论上可以自发逆转。相关的“AIH”和“IBD”也是如此,随着年龄依赖的免疫反应演变而逐渐缓解。随着PSC的进展,特别是在亚临床状态下,如果未检测到重叠免疫的窗口期或重叠免疫已经开始消退时,能够治疗的可能性就会降低,增加并发症的风险。可以推测PSC中存在一个特别适合接受治疗的窗口期,过了这个窗口期,大多数目前针对肠道微生物群或免疫抑制的干预措施可能变得不那么有效或无效。这个治疗窗口窗口期最有可能出现在结合胆红素水平开始上升之前的阶段,即在低SclerosingCholangitisOutcomesinPediatrics(SCOPE)(儿童硬化性胆管炎结果)评分阶段。这时候,加用抗炎、抗纤维化和/或微生物治疗可能是有效的。这个治疗窗口期预计是在PSC演变早期出现,最有可能在青春期之前的儿童患者。PSC治疗窗口期的干预方案之一是口服万古霉素治疗(OVT)。Cox等人在1998年首次报道OVT对三名患有PSC-IBD的儿童有益。OVT可能通过调节肠道微生物群和肠道代谢组发挥作用,从而抵消“肠漏”诱导的PSC循环。OVT对PSC-IBD患者是安全的,可以促进持续的临床和生化应答。研究表明OVT能够改善儿童PSC。在一个开放标签的前瞻性试验中,25名SD-PSC患者接受OVT治疗后,12名接受了随访肝活检,其中11名发现门脉/周围炎症有减轻。在同一队列中,34名LD-PSC患者中26名OVT治疗后MRCP显示有改善。一个单中心病例研究发现12名PSC-IBD的儿童/年轻成人患者中,有2名(17%)MRCP有改善,强调了儿童/年轻成人OVT治疗的机会窗口。Pratt及团队发现OVT(每天两次,每次一克)在成人PSC患者中的临床和生化应答效果不如儿童,但9位患者中仍有4位得到了改善。一例儿童肝移植后PSC复发的患者,经过OVT治疗后肝脏组织学出现逆转。这些观察结果共同呼吁在PSC中有必要开展OVT的前瞻性试验。结论本文提出了一个理论模型,可以解释PSC呈现、表型和进展相关的年龄变异因素,并强调了PSC作为目前认为不可逆的疾病过程中“治疗窗口”的概念。所有经典PSC病例都源自于儿童发展期间PSC与“自身免疫性肝炎”和“IBD”相关的“憩室”胚胎起源自身免疫重叠谱系。在这个重叠中,“自身免疫性肝炎”和“IBD”保持不同的活跃度。与PSC-IBD相比,PSC-AIH更有可能随时间自行缓解。在确诊的成人患者中,亚临床PSC可能从儿童早期就已经存在。在这个动态变化的过程中,存在一个特别适合治疗的PSC窗口期,尤其是在青春期发育之前发生显著胆管纤维化和胆道梗阻之前。因此,应该加强对IBD和AIH儿童病例中PSC的筛查,特别是对那些传统方案治疗效果一般的IBD患者。本文涉及的一些名词缩写AC:自身免疫性胆管炎AIH:自身免疫性肝炎AIP:自身免疫性胰腺炎ASC:自身免疫性硬化性胆管炎CRC:结直肠癌ERCP:内窥镜逆行性胆管胰管造影IBD:炎症性肠病IBD-ASC:与IBD相关的ASCLD-PSC:大胆管PSCMRCP:磁共振胆管胰管造影OVT:口服万古霉素治疗PBC:原发性胆汁性胆管炎或肝硬化PIBD:儿童IBDPSC:原发性硬化性胆管炎PSC-PIBD:患有PSC和IBD的儿童患者SCOPE:儿童硬化性胆管炎结局SD-PSC:小导管PSCSSC:继发性硬化性胆管炎UC:溃疡性结肠炎VEO-IBD:“非常早期发病”的IBD(发病年龄小于6岁)参考文献:KellermayerR,CarboneM,HorvathTD,SzigetiRG,BunessC,HirschfieldGM,LewindonPJ.Identifyingatherapeuticwindowofopportunityforpeoplelivingwithprimarysclerosingcholangitis:Embryologyandtheoverlapofinflammatoryboweldiseasewithimmunemediatedliverinjury.Hepatology.2024May14.
 陈燕飞医生的科普号
陈燕飞医生的科普号 2024年06月02日
2024年06月02日 174
174
 0
0
 2
2
-
自身免疫性肝病,你需要了解这些
2024年3月18日是第24个“全国爱肝日”。今年的宣传主题是“早防早筛,远离肝硬化”。近年来,自身免疫性肝病发生率逐年攀升,更好的认识自身免疫性肝病,早诊早治可以最大程度保护肝脏,避免肝硬化发生。
 陈燕飞医生的科普号
陈燕飞医生的科普号 2024年03月31日
2024年03月31日 462
462
 0
0
 3
3
-
补充这种维生素能治疗原发性硬化性胆管炎(PSC)?
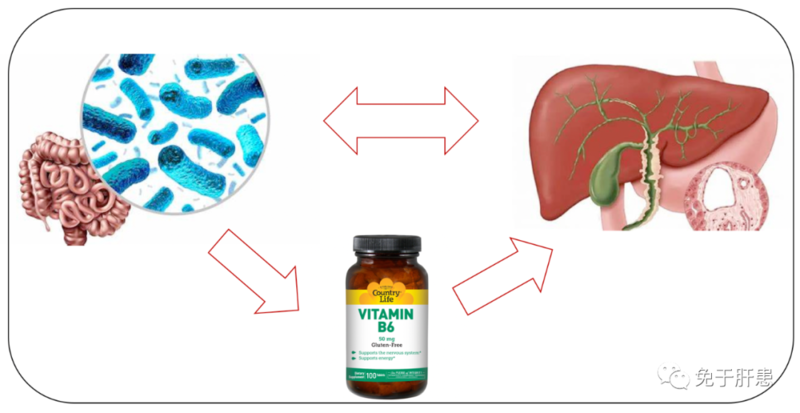
原发性硬化性胆管炎(PSC)是一种以肝内外胆管进行性炎症、纤维化和节段性狭窄为特征的慢性胆汁淤积性疾病。与PBC不同,PSC患者多为中青年男性,主要累及中胆管和大胆管,目前尚无治疗PSC的特效药物,很多患者最终发展成肝硬化,甚至肝衰竭。熊去氧胆酸能够改善患者生化指标,但对于PSC患者组织学改善、预防进展和降低死亡率效果一般。肝移植是PSC终末期患者唯一有效治疗手段。因此,亟需开发新型PSC治疗药物。最近有研究认为维生素B6缺乏与PSC预后不佳直接相关,补充维生素B6似乎是一种值得挖掘的治疗方法。PSC患者肠道菌群失衡,肠菌合成维生素B6能力下降肠道菌群能够合成人体所需的多种维生素。2021年,挪威PSC研究中心Hov教授团队在胃肠病学期刊《Gastroenterology》发表PSC患者肠道菌群研究1,首次发现PSC患者肠道细菌功能基因中与维生素B6代谢相关酶的丰度与健康对照组有显著差异,尤其是5-磷酸吡哆醛合成酶明显缺乏。5-磷酸吡哆醛合成酶是肠道细菌原位合成5-磷酸吡哆醛(PLP,维生素B6主要活性形式)的主要生物途径。靶向代谢组分析也发现,PSC患者血液中维生素B6、PLP水平也比健康对照组明显降低,吡哆醛和4-吡啶氧酸等其他维生素B6代谢产物也处于较低水平。这些维生素B6代谢产物浓度能够预测PSC患者无肝移植生存率。血浆中PLP浓度越低,患者移植或死亡风险越高。肝移植不能完全改善维生素B6缺乏状态随后,该团队对上述结果进行了追踪验证,通过扩大的多中心队列和肝移植前后的纵向对比分析,发现17-38%的PSC患者合并维生素B6低水平,血浆PLP水平低于正常下限。与PBC患者和不合并PSC的单纯IBD患者相比,PSC患者维生素B6缺乏更为明显。低维生素B6状态在肝移植后仍持续存在。在未接受肝移植和移植后复发PSC患者中,PLP浓度低是预测患者存活率降低的独立因素。这部分研究结果近期发表在肝脏病学顶级期刊《JournalofHepatology》上2。总结:维生素B6浓度下降和相关代谢通路紊乱是PSC的重要特征,与患者预后密切相关。维生素B6缺乏可能是因为肠道细菌失调,导致肠菌维生素B6合成能力下降。肝移植后,部分患者肠道菌群失调仍未纠正,导致维生素B6持续缺乏,是移植后复发的高危因素。改善肠道菌群或者补充维生素B6可能是治疗PSC的潜在方法,但有待进一步研究证实。参考文献: KummenM,...,HovJR.AlteredGutMicrobialMetabolismofEssentialNutrientsinPrimarySclerosingCholangitis.Gastroenterology.2021Apr;160(5):1784-1798.e0.BraadlandPR,...,HovJR.ClinicalandbiochemicalimpactofvitaminB6deficiencyinprimarysclerosingcholangitisbeforeandafterlivertransplantation.JHepatol.2023Oct;79(4):955-966.
 陈燕飞医生的科普号
陈燕飞医生的科普号 2023年10月15日
2023年10月15日 243
243
 0
0
 1
1
-
原发性胆管炎PbC,什么办法吗?
 武曼群医生的科普号
武曼群医生的科普号 2022年11月08日
2022年11月08日 31
31
 0
0
 0
0
-
原发性硬化性胆管炎PSC的患者要定期复查,早期发现癌症
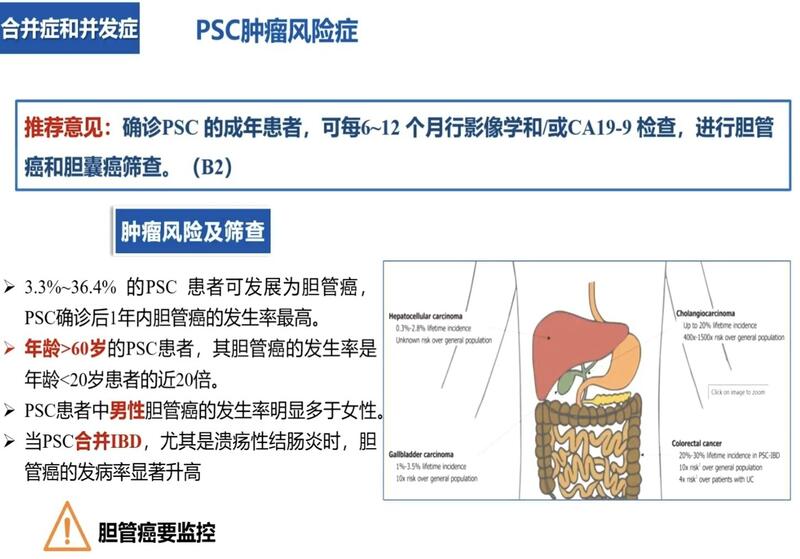
根据2021年中华医学会原发性硬化性胆管炎PSC的专家共识指南推荐,确诊PSC的成年患者,可每12个月行影像学和/或CA19-9检查,进行胆管癌和胆囊癌筛查。据统计,PSC发展为胆管癌的风比例大概有百分之3到30%左右。
 邓振忠医生的科普号
邓振忠医生的科普号 2022年10月16日
2022年10月16日 362
362
 0
0
 1
1
-
免疫性肝病禁忌:不能吃补品

 张引强医生的科普号
张引强医生的科普号 2021年10月03日
2021年10月03日 2123
2123
 7
7
 27
27
-
与炎性肠病密切相关的原发性硬化性胆管炎
原发性硬化性胆管炎(PSC)是一种慢性胆汁淤积性肝病,以肝内和/或肝外胆管炎症和纤维化所致的多灶性胆管狭窄为特征。发病原因可能是遗传和环境因素共同影响的的结果,但环境因素发挥主导作用。该病以北欧国家最常见,多见于40~50岁男性,诊断年龄为30~40岁。约70%的患者合并炎性肠病,以溃疡性结肠炎为主。PSC起病隐匿,临床表现多样,部分患者确诊时无任何临床症状,有些是查体时发现肝功能异常,经进一步检查诊断;还有一部分是炎性肠病患者常规行肝功能检查时发现胆汁淤积指标或胆管影像学异常而诊断。约3/4的患者表现为胆汁淤积性肝脏生化异常:碱性磷酸酶(ALP)和Y-谷氨酰转肽酶(GGT)水平升高。约28%~40%的患者胆红素水平升高,一旦出现黄疸则提示预后不良。转氨酶水平一般正常,如果其水平显著升高,需考虑重叠自身免疫性肝炎的可能。磁共振胰胆管造影(MRCP)是诊断PSC的首选影像学检查。典型影像学表现为肝外和/或肝内胆管局限或弥漫性狭窄,呈串珠状、枯树枝样改变或假憩室样扩张。PSC的典型病理学改变为胆管周围洋葱皮样纤维化,又称纤维闭塞性胆管炎 ,即胆管周围同心圆形纤维化和胆管腔狭窄,但相对少见。肝活组织检查对于诊断PSC并非必须。其他病理特征包括:慢性门静脉炎性改变、胆管增生、胆管扩张和不同程度的肝纤维化、肝硬化。PSC组织学表现可分为4期:门静脉炎症;门静脉周围纤维化;胆管缺失和桥接纤维化;肝硬化。PSC的药物治疗目前FDA批准的药物是熊去氧胆酸(UDCA)和奥贝胆酸(OCA)。UDCA推荐剂量为13~15mg/kg/天,分次口服。OCA推荐剂量:对于非肝硬化和肝硬化分期Child-A级的为5mg/天,连续服用3月后如效果不佳,可以逐步增加到最大剂量10mg/天;肝硬化Child-B,Child-C级,5mg/每周。需要注意的是,多部指南均不推荐将UDCA作为初诊PSC患者的常规药物,并提出了高剂量(28~30 mg/天)可能有害的警示,也不建议使用UDCA预防结直肠癌或胆管癌。我国关于PSC的指南建议:可对PSC患者尝试使用UDCA经验性治疗,但不推荐使用高剂量。各指南均不建议使用激素和免疫抑制剂治疗经典PSC。PSC患者的显性狭窄指的是为胆总管狭窄<1.5mm,或左右肝管狭窄<1 mm。对有症状患者可以进行重复内镜干预(通常是内镜扩张±支架置入)。PSC发生恶性肿瘤的风险较高,累积胆管癌发生率可达20%,合并炎性肠病者,25年累积结直肠癌发生率高达50%。该病从诊断至死亡或肝移植的生存期为10~22年。目前尚无有效的治疗药物,多数患者最终需要肝移植治疗,但移植后仍存在复发风险。PSC接受肝移植者的预后较好。一般而言,如果有肝硬化和/或门静脉高压并伴有并发症,或英国终末期肝病模型评分>49分或终末期肝病模型评分>15分时,应尽早考虑肝移植。此外,顽固性瘙痒和复发性胆管炎也是英国的肝移植适应证。胆管癌是PSC最常见的死因,应定期监测糖类抗原CA199和癌胚抗原。PSC患者胆囊息肉恶变的可能性较大,即使息肉直径
8 mm时应行胆囊切除术。建议合并炎性肠病的PSC患者每年行结肠镜检查和结肠活组织检查,未合并炎性肠病者可每5年检查1次。专业名词:ursodeoxycholic acid(UDCA);Obeticholic Acid(OCA);Primary biliary cholangitis (PBC)参考文献:1.王璐,韩英.原发性硬化性胆管炎诊治进展.中国医学前沿杂志(电子版),2020,12(2):7-12.2. Mayo Clinic.Update on Emerging Treatment Options for Primary Biliary Cholangitis. Hepatic Medicine: Evidence and Research, 2020,12,69-77.3. 中华医学会肝病学分会.原发性硬化性胆管炎诊断和治疗共识(2015).肝脏 ,2015,20(12):983-990. 刘继喜医生的科普号 2020年08月03日
2020年08月03日 2746
2746
 1
1
 2
2
-
消化科,介入科,外科,哪个科能治?
周一门诊的时候碰到一位从消化科转过来的患者,她是一位58岁的女性,门诊就诊时面色晦暗,全身皮肤发黄,仔细询问病史后得知患者8年前因为反复腹泻、便血在消化内科就诊,做了肠镜确诊为溃疡性结肠炎,结果在治疗的过程中出现了全身瘙痒、皮肤粘膜发黄,做了腹部核磁发现胆道出了问题,胆道多段狭窄,引起胆道梗阻,在消化内科做了内镜下的支架置入来缓解胆道狭窄,但是因为胆道狭窄累及多个节段,单个支架不能解决,介入科会诊说可以通过穿刺扩张胆道解除胆道梗阻,但是也不能解决全部胆道狭窄的问题,于是消化内科医生建议患者来外科咨询肝移植事宜,那么这位患者到底得了什么病需要这么多科室轮番上阵呢?今天我们就聊聊原发性硬化性胆管炎。什么是原发性硬化性胆管炎?原发性硬化性胆管炎(primary sclerosing cholangitis, PSC)是一种病因不明的慢性进行性疾病,特征为肝内及肝外胆管的多灶性狭窄,节段性扩张。PSC的发病率约为1例/100,000人年,大约70%的PSC患者为男性,诊断时的平均年龄为40岁。高达90%的PSC患者合并溃疡性结肠炎(UC)。PSC的病因尚不清楚,可能由多种因素导致,但是自身免疫造成的胆道损伤可能是它的主要发病机制,这也解释了为什么这类患者多合并有其它自身免疫性相关的疾病,如溃疡性结肠炎。文章开头提到的那位女士就是PSC合并了溃疡性结肠炎,反复在消化内科就诊。PSC可能有哪些临床表现和潜在危害?大约有15%-55%的患者被诊断PSC时并无明显症状,仅在体检时因发现血液中碱性磷酸酶(ALP)升高而被诊断。有些患者如文中提到的那位女士一样,是因为溃疡性结肠炎就诊后而被发现。胆道多节段的狭窄会引成胆汁排出受阻,造成胆汁淤积引起急性肝损伤,可逐步发展成肝硬化或肝功能衰竭。患者会出现皮肤粘膜黄染、全身瘙痒,当发展至肝硬化时会有门静脉高压症表现,如食道静脉曲张引起呕血、腹水、脾大等表现。部分患者可继发胆管结石或胆道感染,引起腹痛、发热等临床表现。PSC因胆汁淤积还可能会导致以下一些并发症:脂溶性维生素缺乏症(维生素A、D、E和K)代谢性骨病胆管细胞癌胆囊癌肝细胞癌(在合并肝硬化的患者中)结肠癌(在合并溃疡性结肠炎的患者中)PSC该如何治疗?原发性硬化性胆管炎是与自身免疫相关的,并无特别有效的治疗方法,病情随着时间而逐步进展,主要有2个治疗目标:①延缓病程进展,②治疗PSC的相关并发症。对于不同阶段的PSC可选择药物治疗、内镜治疗、介入治疗和手术治疗。在药物治疗中,目前包括熊去氧胆酸(UDCA)等各种治疗PSC的药物中并没有一个药物被证明能延长患者存活时间,只是改善症状,如缓解瘙痒、保护肝功能等。对于因胆道狭窄而出现黄疸的患者可以通过内镜下支架置入(ERCP)或介入科行经皮经肝穿刺引流(PTCD)来解除胆道梗阻。对于已经发展到肝硬化或肝功能衰竭的患者,肝移植手术是最终的解决办法。由于PSC患者容易继发各种恶性肿瘤,其中大约3.3%-36.4%的患者可发展为胆管癌,因此对PSC患者的癌症筛查非常重要,尤其对于已经合并有肝硬化、溃疡性结肠炎的患者要定期检查来监测肝癌和结肠癌的发生。尽管大部分PSC患者病情进展缓慢,中位生存期可达10到12年,但是病情的缓慢进展和逐步增加的肿瘤发生率对于患者生理和心理都是极大的煎熬,患者需要辗转在消化内科、介入科、外科之间,往往得到的答复都是没什么太好的办法,直到外科医生说:做肝移植吧。在治疗这个疾病的路上我们还有很长的路要走。
李照医生的科普号 2019年08月13日
2019年08月13日 2639
2639
 0
0
 0
0
-
原发性硬化性胆管炎最新诊治进展
诊断:首选MRC检查PSC的诊断尚无统一标准,目前认为:有胆汁淤积生化特征的患者,胆管造影检查包括磁共振胆管造影(MRC)、内镜逆行胆管造影(ERC)、经皮肝穿刺胆管造影(PTC)等显示具有典型的多灶性胆管狭窄和节段性扩张的胆管改变,并除外继发性硬化性胆管炎,则可以诊断为PSC;当胆管影像学检查正常,但临床、生化和组织学改变符合PSC者,可诊断为小胆管PSC。既往认为ERC是诊断PSC的金标准,能够很好地显示大胆管的病变,更有助于判断肝外胆道梗阻及严重程度。但ERC为有创性检查,有可能导致胰腺炎、细菌性胆管炎、出血、穿孔等严重并发症,文献报道在接受ERC检查的PSC患者中约10%因操作相关并发症住院治疗。近年研究发现,无创性检查MRC与ERC诊断PSC的准确性相似,故最新AASLD指南和EASL指南均建议对怀疑PSC的患者首先行MRC,如不能确诊再考虑行ERCP。对于PSC的诊断与治疗均较为棘手,亟需研发更安全有效的药物,以阻止疾病进展、改善预后。治疗:有效药物待开发目前尚无治疗PSC的有效药物。曾用大剂量UDCA来治疗PSC,但近年多项随机对照研究结果对其应用提出质疑。最近的荟萃分析也表明UDCA对于PSC的死亡率、组织学进展率及胆管癌发生率均无改善。Lindor等研究表明大剂量UDCA虽然能够改善生化指标,但发生终点事件和严重不良事件的风险反而均高于安慰剂组。究其原因,有学者认为可能是口服大剂量UDCA后,未被吸收的药物在结肠细菌作用下被转化为有肝毒性的胆汁酸(如石胆酸),但其确切机制尚需进一步阐明。此外,目前也没有证据表明糖皮质激素或其他免疫抑制剂对PSC治疗有效。2010年AASLD关于PSC的指南明确不推荐成年PSC患者使用UDCA治疗,也不推荐应用糖皮质激素和其他免疫抑制剂,除非PSCAIH重叠综合征患者。需要注意的是,PSC患者胆管癌和结肠癌的发生率较正常人明显升高,因此治疗过程中需加强对肿瘤的监测,动态监测肿瘤标记物,必要时行内镜检查;在对显著胆管狭窄行内镜治疗时,首先行细胞学刷检或活检以除外胆管癌。
2011年11月01日 6399
6399
 0
0
 1
1
相关科普号

乔宇琪医生的科普号
乔宇琪 副主任医师
上海交通大学医学院附属仁济医院(东院)
消化科
3580粉丝7万阅读

建磊磊医生的科普号
建磊磊 主治医师
复旦大学附属华东医院
风湿免疫科
961粉丝1.3万阅读

刘成海医生的科普号
刘成海 主任医师
上海中医药大学附属曙光医院西院
肝病科
1077粉丝30.3万阅读
-

 推荐热度5.0范晓鹏 主任医师山东大学齐鲁医院 肝病科
推荐热度5.0范晓鹏 主任医师山东大学齐鲁医院 肝病科肝病 91票
肝硬化 82票
乙肝 61票
擅长:乙肝、丙肝、肝硬化、自身免疫性肝病、药物性肝损害、酒精性肝病、脂肪肝、肝衰竭、遗传代谢性肝病、肝癌、乙肝的母婴传播阻断、不明原因的肝损害、肝脏的预防保健及调理、不明原因的腹痛及肝区不适。 -

 推荐热度4.4苟卫 主任医师青岛市第六人民医院 肝病科
推荐热度4.4苟卫 主任医师青岛市第六人民医院 肝病科肝硬化 100票
乙肝 89票
肝病 40票
擅长:擅长各种病毒性肝炎、肝硬化及并发症的诊治 -

 推荐热度4.4张引强 主任医师中国中医科学院西苑医院 肝病科
推荐热度4.4张引强 主任医师中国中医科学院西苑医院 肝病科肝硬化 160票
自身免疫性肝病 26票
肝病 25票
擅长:肝癌、肝硬化、腹水、慢性乙/丙型病毒性肝炎、胆汁淤积性肝病(原发性胆汁性肝硬化)、自身免疫性肝病、胆囊炎、肝纤维化、脂肪肝、药物肝的诊治,同时对于慢性萎缩性胃炎、胃食管反流病、肠易激综合征也有较好的疗效。




