 三甲
三甲
肝细胞癌合并胆管癌栓多学科诊治中国专家共识(2020版)
肝细胞癌(hepatocellular carcinoma,HCC;以下简称肝癌)发病率位居全世界常见恶性肿瘤第六位,每年新发病例约74万,近一半在中国。在我国,肝癌相关死亡率仅次于肺癌和胃癌,高居第三位[1-2]。临床上,肝癌多侵犯血管形成血管癌栓,亦可侵犯胆管形成胆管癌栓(bile duct tumor thrombus,BDTT)。文献[3-5]报道,BDTT发生率为0.5%~2.5%。BDTT 可沿肝内胆管向肝门部胆管延伸,甚至阻塞胆总管导致黄疸、胆道出血等。其自然病程约为1~3个月[6-7]。
目前,国际上对于肝癌合并BDTT的诊断与治疗研究较少且未达成共识。欧美国家肝癌相关指南包括巴塞罗那临床肝癌分期(Barcelona clinic liver cancer,BCLC)及美国癌症联合委员会(American Joint Committee on Cancer,AJCC)肝癌分期均未阐述肝癌合并BDTT的诊断及治疗策略,包括我国在内的东南亚地区学者则提出了外科手术、肝动脉栓塞化疗(transcatheter arterial chemoembolization,TACE)、放射治疗以及联合多种治疗手段的综合治疗[8]。
为指导我国临床肝癌合并BDTT的规范化诊断和治疗,中国医师协会肝癌专业委员会组织国内部分专家学者基于现有的循证医学证据,尤其是我国学者针对肝癌合并BDTT的临床研究成果,经反复讨论及修订,形成《肝细胞癌合并胆管癌栓多学科诊治中国专家共识(2020版)》。
本共识中的推荐意见共分5个级别,分别基于6个证据等级[9-10]。见表1、2。

1 肝癌合并BDTT诊断与分型
1.1 诊断与鉴别诊断 BDTT的术前诊断主要依靠影像学检查,肝脏占位性病变及癌栓梗阻平面以上胆管扩张是其主要影像学特征。确诊依据术后病理学检查。
1.1.1 影像学检查 (1)超声及超声造影检查。超声检查能较好显示肝癌的部位、大小、形态及梗阻以上平面胆管扩张。能较好显示肝外胆管及一级分支BDTT,位于二级分支以上BDTT较难显示。BDTT超声表现为扩张胆管内可见实性回声,呈条状及结节状,与肝癌病灶相连。超声造影可见肝癌病灶动脉期呈高增强,静脉期及延迟期呈低增强,部分病例消退不明显。(2)CT检查。CT平扫检查肝癌病灶和BDTT表现为低密度影,癌栓梗阻平面以上胆管扩张;动脉期肝癌病灶和BDTT快速强化,呈高密度影;门静脉期及肝静脉期肝癌病灶及BDTT快速退出,呈低密度影[11]。肝内胆管扩张在静脉期更为明显,但癌栓仅累及亚肝段时,可不伴有胆管扩张。(3)MRI及磁共振胰胆管成像(MRCP)检查。胆管癌栓梗阻平面以上胆管扩张是MRCP检查主要特征,MRCP检查能较好显示BDTT在肝内外胆管内的位置和分布,BDTT位于肝外胆管、左右肝管及部分二级胆管时,在MRCP检查上表现为充盈缺损;位于二级胆管以上癌栓充盈缺损较难发现,但可以通过梗阻平面以上胆管扩张来间接判断BDTT位置。(4)正电子发射断层显像(PET-CT)检查。PET-CT检查主要用于排除其他部位有无转移灶,对于细小病灶发现率较低。对于Ⅰb型和Ⅱ型BDTT ,PET-CT检查可见其摄取值与原发肝癌病灶一致[12]。(5)经皮肝穿刺胆管造影(PTC)或内镜下逆行胰胆管造影术(ERCP)。PTC和ERCP都属于有创检查,不作为诊断BDTT优先检查方法。PTC穿刺通常选择从健侧肝内胆管入路,一方面可以充分引流胆道、减少胆道压力,有利于健侧肝功能恢复[13],另一方面可以作为术后胆道引流,避免放置T管。ERCP检查能较为直观显示胆管梗阻的部位和狭窄程度,对部分病人还可以行活组织病理学检查或相应治疗。
推荐意见1:建议肝癌合并BDTT病人的影像学诊断方法首选MRI及MRCP(Ⅲ,A)。
1.1.2 鉴别诊断 BDTT须与以下常见情况相鉴别:(1)肝癌病灶压迫胆管。肝癌病灶压迫肝内胆管可致远端胆管扩张,影像学检查可见肿瘤紧贴受压胆管;但BDTT所致胆管扩张,肿瘤与扩张胆管起始部有一定距离,这是两者主要区别。(2)肝门部胆管癌。与位于第一肝门区肝癌合并BDTT表现相似,均可表现为肝门部胆管内占位性病变和左右肝胆管扩张。肝门部胆管癌表现为肝门部胆管壁增厚,胆管肿瘤增强造影检查表现为渐进性强化,而肝癌及BDTT常见表现为快进快出,胆管肿瘤相关标记物检测值升高有利于鉴别诊断[14-15]。(3)肝内胆管细胞癌。肝内胆管细胞癌可表现为肝脏占位性病变和远端胆管扩张,CT或MRI检查表现与肝癌特点不同,甲胎蛋白(AFP)和CA19-9水平有助于鉴别诊断。(4)肝癌合并胆道出血。肝癌合并胆道出血病人临床表现为腹痛、黄疸及上消化道出血。肝癌合并BDTT可表现为梗阻性黄疸、腹痛和上消化道出血。在CT影像上,胆管内新鲜出血表现为高密度,BDTT为低密度,前者动脉期无强化,后者静脉期有强化,有助于两者鉴别。(5)肝癌伴肝功能衰竭。终末期肝癌常伴有肝功能衰竭,也可表现为黄疸,但无肝内外胆管扩张。
1.2 分型 目前,BDTT的分型包括Ueda分型[16]、Satoh分型[17]、日本肝癌研究小组分型[18]等,这3种分型仅以癌栓分布范围为依据,且分型与预后关联性不强。程树群团队研究结果显示,胆红素水平和BDTT侵犯范围均与治疗手段及预后密切相关[19]。参与编写本共识专家综合分析国内及国际各BDTT分型的病情评估、治疗选择和预后判断等因素后,推荐使用程树群团队提出的BDTT分型。该分型是惟一同时兼顾BDTT范围及胆红素水平的临床分型,提出将BDTT分为肝内型和肝外型:(1)肝内型(Ⅰ型),即癌栓局限于肝内。其中Ia型为胆管二级分支及以上癌栓,Ⅰb型为胆管二级分支癌栓。(2)肝外型(Ⅱ型),即癌栓位于肝总管和(或)胆总管内,其中Ⅱa型为总胆红素<300 μmol/L,Ⅱb型为总胆红素≥300 μmol/L。
2 肝癌合并BDTT首次治疗方法
治疗原则:肝癌合并BDTT的治疗应以肝功能基础为前提,根据肿瘤情况和BDTT分型,首次治疗尽量选择能最大程度去除或控制肝癌原发病灶及BDTT的方法,强调通过联合多学科综合治疗手段延长病人生存时间和改善生存质量。
2.1 手术治疗 手术切除是肝癌合并BDTT的首选治疗方法。研究结果显示:无论Ⅰ型或Ⅱ型BDTT,梗阻性黄疸不是手术的绝对禁忌证,手术切除疗效优于非手术切除(证据级别Ⅱb),围手术期死亡率<5%,R0手术切除后5年生存率可达31.0%~43.6%,中位生存时间可达23.7~45.8个月[4-5,20-24],明显高于TACE治疗组。
手术适应证:(1)美国东部肿瘤协作组(ECOG)体能状态评分为0~1分。(2)肝癌原发病灶可切除并排除肝外转移。(3)BDTT分型为Ⅰ型、Ⅱa型。
手术方式:一般情况和肝功能良好的病人首选解剖性肝切除术,同时切除肝内病灶及相应病变胆管;肝脏储备功能良好病人行半肝及以上的大范围肝切除术能减少肿瘤残留及复发风险[4,23-26]。(1)Ⅰa型BDTT,应根据肝癌位置及癌栓范围行解剖性肝段或半肝切除术。(2)Ⅰb型及Ⅱ型BDTT,应在其预留剩余肝体积(future liver reserve,FLR)足够的条件下,尽量采用病变侧半肝切除或扩大半肝切除术。(3)Ⅱ型BDTT,建议行前入路肝实质离断联合胆总管切开取栓,建议采用“q型胆管切开取栓法”(见图1)[27]。(4)术中发现不能R0切除病人,可行姑息性肝癌切除联合BDTT取栓术,术后综合治疗可提高病人生存质量及延长生存时间[5]。(5)癌栓与胆管处理:肝内BDTT通常与肿瘤整块切除。对于肝外BDTT,是肝外胆管切除(bile duct resection,BDR)还是胆总管切开取癌栓目前尚无定论[4,20,23,28]。大部分BDTT呈膨胀性铸型生长, 与胆管壁多无紧密粘连,易于剥离[29-30],不建议常规行BDR;但若癌栓与胆管壁粘连紧密且冰冻切片病理学检查阳性,则建议联合BDR。
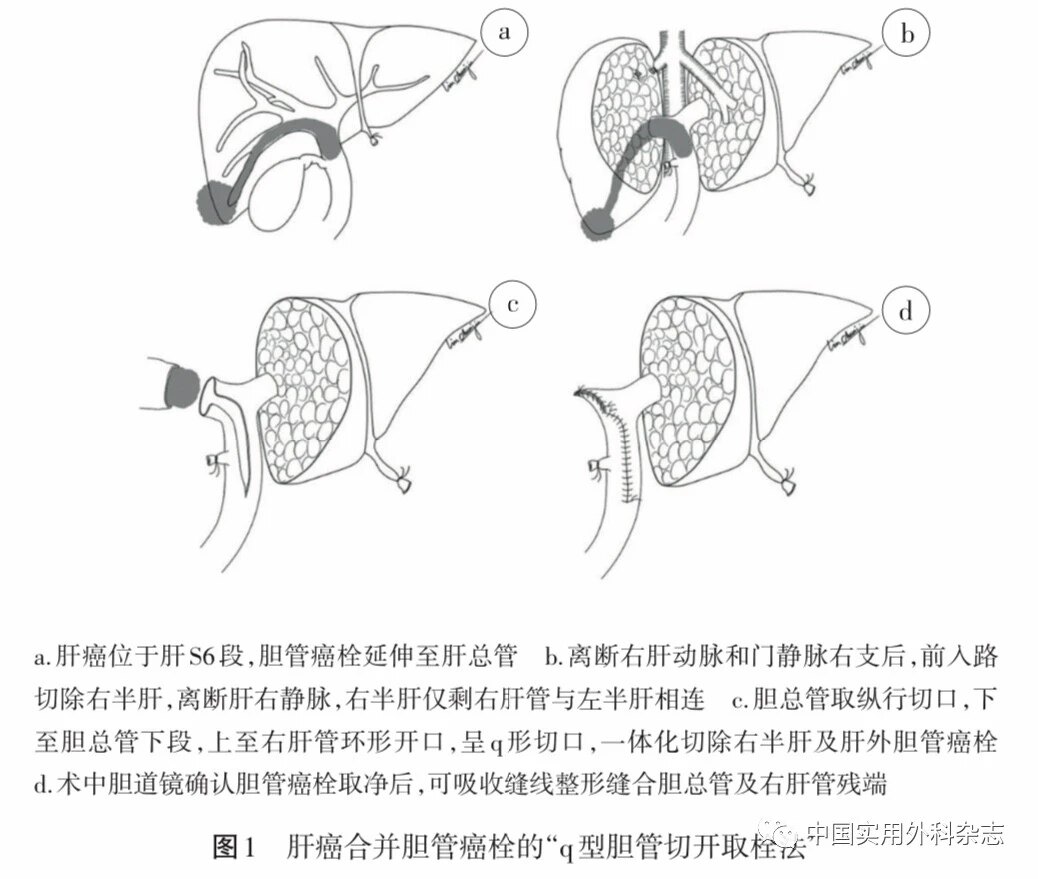
围手术期处理:(1)术前减黄的标准。①Ⅱb型转化为IIa型后方可手术(证据级别Ⅱb)[19]。②合并急性胆管炎病人。③梗阻性黄疸时间>4周,合并明显营养不良尤其是高龄病人。(2)术前胆道引流首选经皮肝穿刺胆道引流术(PTCD),可以避免ERCP操作过程中潜在的肿瘤播散、癌栓出血及胆道感染等风险(证据级别Ⅲ)。(3)预留FLR<40%病人应积极行PTCD减黄后联合其他手段,待FLR增加至≥40%,总胆红素<50 μmol/L再行手术治疗[27]。
提高术后生存率措施:(1)辅助性TACE。术后辅助性TACE可降低BDTT病人的术后复发率,延长生存时间[31](证据级别Ⅱb)。(2)术后化疗[32]或辅助性靶向治疗可能对延长病人生存时间有益(证据级别Ⅲ)。
目前,尚无肝移植治疗肝癌合并BDTT的大宗病例报道。文献[29,33]报道肝移植治疗肝癌合并BDTT的5年生存率可达20%~50%,但复发率高达46.2%~80.0%。肝移植术后高复发率制约其在肝癌合并BDTT中应用。对于肝硬化严重、无法接受常规手术治疗的肝癌合并BDTT病人,肝移植可以作为一种值得探讨的治疗方式。
推荐意见2:ECOG 0~1分、肝癌原发病灶可切除、Ⅰ型或Ⅱa型BDTT病人,可行手术切除(Ⅱb,A)。
推荐意见3:ECOG 0~1分、肝癌原发病灶可切除、Ⅱb型BDTT病人,建议术前行PTCD,转化为Ⅱa型后再行手术切除(Ⅱb,B)。
推荐意见4:建议BDTT病人术后行辅助性TACE(Ⅱb,B)。
2.2 非手术治疗 适用于肝肿瘤不可切除、伴肝外转移或Ⅱb型BDTT病人,目的在于及时胆道引流改善肝功能,控制肝内病灶及癌栓生长,延长病人生存时间。
2.2.1 胆管腔内区域性治疗 Ⅱ型BDTT的胆管腔内区域性治疗包括内镜下取栓、腔内BDTT消融和胆道引流等,目的在于迅速解除胆道梗阻。随着内镜技术的进步,胆道取栓或BDTT消融的成功率已达89%~100%[34-35]。与单纯胆道支架相比,胆管腔内区域性治疗可最大程度控制BDTT,延长胆道通畅时间,可依据病人实际情况谨慎实施。治疗过程中需注意胆道出血、胆汁渗漏等并发症。
胆道引流包括内镜下胆道支架植入术(ERBD)、超声内镜下胆道引流(EUS-BD)和PTCD等,适用于无法手术治疗的BDTT伴胆道梗阻病人。胆道引流可明显减轻病人临床症状、改善肝功能,是转化手术或进一步实施其他非手术治疗的前提。文献[6-7,36]报道,BDTT病人出现黄疸后其中位生存时间仅为1~3个月,行胆道引流后可明显改善病人生存质量,并延长中位生存时间至3~7个月。非手术病人胆道引流首选内胆道支架,可通过ERCP或者经皮胆道穿刺植入,文献[35]报道金属支架的通畅时间较塑料支架延长1~3个月。EUS-BD适用于行ERCP治疗失败的BDTT病人,包括超声内镜下对接技术(EUS-RV)、超声内镜下顺行途径技术(EUS-AG)和超声引导下经腔内胆汁引流[包括胆管十二指肠吻合术(即EUS-CDS)和肝胃吻合术(即EUS-HGS)],总体成功率为77%~94%,并发症发生率5%~27%[37],可依据病人实际情况谨慎实施。PTCD适用于无法行内引流的BDTT病人,需注意防止脱管、胆汁渗漏及水电解质失衡等。
推荐意见5:肝癌原发病灶不可切除、Ⅱ型BDTT伴梗阻性黄疸的病人行胆道引流(Ⅱb,A),同时可谨慎行胆道取栓或消融术(Ⅱb,B)。
2.2.2 TACE TACE是治疗不可切除肝癌合并BDTT的常用方法。一项韩国的回顾性调查结果显示,BDTT病人行TACE后的中位生存时间为6.0个月,优于保守治疗组的1.6个月[36]。海军军医大学东方肝胆外科医院报道BDTT病人行TACE治疗后中位生存时间为11.0个月,明显优于保守治疗组的3.0个月[5]。TACE与其他治疗方法如放射治疗、靶向治疗等联用则可能取得更佳疗效。国内的一项研究结果显示,TACE联合125I粒子支架治疗肝癌合并BDTT病人,其中位生存时间可达11.0个月,高于单纯TACE组的9.0个月,建议TACE联合其他治疗方法以提高疗效[38]。
推荐意见6:肝功能Child-Pugh A或B级、ECOG 0~1分、肝癌原发病灶不可切除的BDTT病人可选择行TACE(Ⅱb,B),建议与其他治疗如放射治疗、靶向治疗等联用(Ⅱb,A)。
2.2.3 放射治疗 随着放射治疗技术的进步,三维适形放射治疗、调强适形放射治疗和立体定向体部放射治疗等可在提高靶区剂量的同时,最大限度保护正常肝组织,在肝癌治疗中发挥越来越重要的作用。Iwamoto等[39]报道45例肝癌合并BDTT或门静脉癌栓(PVTT)病人,放疗的局部控制率为42.5%,中位总生存期(OS)可达13.3个月;Suh等[7]的研究结果显示,放疗对于BDTT的局部控制率可达67%;Huang等[40]研究发现,放疗联合TACE的中位OS为13.4个月;一项纳入641例梗阻性黄疸病人的Meta分析结果显示,内放疗联合胆道支架与仅行胆道支架相比,可明显延长支架通畅时间和总体生存时间,建议肝肿瘤不可切除的BDTT病人选择放射治疗,并可与其他治疗方式如TACE、胆道支架等联用[41]。
靶区定位采用 CT 和 MRI 检查图像融合技术确定肝癌大体肿瘤的范围再外加5~10 mm。原发肿瘤和胆管癌栓可分开照射。放射治疗最佳剂量和分割目前尚无足够证据,但文献[7]报道放射总剂量应>45 Gy。
推荐意见7:肝功能Child-Pugh A或B级、ECOG 0~1分、肝癌原发病灶不可切除的BDTT 病人可选择行放射治疗,放射治疗靶区可包括原发灶和BDTT或仅BDTT(Ⅱb,B),建议同时联合TACE(Ⅱb,A)。
2.2.4 抗病毒治疗 HBV持续感染是乙型病毒性肝炎相关肝癌发生、发展、复发的重要危险因素,更是肝癌病人死亡的危险因素,抗病毒治疗有助于减少术后复发及改善肝癌病人生存[30]。BDTT虽已是肝癌发展的中晚期阶段,抗病毒治疗仍不容忽视,如何选用药物及用药时机可参考《HBV/ HCV相关性肝细胞癌抗病毒治疗专家共识》[42](Ⅰa,A)。
2.2.5 系统性治疗 阿特利珠单克隆抗体联合贝伐珠单克隆抗体(T+A)[43]、索拉非尼和仑伐替尼已被cFDA批准为不可手术或转移性肝癌的一线治疗药物,可适用于肝功能Child-Pugh A级所有类型肝癌合并BDTT病人(Ⅰa,A)[44-45]。瑞戈非尼或阿帕替尼可用于一线治疗失败病人的二线治疗(Ⅰa,A)[46]。
EACH的研究结果显示,含奥沙利铂的化疗方案(FOLFOX)对晚期肝癌可获得部分客观疗效,病人耐受性尚好,一般情况较好或者已合并肝外转移的病人可考虑应用(Ⅰb,A),建议同时对癌栓进行区域性治疗[47]。
免疫检查点阻断剂(CTLA-4阻断剂、PD-1/PD-L1阻断剂等)有一定的抗肿瘤作用,其与靶向药物联用可能获得更好的效果[48],在肝癌合并BDTT治疗中的作用有待大规模临床研究加以验证。
对于肝功能 Child-Pugh C 级,合并大量腹腔积液或消化道出血、肝性脑病的病人,因无法耐受针对肿瘤的治疗,建议行支持治疗。若进行支持治疗后肝功能有所好转,则可依据诊疗路径考虑相应的治疗。
此外,对于不可切除肝癌合并BDTT病人,可采用适宜的中医中药治疗改善症状,减轻放化疗不良反应,提高生存质量。
推荐意见8:建议BDTT 伴乙型病毒性肝炎的病人给予核苷类似物抗病毒治疗,并选择强效高耐药屏障药物(Ⅰa,A)。
推荐意见9:T+A方案、索拉非尼和仑伐替尼可作为治疗肝癌合并BDTT 病人的基本药物(Ⅰb,A),建议与其他治疗方法如手术、TACE、放射治疗等联用;瑞戈非尼及阿帕替尼可用于索拉非尼或仑伐替尼耐药的二线治疗(Ⅰb,A);靶向药物与免疫检查点抑制剂联合方案适应于一线或二线系统治疗(Ⅰb,A)。
推荐意见10:对于肝功能 Child-Pugh C 级,合并大量腹腔积液或消化道出血、肝性脑病表现的病人,建议仅行支持治疗(Ⅰa,A)。
3 肝癌合并BDTT开展多学科协作诊治流程及路径
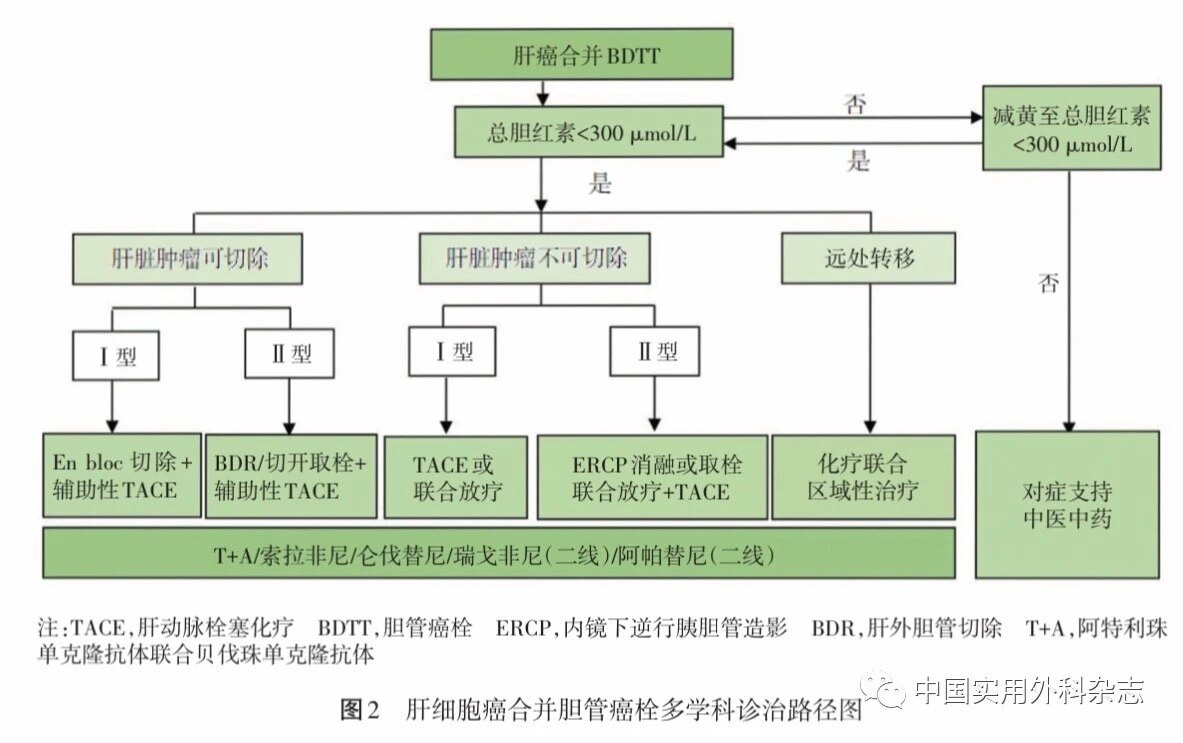
多学科综合治疗协作组(multidisciplinary team,MDT)诊疗模式通过多学科的协同诊疗,有利于最大限度地发挥各个学科的专业优势,使病人获益最大化。肝癌合并BDTT的诊断与治疗特别需要通过MDT制订诊疗方案。肝细胞癌合并BDTT多学科诊治路径见图2。首先,评估BDTT病人肝功能状态, Ⅰ型和Ⅱa型BDTT病人可根据肿瘤是否可切除、BDTT类型及有无远处转移等选择相应的综合治疗。原发病灶可切除的Ⅰ型或Ⅱa型BDTT病人首选手术治疗,术后辅以TACE治疗。原发病灶不能切除的I型BDTT病人首选TACE联合放疗,Ⅱa型病人则优先考虑胆管区域治疗联合TACE和放疗。Ⅱb型病人首先给予胆道引流和或胆管内区域治疗,转化为Ⅱa型则可行相应治疗,若肝功能改善不明显则建议仅行支持治疗。肝功能Child-Pugh C级BDTT病人仅行对症支持治疗。若合并远处转移,Ⅰ型BDTT病人可考虑行系统化疗,Ⅱ型则首先给予胆管内区域治疗和(或)系统化疗。索拉非尼、仑伐替尼适用于肝功能Child-Pugh A级的BDTT病人,瑞戈非尼适用于索拉非尼/仑伐替尼耐药的BDTT病人的二线治疗,也可采用靶向药物与免疫检查点抑制剂的联合治疗方案。
我国肝癌病人在病因、肿瘤生物学行为等方面与欧美国家病人存在差异,且合并BDTT病人病情复杂。目前,肝癌合并BDTT治疗相关报道较少,现有的专家共识推荐意见循证医学级别还较低。因此,应充分利用我国病例资源,建立更科学的分型标准。通过开展更多的随机对照研究,开发、验证更多有效的BDTT诊断与治疗方法,对已有共识内容不断补充和更新。同时也要重视我国中医中药辨证论治整体治疗观在肝癌合并BDTT中的应用。
此外,还需补充以下两点:(1)对于BDTT合并门静脉癌栓或肝静脉/下腔静脉癌栓,相关研究较少,暂可同时参照《肝细胞癌合并门静脉癌栓多学科诊治中国专家共识(2018年版)》[49]和《肝细胞癌合并肝/下腔静脉癌栓多学科诊治中国专家共识(2019版)》[50]进行治疗。(2)BDTT同时合并门静脉高压症的诊断及治疗可参考相关共识[51]。
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论