 三甲
三甲
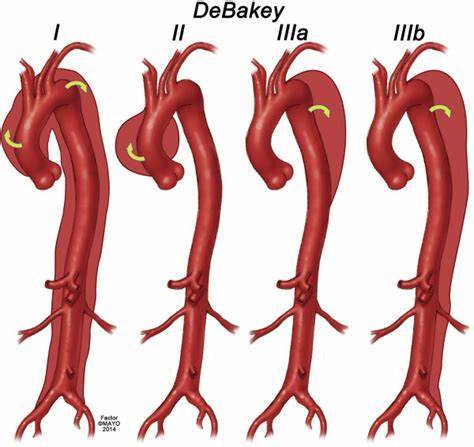
主动脉夹层的病因
【摘要】
我们从不同角度讨论了主动脉夹层(AD)的病因。主动脉夹层的发展需要两种病理条件:中层退行性病变和机械壁应力。首先,中层退行性病变的组织病理学结果被假设是由于弹性纤维和相互连接的弹性纤维的丢失。对血管的损伤在形成进入部位中起着关键作用。中层退行性病变的临床原因包括高血压、主动脉瘤、阻塞性睡眠呼吸暂停和结缔组织疾病。第二,机械壁应力被认为是由血流引起的切应力以及高血压和主动脉根部运动引起的。有必要进行进一步的研究,以寻找在AD发生之前导致中层退行性病变的机制。
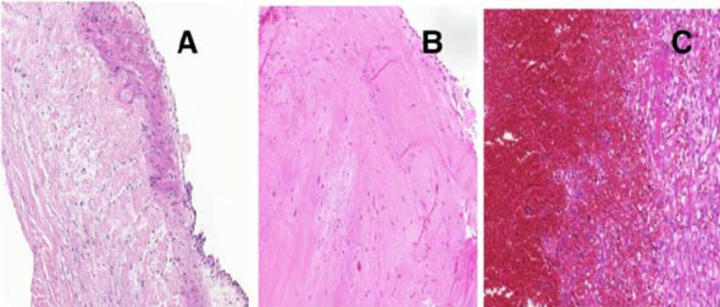
主动脉壁的组织学表现。囊性中层变性(A)占75%,纤维化(B)占6%,动脉粥样硬化(C)占13%
1 引言
急性主动脉夹层(AAD)是一种潜在的灾难性疾病,其病因已被描述,但仍未完全阐明。此外,尽管高血压[1,2]和马凡综合征(MFS)[3]是众所周知的主动脉夹层(AD)的原因,但它们与这种疾病的关系并不完全清楚。本文从不同角度对AD的病因进行了探讨。

马凡综合征
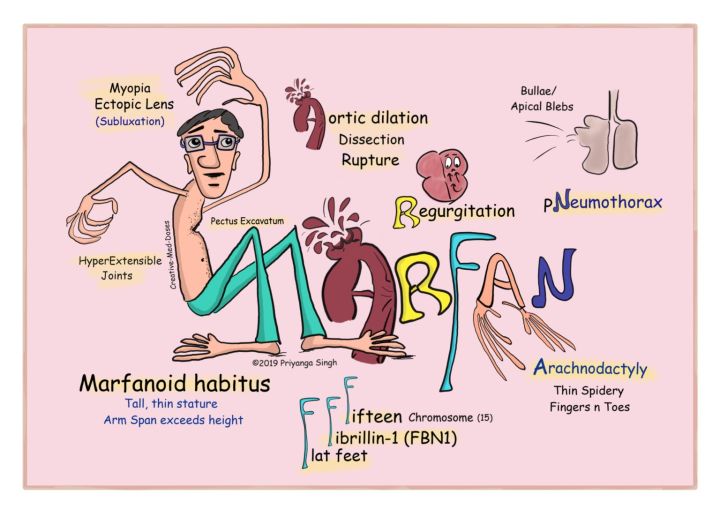
马凡综合征
AD可根据大动脉存在的特定情况而发展。这被认为涉及“主动脉中层退行性病变”,这个想法最初是在1958年报道的[1]。除了对创伤或医源性疾病等事件的反应外,AD的病因将根据这一过程进行解释。此外,AD的发展需要一个与在主动脉壁内膜破口相关的“触发器”。据推测,触发因素是血液流动,这会在主动脉壁产生剪应力。因此,主动脉夹层的发生需要两种病理条件:中层退行性病变和主动脉壁的机械剪应力。我们将从这两个病理过程来解释AD的病因。
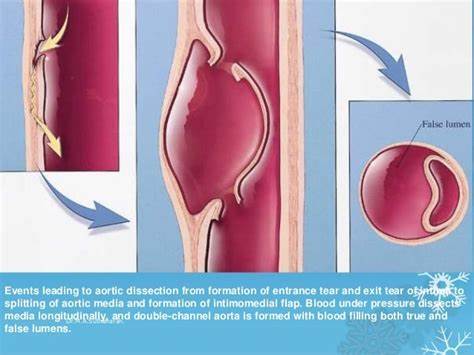
主动脉夹层 内膜破口
2 主动脉内膜退行性病变
2.1 病理变化
主动脉中层退行性病变被认为是AAD发生的一种特殊情况。囊性中层坏死(CMN)是几种典型的主动脉壁中层退行性变之一。然而,中层退行性病变的术语随着时间的推移而变化。最近,诸如CMN和间质坏死等较老的术语已被诸如粘液样细胞外基质堆积、弹性纤维断裂和/或丢失、以及平滑肌细胞核丢失等术语所取代。
2.1.1 囊性中层坏死
传统上,CMN一直被认为是AD的主要原因。最近,据报道,在没有MFS的AD患者中,CMN的发生率仅为8-19%[5-7],其中CMN的程度较轻。相比之下,40-82%的患有MFS的AD患者[5,7]观察到了它,程度很严重。因此,如果没有结缔组织紊乱(CTD)如MFS的存在,CMN现在不被认为是AD的主要原因。轻度的CMN随着年龄的增长而被观察到,并且在高血压患者中也更常见[8]。
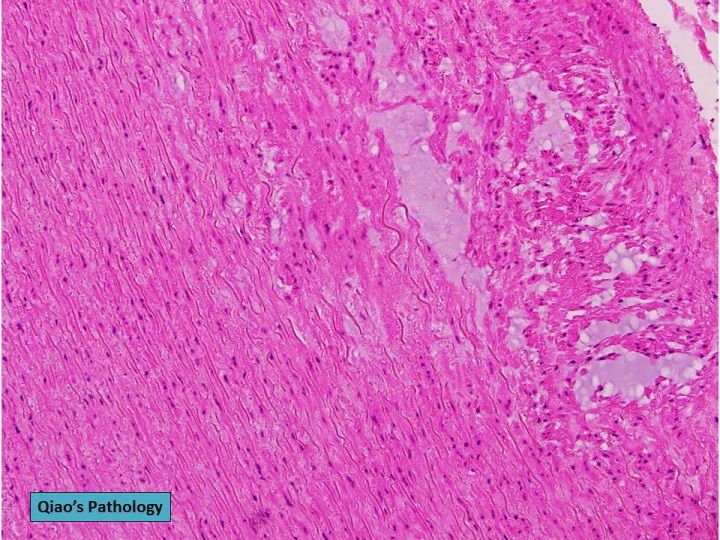
囊性中层坏死
2.1.2 弹性纤维损耗
弹性纤维是负责主动脉中层弹性的结缔组织中最重要的成分。一些报告描述了在AD[7,9](图1)中观察到的弹性纤维是如何减少的。相比之下,其他人报告说,弹性纤维丢失在这种疾病中并不显著[10]。此外,在AD的每种情况下,弹性纤维丢失的程度可能并不一致。
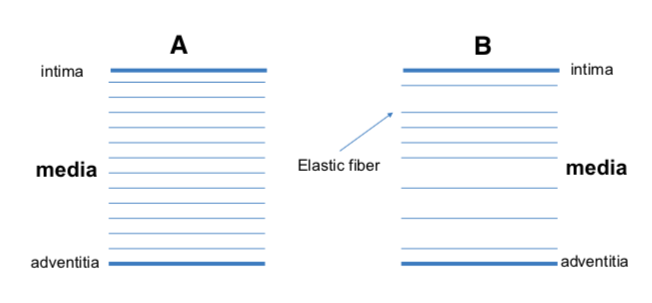
与对照组(A)相比,主动脉夹层(B)的弹性纤维丢失明显
2.1.3 结合弹性纤维损耗
相互连接的弹性纤维是结缔组织中将弹性纤维捆绑在一起的组件,只能通过电子显微镜才能看到。据报道,AD[9,11]和高血压患者[11](图2)失去了相互连接的弹性纤维。这在主动脉中膜退变的病因学上被认为是必不可少的。相互连接的弹性纤维的丢失可能导致难以平衡存在于主动脉壁内膜和外膜之间的剪应力,导致内膜破裂和脱落,并导致进入部位的形成[9]。
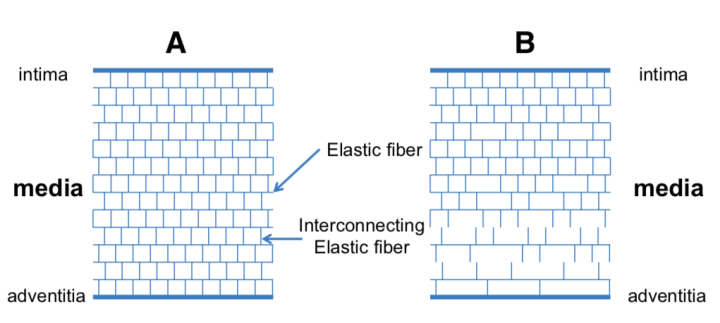
与对照组(A)相比,主动脉夹层(B)患者外中膜中相互连接的弹性纤维的丢失更为明显
3 引起主动脉壁中层退变的疾病(表1)
3.1 先天性疾病:结缔组织病
弹性纤维是结缔组织的组成部分。CTD显示弹性纤维减少且不完整,导致脆弱的结缔组织,如主动脉壁、骨和肺。主动脉中层的强度是决定主动脉壁脆性的最重要因素;CTD随后会导致AD和主动脉瘤的发展。CTD也经常是由遗传疾病引起的。这导致人们怀疑,患有AAD且年龄在40岁以下的患者可能患有遗传疾病。
3.1.1 MFS(马凡综合征,伴有FBN1突变)和血管型Ehler-Danlos综合征(vEDS;伴有COL3A1突变)是众所周知的遗传性疾病。最近,Loeys-Dietz综合征(LDS)患者被证明存在TGRBR1或TGFBR2突变[12],而其他具有新基因突变的CTD,如ACTA2[13]、SMAD3[14]和TGFBR[15]等,也经常被发现。然而,所有导致CTD的基因突变还没有完全阐明。
马凡综合征MFS是由FBN1突变引起的最常见和最具代表性的CTD,导致骨骼、眼部和心血管问题。MFS最常见和最严重的发现是主动脉根部扩张[16],这导致A型AD;在这种情况下,积极进行手术修复。
3.1.2 Loeys-Dietz综合征(LDS)是由TGFBR1或TGFBR2突变引起的。LDS的临床表现通常是多种多样的:一些病例有马凡样外观,而另一些患者看起来完全正常[17]。
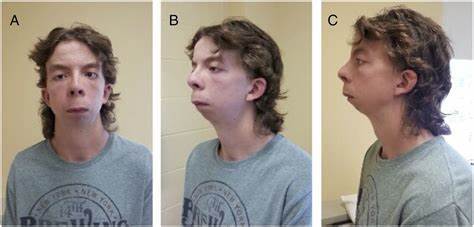
Loeys-Dietz综合征
悬雍垂双裂、末端增厚和主动脉分支血管扩张,如腹主动脉和肠系膜上动脉,被认为是LDS的特征[12];然而,这些并不常见。与MFS相比,结缔组织异常偏向血管异常。如果患者有异位晶状体,则排除LDS。引起A型AD的主动脉根部扩张也是LDS的一个非常重要的发现。与MFS相比,动脉夹层倾向于血管直径较小[12]。例如,对于升主动脉直径≥为42 mm的Loeys-Dietz综合征患者,建议及早手术干预,而在马凡综合征患者中,升主动脉直径为≥45 mm的患者才建议手术[18]。
3.1.3 血管型Ehler-Danlos综合征 是EDS的一种,由COL3A1基因突变引起。VEDS的主要特征是:皮肤半透明,易擦伤,动脉脆弱,肠穿孔或子宫穿孔。尤其是容易擦伤(97%)和皮肤半透明(77%)的患者[19]。有弹性的皮肤是经典型EDS的特征,而不是vEDS的特征。这种疾病的动脉病变通常不包括主动脉;相反,更常见的是肠系膜上动脉、脾动脉、肾动脉和髂总动脉[19]。受影响动脉的夹层和破裂是vEDS患者最常见的死亡原因。与MFS和LDS相比,vEDS患者较少发现主动脉根部扩张;然而,主动脉更脆弱。因此,手术只考虑在可能致命的并发症中进行,因为组织无力[18]。

Ehler-Danlos综合征
ACTA2突变ACTA2突变导致平滑肌异常,导致CTD[13]。带有ACTA2突变的患者没有任何明显的身体异常,因此仅凭身体外观很难诊断,就像MFS一样。
3.1.4 二瓣叶主动脉瓣 在40岁以下的AD患者中有9%的患者存在二瓣叶主动脉瓣(BAV);在所有AAD患者中有2%的患者存在BAV[20]。BAV的病因目前仍在讨论中,被认为与AD的发展有两个方面的联系:第一,BAV引起的主动脉狭窄和返流可能对升主动脉壁造成机械损伤,导致主动脉扩张和AD[21]。其次,BAV可能是由遗传性疾病合并CTD引起的[22],导致主动脉扩张和AD,因为主动脉壁脆弱[23]。已有报道在BAV患者中发现GATA2[24]和NOTCH1[25]突变;然而,只有一小部分患者携带这些突变。因此,BAV的主要原因,无论是血液动力学疾病还是遗传疾病,仍不清楚。
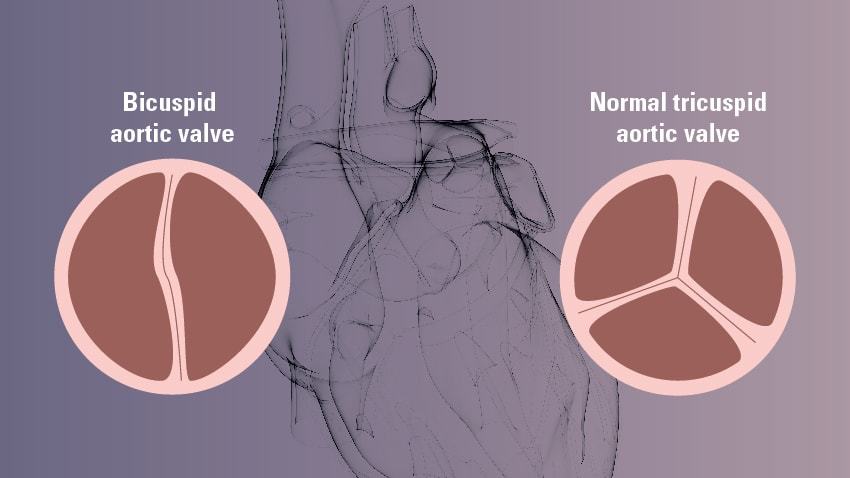
二瓣叶主动脉瓣
其他SMAD3突变会导致动脉瘤-骨关节炎综合征,其特征是动脉动脉瘤、骨骼异常和骨关节炎[14]。
引起AD的主动脉根部扩张是Smad3突变的一个重要临床特征。TGFB2突变会导致马凡样的临床特征,如主动脉根部扩张和骨骼异常。然而,异位晶状体不存在,个体不符合MFS的诊断标准,并且AD不会像MFS中发现的那样在年轻时发生[15]。
遗传疾病引起的主动脉夹层病例所占比例是多少?MFS患者占所有AD患者的5%[3]。然而,对于患有AD和主动脉瘤的年轻患者,我们发现60%的患者有MFS,6%的患者有LDS,5%的患者有ACTA2突变,而另外29%的患者来源不明[26]。因此,除MFS外的CTD病例可能不到所有合并AD和主动脉瘤的MFS病例的一半。MFS和其他CTD可能占所有AD病例的10%或更少。
3.2 获得性疾病
3.2.1 高血压 在50-86%的AD患者中存在,并通过两种方式与AD的发展相关:1、2、5、27-30。首先,它与主动脉壁中层退行性变有关。高血压会减少滋养三分之一的外主动脉中膜的血管的血流量。因此,高血压会导致外中膜的缺血和损伤,导致后者弹性降低[31]。其次,高血压引起了主动脉壁的机械剪应力[32],导致了进入部位的形成。因此,高血压既与有利于AD发展的特定条件有关,也与产生进入部位的机械应力有关。
高血压
高血压的危害
3.2.2 阻塞性呼吸睡眠暂停综合征 近来,阻塞性呼吸睡眠暂停综合征(OSA)被证明是AD的一个重要原因[33,34]。Yanagi et al.。报告称,在所有AAD病例中,发生OSA的比例为13%[34]。然而,很难完全理解OSA是如何影响AD的发展的。一种假设是,呼吸暂停期间胸腔内负压可能会增加主动脉壁的跨壁压力,从而造成损害。引起高血压的交感神经活动增加[33]可能是导致内膜破口所必需的。相反,一项队列研究表明,OSA与AD风险的增加无关[35]。我们的结论是,在住院期间,应在AD患者中积极寻找OSA的证据。
阻塞性呼吸睡眠暂停综合征
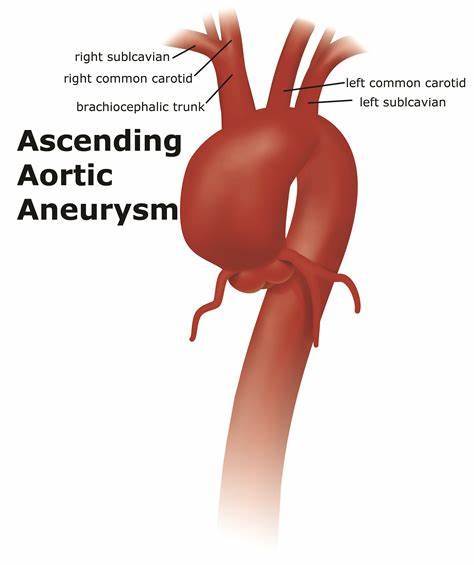
3.2.3 真性主动脉瘤 我们以前发现真性主动脉瘤是所有AAD患者中24%的并发症;9%的AAD患者特定起源于主动脉瘤[36]。我们应该记住,真正的动脉瘤的最终特征不仅包括主动脉破裂,还包括AD的发展。在主动脉瘤的第一阶段,当其结构(内膜、中膜和外膜)完好时,主动脉壁扩张。然而,在最后阶段,由三种壁结构组成的动脉瘤壁会破裂并变薄。因此,AD有时会发生在发展成这种破裂和薄的动脉瘤样壁之后。
升主动脉瘤
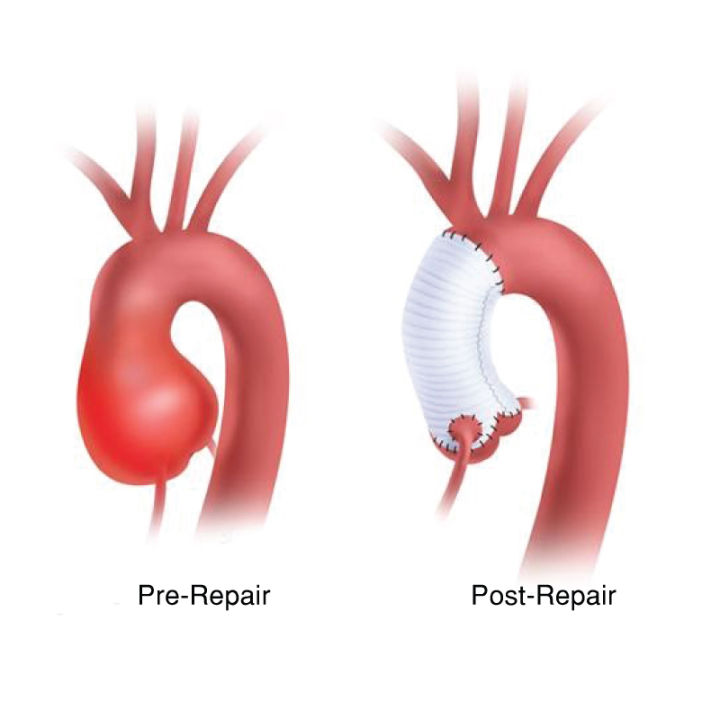
主动脉根部瘤
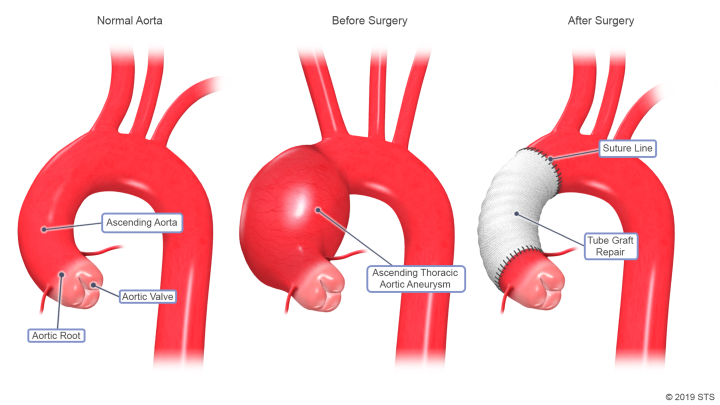
升主动脉瘤
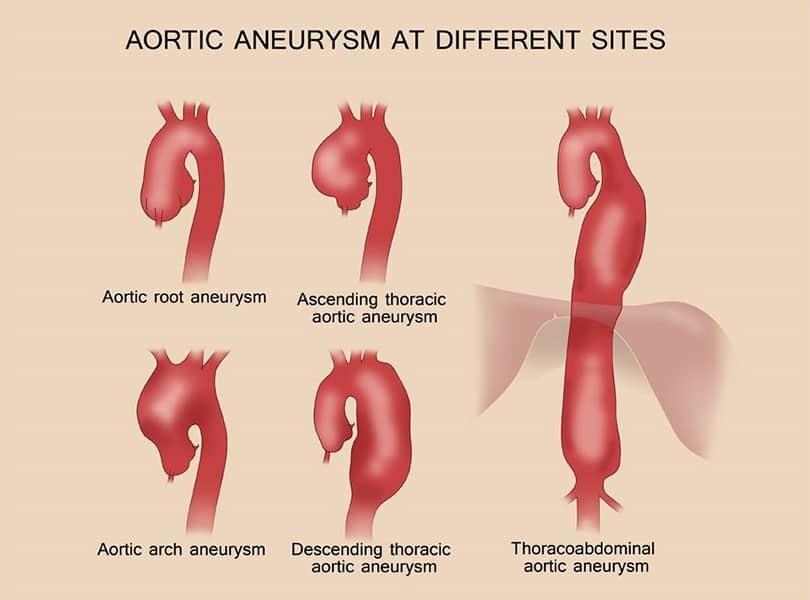
主动脉瘤
3.2.4 炎症性大动脉疾病 炎性大动脉疾病,如Takayasu大动脉炎、巨细胞性大动脉炎和Beh?et病,以前曾在病例报告中描述过,但不太可能是AD的原因。Takayasu大动脉炎的主要炎性病变是由主动脉中层和中层坏死以及弹性纤维断裂组成[37]。典型的大动脉炎性病变见于颈部血管和锁骨下动脉。主动脉根部也是常见的炎性病变部位,升主动脉扩张的主动脉瓣反流与AD有关。
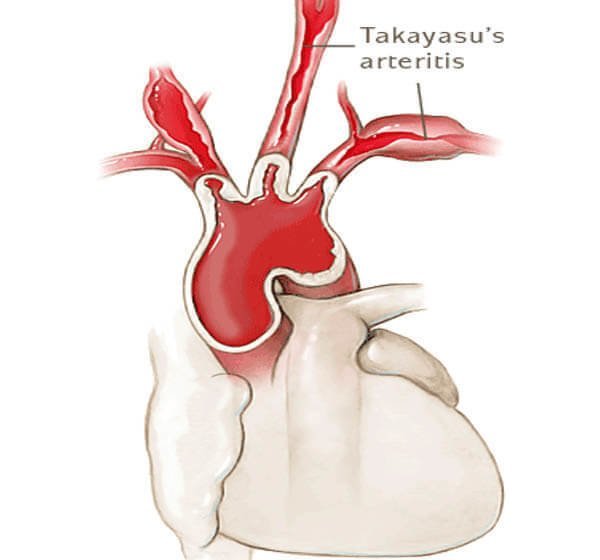
大动脉炎
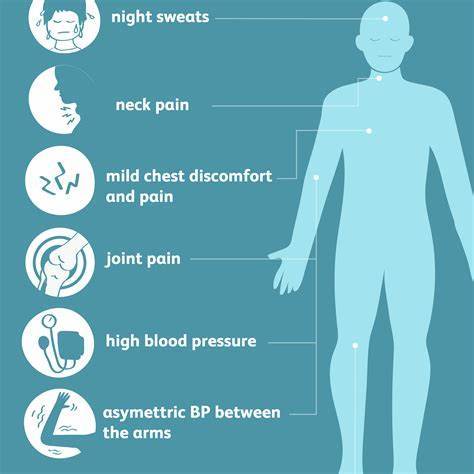
大动脉炎 症状
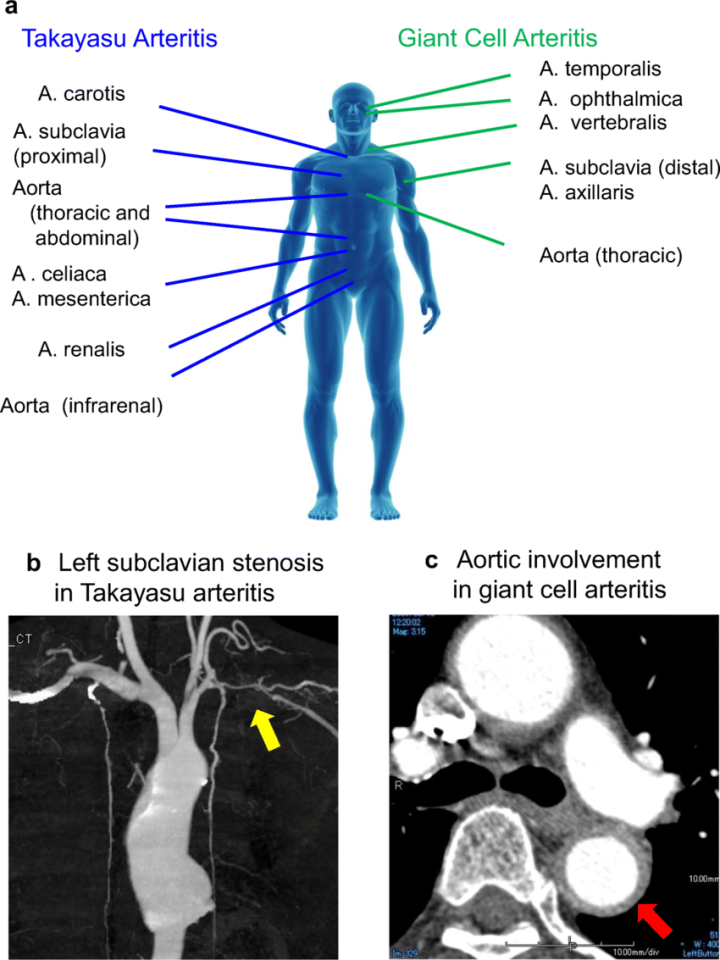
大动脉炎和巨细胞大动脉炎比较
巨细胞性大动脉炎(GCA)和大动脉炎(TAK)的血管分布模式。(A)大动脉炎(TAK)主要影响主动脉以及胸腹主动脉的主要分支。几乎所有的患者都有大动脉炎。巨细胞动脉炎(GCA)主要表现在主动脉的2-5支,包括病变累及颞动脉。只有一小部分GCA患者发生大动脉炎,主要是胸主动脉。(B)诊断为大动脉炎的29岁女性患者,CT血管成像显示左锁骨下动脉狭窄。(C)增强CT扫描显示胸主动脉壁增厚,确诊为GCA的66岁女性
3.2.5 怀孕和妊娠期间使用类固醇 循环血量增加会导致血压升高,并导致主动脉壁压力。因此,怀孕被认为是AD的一个危险因素[38]。然而,许多患有AD的孕妇通常患有CTD,如MFS,而没有MFS的孕妇不太可能发展为AD[39]。长期使用类固醇还会干扰胶原纤维的产生,导致主动脉壁脆弱和AD的发生[40]。

怀孕

类固醇激素的使用
3.2.6 动脉粥样硬化 动脉粥样硬化与主动脉夹层的关系先前已在别处讨论过[41,42]。AD可发生在动脉粥样硬化引起的穿透性溃疡部位,但发生的频率并不高。总的来说,动脉粥样硬化被认为与AD的发展无关[41]。在AD患者中,动脉粥样硬化的程度可以从轻度到中度,而有时观察到AD的发展在主动脉瘤的动脉粥样硬化部位停止[36]。
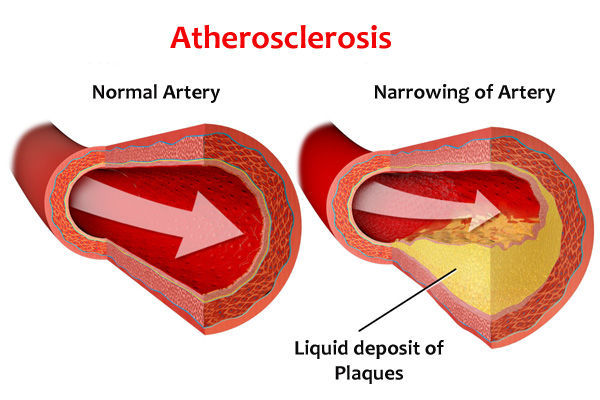
动脉粥样硬化
4 主动脉壁应力
4.1 切应力作用下内膜缺血引起的主动脉内膜破裂
主动脉壁由三层组成:内膜、中层和外膜。中层是最厚的一层,负责大动脉的弹性性质。三分之二中层的营养物质和氧气是由主动脉腔的灌流提供的,而三分之一的中层外部的营养物质是由血管供应的[43]。如上所述,高血压损害了富含外部介质的血管,导致外部内侧缺血和弹性降低[31]。相比之下,三分之二的内部中层不太可能是缺血的,其弹性也不太可能降低。因此,由于血流与高血压成正比[32],内、外介质弹性性质的差异加上主动脉壁的剪应力,最终可能导致各层的脱离,从而导致AD[31]。大多数AD发生在三分之一的外部中层中[44]。
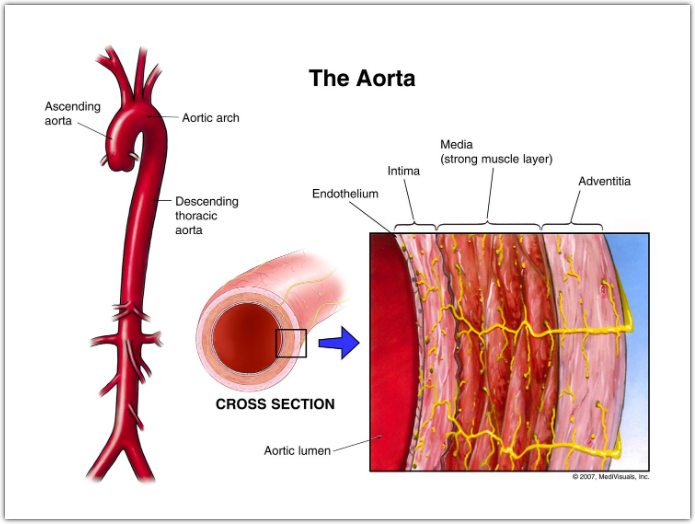
主动脉壁由三层组成:内膜、中层和外膜
4.2 主动脉根部的垂直摆动运动
根据心脏的跳动,主动脉根部垂直移动。主动脉由来自主动脉弓的三条分支血管固定。因此,在这三条血管的起始处,经常形成入口部位的主动脉暴露于强烈的机械应力[45]。事实上,有限元模型显示,在距主动脉根部2厘米远的地方,头臂动脉和主动脉峡部的起始处会受到很大的压力[46]。
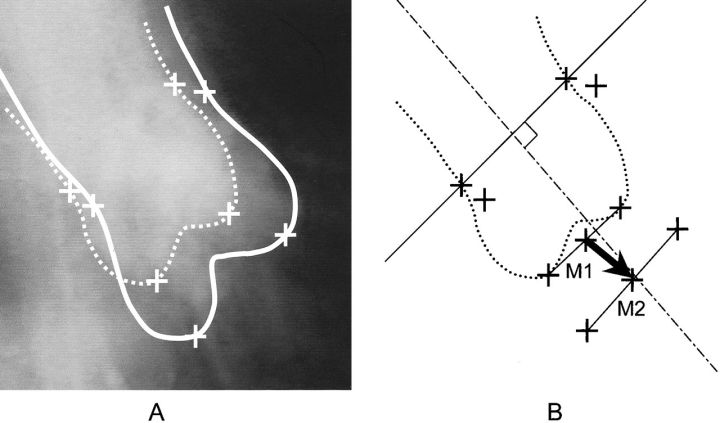
重叠血管造影,勾勒出心动周期中主动脉根部最向上和最向下的位置。?测量的参考点在Valsalva窦底和STJ处。在原理图B中,箭头表示主动脉根部底部从M1移动到M2。这一位移在垂直于STJ平面的方向上的投影被定义为主动脉根部的轴向位移。
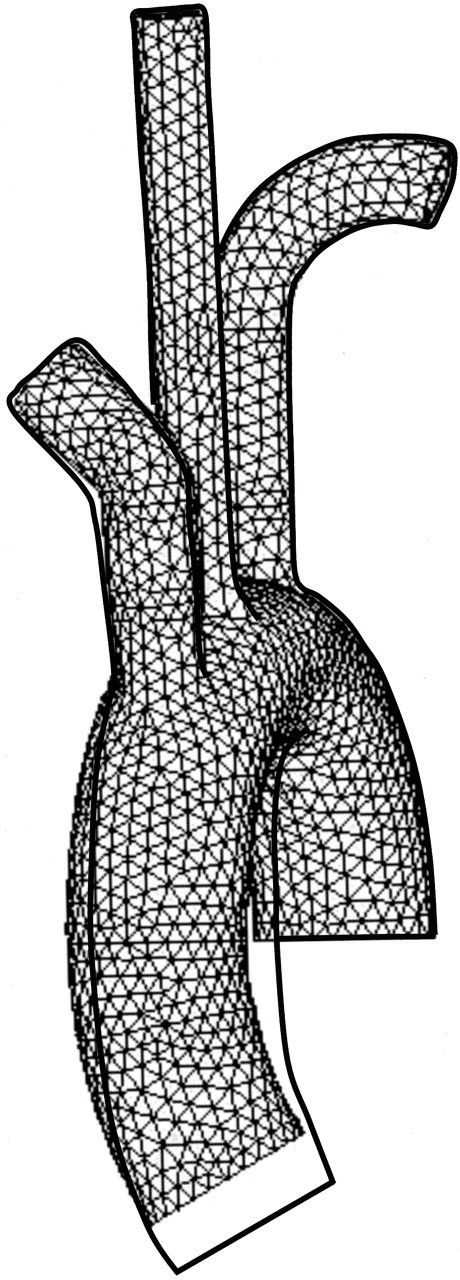
主动脉根部、弓部和分支的有限元模型的前视图。当对主动脉根部施加8.9 mm轴向位移和6度扭转时,未变形的网状结构与变形的形状轮廓一起显示。人们可能会欣赏这个模型在太空中的变形。
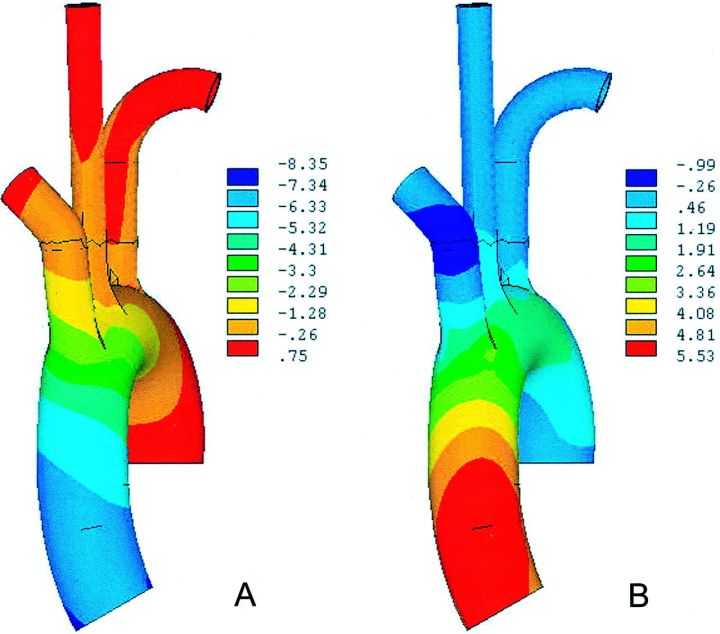
垂直向下(A)和垂直于弓(B)的位移(Mm)。该模型的管腔压力为120 mm Hg,轴向位移为8.9 mm,底部扭转为6度
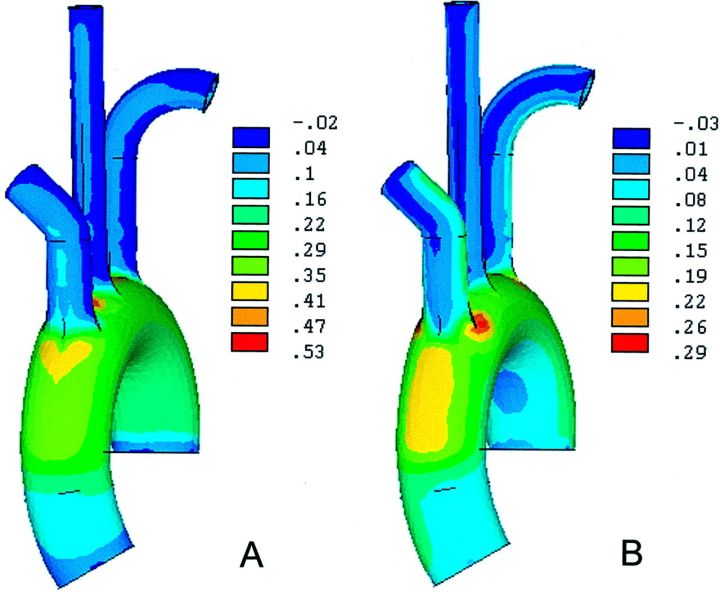
主动脉弓内周向(A)和纵向(B)应力的分布(NMM?2)。在这个对照模型中,唯一的载荷是120毫米汞柱的管腔压力。观察到主动脉上血管开口周围的预期应力集中
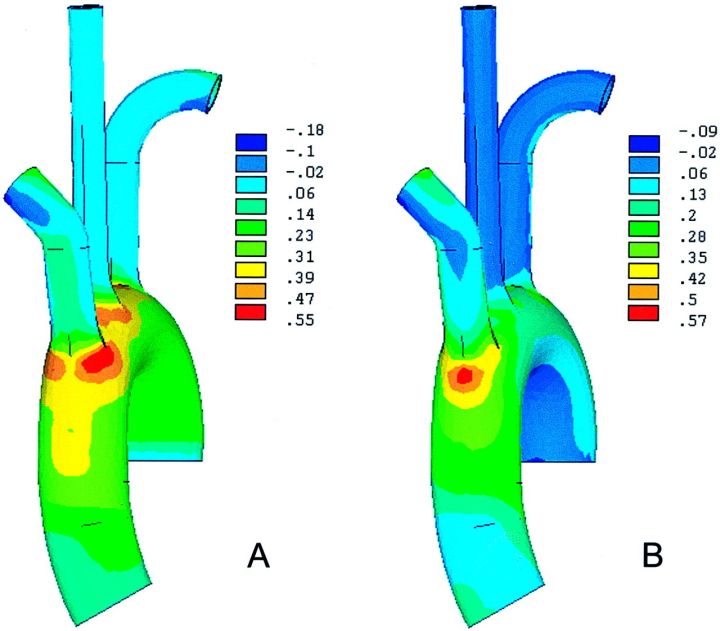
在120 mm汞压力的基础上,对主动脉根部施加8.9 mm的轴向位移和6度的扭转。在这个模型中,与对照模型相比,升主动脉的纵向应力增加了大约50%。
5 主动脉夹层在中层的延展
在主动脉夹层的发展过程中,血液通过入口部位流入主动脉壁,并向外膜方向流动。在一个实验模型中,到达外中膜前三分之一的血液流向头尾方向,导致夹层延长[47]。因此,AD通常在中层的前1/3处进展[45,47],这是由血管或来自主动脉腔的灌流所提供的营养的边界。血管的任何损伤都将意味着血液供应的减少和介质的脆性增加,这可能与AD的发展有关。
6 无明显破口的主动脉夹层
“壁内血肿(IMH)”是一个组织病理学术语,定义为无进入部位的AD。在日本,根据“主动脉瘤和主动脉夹层的诊断和治疗指南(JCS 2011)”,我们使用“非交通性假腔”来代替IMH[48]。这是因为在临床环境中很难确定进入部位的存在。即使是直接观察,计算机断层扫描也不能全部检测到微小的内膜撕裂。然而,无内膜撕裂的AD是否真的能长期存在是有争议的。Hirst等人报道,在505例AD尸检病例中,4%的病例缺乏内膜撕裂[1]。国际急性主动脉夹层登记处报告说,在2830例AD病例中,IMH占6%[49]。约5%的AD病例可能缺乏进入部位。
如果无内膜撕裂的AD病例确实存在,这可能支持这样一种观点,即中层变性是AD发展的第一步。在正常情况下,中层退变会导致内膜破裂和脱落,这可能会产生一个进入部位,导致交通假腔。相比之下,非交通性假腔可以以两种方式发展:一种是由于中层中的血流不再进入而变得停滞,并在假腔内完全凝结,包括进入部位。另一种可能是血管破裂导致中层血肿。在一些有非交通性假腔的AD病例中,中层退行性变可能会在新出现的进入部位之前导致血管破裂。这些想法只是假设,到目前为止还没有得到足够的证据支持。无内膜撕裂的AD患者是否存在,是解决其发病机制的关键之一。
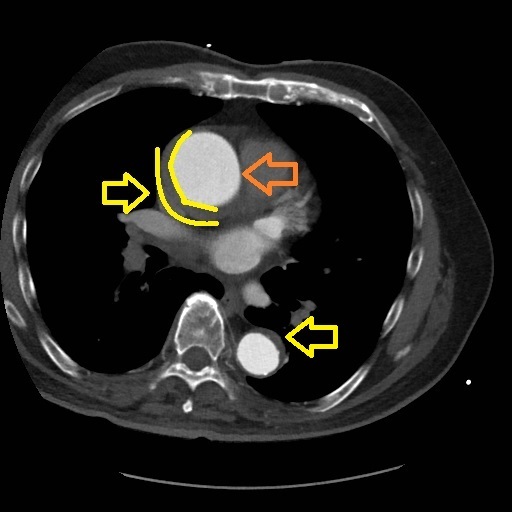
主动脉壁间血肿
7 结论
AD可在中层退行性变和机械主动脉壁应力的基础上发展。中层退行性变的组织病理学结果被假设为弹性纤维和结合弹性纤维的丢失。中层退行性变的临床原因包括高血压、主动脉瘤、阻塞性呼吸睡眠暂停综合征和CTDS。此外,机械壁应力被认为是由血流引起的切应力以及高血压和主动脉根部运动引起的。对血管的损伤在形成进入部位中起着关键作用。
因此,虽然主动脉夹层的病因已经被广泛讨论,但它还没有完全阐明。有必要进行进一步的研究,以寻找在AD发生之前导致中层退变的机制。
本文是田振宇版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论