神经母细胞瘤(Neuroblastoma, NB)的免疫治疗


免疫检测点如 PD1/PD-L1的抑制剂 和 CAR-T细胞治疗 在内的免疫疗法在成人肿瘤治疗中取得了革命性的进展,但大部分儿童肿瘤患者尚未从免疫治疗中获益。
同样未能从免疫检查点抑制剂中获益的神经母细胞瘤,却凭借利用先天免疫细胞杀伤肿瘤细胞的GD2单抗大幅提升了患儿的生存率,也彻底改变了这类儿童肿瘤的治疗方案。能否进一步扩展免疫治疗,使更多神经母细胞瘤的患者受益,成为越来越多的人关注的话题。
2022年4月18日,来自英美两国的科学家在 Clinical Cancer Research 在线发表综述文章 Immunotherapy of Neuroblastoma: Facts and Hopes ,详细汇总了免疫疗法治疗神母细胞瘤的现状,并展望了未来免疫治疗可能的应用。

神经母细胞瘤“免疫原性”
神经母细胞瘤(Neuroblastoma, NB)起源于交感神经系统,是发病率最高的儿童脑外实体瘤。好发于五岁以下儿童,尤其是两岁以下婴幼儿。我国神母的发病率约为10.1/100万(0~14岁儿童)。目前神母的治疗方式主要集中在手术、化疗、放疗、高剂量化疗及干细胞移植等手段,免疫疗法应用十分有限。那么既然免疫治疗可以在成人实体瘤中取得突破性进展,对于神母的治疗是否也能有所助益呢?
可免疫治疗往往对“免疫原性”更高的肿瘤有更好的疗效。而包括高危型神母在内的许多儿童肿瘤并不具有传统意义上的“肿瘤免疫原性”。
比如,神母的肿瘤突变负荷不高。与其它很多儿童肿瘤一样,神母也是由于发育过程中相关蛋白的异常表达和调节造成的。这部分在发育过程中表达的蛋白质在发育完成后的正常组织中沉默,但是患者自身的T细胞已经无法识别这些所谓的“癌胚抗原”。这种“无法识别”在某种程度上导致了大部分神经母细胞瘤中缺少肿瘤反应性T细胞的浸润,进一步促使这些肿瘤对免疫检验点抑制剂,比如PD1/PD-L1的抑制剂以及肿瘤疫苗响应率很低。
从这些特征看来,神母属于典型的免疫“冷”肿瘤。不过即使神母肿瘤内缺乏获得性免疫反应的痕迹,但与大多数肿瘤一样,神母仍然有免疫逃逸的迹象。比如神母肿瘤细胞表面会下调MHC-I的表达,肿瘤内有大量抑制性髓系细胞入侵,还存在多种抑制性的细胞因子。这些迹象或许指向神母免疫原性的“冷”,未必全是由于缺乏免疫系统可识别的“危险”信号,也可能有免疫逃逸的影响。而这无疑为免疫治疗提供了希望。
神经母细胞瘤治疗中的免疫疗法
由于激发内源性的免疫识别在神经母细胞瘤的治疗上收效甚微,科学家们转而希望采用生物工程手段制造可以识别肿瘤细胞的药物,由此创造出新的针对肿瘤的免疫反应。这种依赖“合成”免疫识别的免疫治疗一般基于单克隆抗体。在单抗之上还能发展出其它药物形式,如CAR-T细胞治疗和抗体药物偶联(Antibody–Drug Conjugates,ADC)。
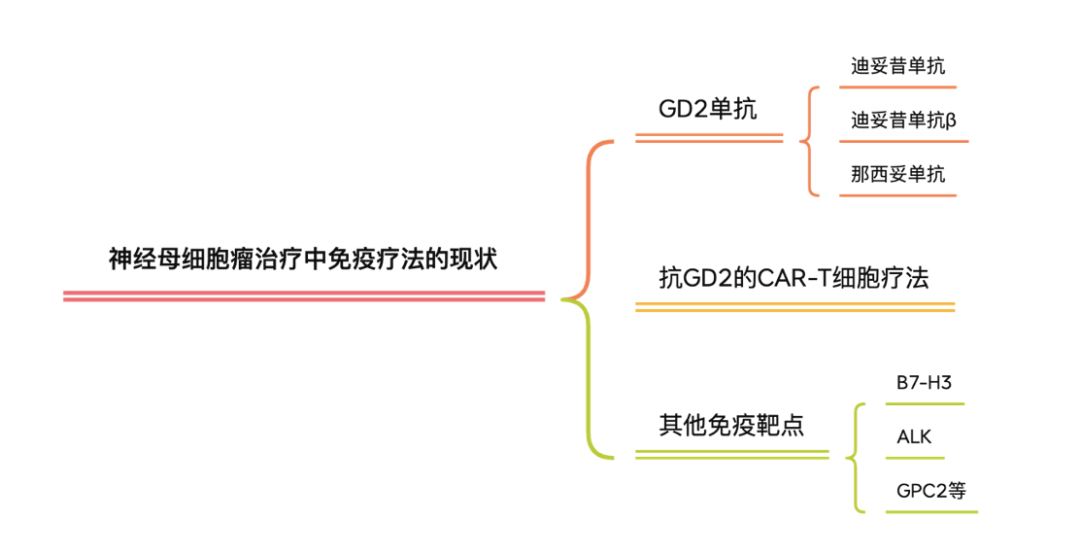
神经母细胞瘤中目前研究最多也最成熟的靶点是GD2。GD2是一种含有唾液酸的糖鞘脂,集中于细胞表面,几乎在神母每一个肿瘤细胞表面都有表达。但在正常组织中的表达高度受限(主要是小脑和周围神经),对治疗神母来说是一个“完美的靶点”。以GD2为靶点的药物研发主要涉及单抗药物,CAR-T细胞疗法和肿瘤疫苗等方面。
GD2单抗是过去数十年唯一被批准上市的用于治疗神经母细胞瘤的新药,目前共有三款产品获批上市。迪妥昔单抗于2015年被美国FDA批准上市,是第一款用于治疗高危型神经母细胞瘤的单克隆抗体药物,但是需要和IL2与GM-CSF一起使用。2017年,迪妥昔单抗β在欧洲批准上市,迪妥昔单抗β与迪妥昔单抗是同一靶点但来自不同细胞的两种单克隆抗体,迪妥昔单抗β可以单独使用。该药由百济神州引入中国,并在2021年被国家药品监督管理局批准上市,成为我国第一款治疗神经母细胞瘤的单克隆抗体药物。2020年11月在美国获批上市的那西妥单抗是由Y-mAbs Therapeutics开发的首款人源化的GD2单抗,与GM-CSF联合使用治疗有骨和骨髓转移的神经母细胞瘤患者。目前已由赛生药业引入中国并已被纳入快速审批通道。相信在不久的将来会有越来越多的中国患儿可以从中获益。
GD2单抗主要通过抗体依赖的细胞毒性作用(ADCC)来进行肿瘤细胞的杀伤。抗体的Fab段可以识别肿瘤细胞表面的GD2,Fc段与杀伤细胞(NK细胞和巨噬细胞,不是T细胞)表面的FcR结合,激活这些杀伤细胞并释放细胞毒性物质,从而杀死肿瘤细胞。而迪妥昔单抗β可以单独使用而迪妥昔单抗不可以。
免疫治疗起效的主要原因在于抗体能否有效激活杀伤细胞,如果不能,则需要额外的刺激因子来一起帮忙实现杀伤作用,如IL2激活NK细胞,GM-CSF激活巨噬细胞。
除了单独使用GD2单抗,儿童肿瘤学组织 (COG)和圣裘德儿童研究医院分别开展了临床试验用于研究GD2单抗和化疗联合使用在神母患者中的治疗效果。前期的结果显示,在复发性神母患者中,相较于仅使用常规化疗,化疗与GD2单抗联用效果更好,尤其是对于患者病灶较大的情况,并且效果相对持久。目前,COG正在开展更大规模的临床试验做进一步的验证,以期早日将这种治疗方案惠及更多患者。
虽然GD2单抗的问世改善了部分神母患者的预后,但是目前使用GD2单抗治疗也存在一些问题。比如不是所有GD2阳性的患者都会响应GD2单抗治疗,有些患者接受GD2单抗治疗后依然会复发,甚至在复发之后转为GD2阴性。此外,即便GD2在正常组织中表达较低,但是依然会有患者神经性疼痛。因此,很多研究人员都在努力对GD2单抗进行优化。
除了GD2单抗,靶向GD2的CAR-T细胞治疗是第一个针对儿童实体瘤开发的免疫细胞治疗方法。第一代抗GD2的CAR-T使用了和迪妥昔单抗共同的识别位点。现有临床试验的结果显示部分患者对此疗法响应,并且未产生脱靶和肿瘤外的神经毒性。相比较于GD2单抗, CAR-T细胞疗法的副作用主要还是来自细胞因子风暴,并没有产生异常性疼痛或者神经系统反应。目前,新一代靶向GD2的CAR-T细胞疗法还在开发中。除了GD2单抗和靶向GD2的CAR-T细胞疗法, Y-mAbs Therapeutics公司正在研发GD2/GD3的肿瘤疫苗(详情点击这里)。
除了GD2这个神母肿瘤细胞最知名的靶点,其他膜蛋白靶点比如B7-H3 (CD276)和ALK也被发现在神母中有高表达。相应的单抗和CAR-T细胞疗法都在开展临床试验。
一些临床前研究也在关注如何靶向在神母细胞内特异性表达的蛋白。此外,一些癌睾抗原(Cancer Testes Antigens, CTAs),比如NY-ESO-1和PRAME,在神母以及其它一些肿瘤细胞中有高表达,但在正常组织中的表达仅限于睾丸组织,正在被当做免疫治疗的靶点进行药物开发,不过目前尚未扩展到神母的临床试验中。
潜在的治疗神经母细胞瘤的免疫疗法
GD2单抗在一部分神经母细胞瘤患者治疗中的成功使得人们相信会有更多免疫治疗手段来提高神经母细胞瘤患者的治疗效果和生存期。但神经母细胞瘤的肿瘤微环境仍然对激发内源性的免疫反应极为不利。如肿瘤本身会通过下调MHC-I,髓样来源的抑制细胞的浸润和产生TGFβ在内的抑制因子来完成 “免疫逃逸”。这些导致获得性免疫相关的治疗进展困难。如何更有效利用先天免疫中的NK细胞和巨噬细胞成为神经母细胞瘤免疫治疗的关键。
在使用GD2单抗治疗的过程中,有数据显示有NK细胞受体(NKR)及它的配体表达的神母患者更容易响应GD2单抗治疗。科学家还尝试使用体外扩增的具有抗GD2抗体的NK细胞来治疗神母患者,并且产生了一些治疗效果。此外,贝勒医学院的研究人员还开发了抗GD2的CAR-NKT细胞并且显示出初步的疗效。鉴于肿瘤细胞可以通过表达CD47来抑制巨噬细胞对于肿瘤细胞的吞噬作用,因此研究人员考虑将CD47单抗与GD2单抗联用,以此来增强巨噬细胞的抗肿瘤效果,这项研究目前已经在复发性神经母细胞瘤的患者中开展了临床试验。
先天免疫之外,以单抗为基础的免疫治疗方法一直是肿瘤免疫治疗的重要组成部分。目前研究人员通过生物工程的手段设计开发了双特异性T细胞结合剂 (Bispecific T-cell Engager, BiTE),通过连接肿瘤特异性靶点的单抗和CD3单抗使T细胞特异识别肿瘤细胞,进一步杀死肿瘤细胞。除了T细胞, 还有双特异性NK细胞结合剂(Bispecific NK cell Engager, BiKE) 甚至三特异性杀伤细胞结合剂 TriKE(可识别NK细胞和肿瘤细胞同时带有细胞因子)。但是由于实体瘤微环境中的免疫抑制,这些结合剂在实体瘤中的效果并没有在血液瘤中的效果好。此外,研究人员还尝试构建可以同时识别两种肿瘤细胞抗原的单抗,或者改造Fab段的抗原结合位点来让单抗更好地结合在肿瘤细胞表面,进而促进以单抗为基础的免疫治疗方法的效果。
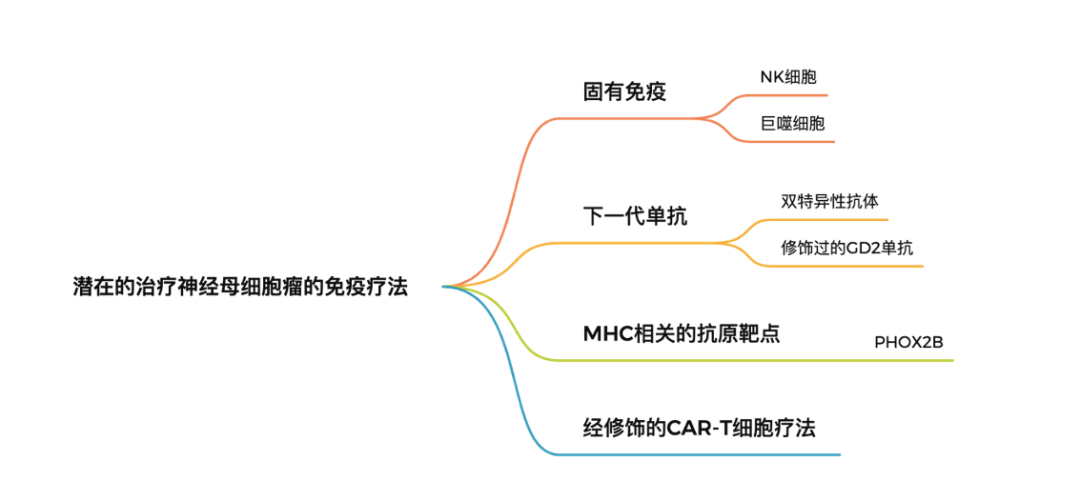
虽然神经母细胞瘤的“免疫特性”显示其对于内源性T细胞相关的免疫反应响应较低,但是仍然可以尝试将一些MHC相关的肿瘤抗原比如PHOX2B作为免疫治疗的靶点。PHOX2B是一种癌胚抗原,被认为是神经母细胞瘤发生的关键基因,经MHC分子呈递至神母细胞表面。PHOX2B在发育完成的正常组织中基本不表达。靶向PHOX2B的CAR-T细胞疗法目前已经完成了临床前的概念性验证。针对神经母细胞瘤这一类免疫原性不强的实体瘤,还可以通过使用一些细胞因子或者放疗等手段来模拟“原位疫苗”,进而增加肿瘤的免疫原性,激活抗原提呈进一步刺激内源性的T细胞发挥作用。
关于神经母细胞瘤的新一代CAR-T细胞疗法的开发,主要聚焦在如何提高CAR-T细胞的扩增和存活时间,以及如何降低肿瘤微环境中的免疫抑制,同时还要注意平衡有效性和毒性之间的关系。虽然靶向GD2的CAR-T细胞疗法有一个相对合适的治疗窗,基本不会识别GD2低表达的组织导致出现脱靶并造成神经毒性,但是新一代CAR-T细胞疗法旨在通过转录重编程等手段来增强治疗效果,在治疗效果得到提升的同时可能对于靶点更加敏感,因此有可能也会靶向靶点低表达的正常组织,出现脱靶并造成额外的毒副作用。
对于神经母细胞瘤这种不具有传统意义上“肿瘤免疫原性”的实体瘤来说,GD2单抗的出现极大地鼓舞了研究人员对于使用免疫疗法治疗神母的信心,并由此根据神母自身的免疫特性对不同免疫治疗方法和不同靶点进行了尝试,部分已经取得了不错的疗效在进一步优化中。未来,除了免疫疗法本身更新换代带来的治疗效率的提升,与其他疗法联用也是提升治疗效果的重要手段。
神经母细胞瘤研究领域的愿景是通过包含新型免疫治疗的新治疗方案,在减少长期副作用较大的放化疗的情况下仍有效清除肿瘤。其它高危儿童肿瘤也面临着针对成人的传统免疫治疗不适用、高剂量的放化疗有严重毒副作用的困境,而神经母细胞瘤在免疫治疗上的进展也可以为其它儿童肿瘤提供参考。
本文是曾辉版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论