 三甲
三甲
抗肿瘤相关免疫治疗不良事件(副反应)的识别、判定

注:本文中对治疗中出现的不良反应称为副作用,在临床试验中称为不良事件。
随着肿瘤免疫治疗的应用及相关临床试验成为热点,如何提高免疫相关的不良事件的识别、判定的科学性和稳健性,提高临床试验说明书撰写质量和患者用药安全。在国家药品监督管理局的部署下,药审中心组织制定了《抗肿瘤治疗的免疫相关不良事件评价技术指导原则》。
现整理如下:
1)免疫相关不良事件(irA E)的定义
抗肿瘤药物/治疗临床试验中,经判定与免疫机制有因果关系的所有级别的药物不良反应。
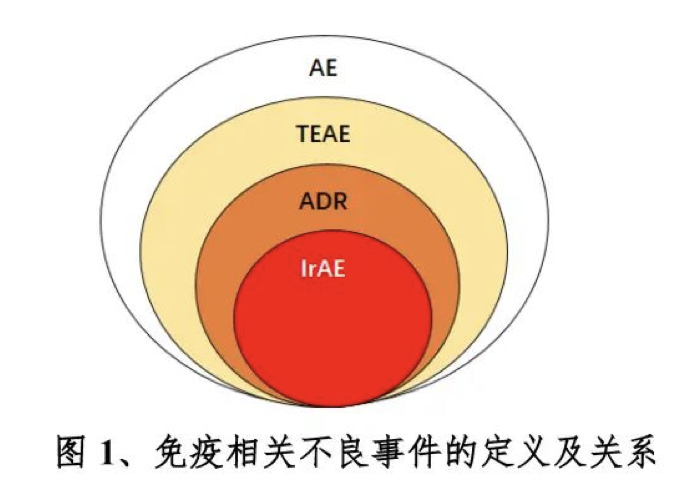
另外,需注意,irAEs实际上是抗肿瘤药物作用机制介导引起的“不良反应”。需要明确其范围。如上图。
2)判定医学考虑
IrAE是由免疫机制介导发生的,临床表现主要与免疫细胞的活化相关,具有如下特征:
A)通常为脱靶免疫反应,可累及单个或多个器官系统;
B)部分产品的剂量-暴露量-安全性特征不明确,低剂量也可能导致严重irAE;
C)发生时间多样,部分在用药后较快发生(如细胞因子释放综合征通常在48小时内发生),并迅速加重;部
分具有迟滞效应,在用药数月后发生;部分在停药后发生并持续加重;
D)部分irAE的发生率极低,需大样本和长时间观察才能暴露;
E)不同作用机制的产品可具有相似的irAE。
基于上述irAE的特点,在临床试验中,往往难以完全参照ADR(药物不良反应)判定的一般原则进行判定,进一步考虑因素如下:
(1)针对目标irAE(包括疑似irAE)是否使用了全身类固醇治疗、其他免疫抑制治疗或内分泌替代治疗,以及治
疗后转归;
(2)病理检测结果(如有);
(3)靶点免疫学机制;
(4)事件与治疗的时间相关性,包括长期用药后发生,重新用药后事件是否再次出现或加重,以及停药后发生并加重的情形;
(5)该事件同靶点药物已报告并明确为irAE;
(6)目标irAE严重程度,单器官还是多器官/系统累及;
(7)患者自身免疫疾病病史和基线疾病状态;
(8)安全性相关生物标记物的支持(如有);
(9)排除其他病因,与临床表现相似的非免疫事件的重要临床鉴别诊断(如免疫相关性肺炎和感染性肺炎);
(10)排除其他可导致目标不良事件的合理解释(例如感染,合并用药和基础疾病);
3)判定流程
在产品总体医学判定上,申办者可结合研究方案的定义、数据收集等各方面考量,制定科学的流程进行判定。当前针对irAE总体判定流程,包括但不限于以下方式:
(1)基于试验总体AE通过预设流程进行综合评价。
(2)在研究者判定结果基础上,申办者按照预先设定的流程进一步评价汇总。研究者通常基于医疗经验进行irAE判定;申办者在研究者判定的基础上,基于在既往临床试验中获得的经验,再次进行irAE判定。
(3)采用预设医学逻辑进行计算机程序判定。需要考虑程序预设医学逻辑的科学性、严谨性和全面性,并经过充分验证。
4)说明书免疫相关不良事件的呈现
(一)一般原则
研究者是临床试验中AE药物相关性的首个判定主体,直接与受试者接触掌握其全面临床信息,因此,研究者的评价结果有重要的价值。建议在SCS等研究资料中,合理呈现研究者和申办者的判定结果,提供申办者的详细评价流程,CTCAE严重等级4~5级判定不一致的病例宜有合理的分析解释。
说明书通常呈现经申办者判断、技术审评部门核定后确认与药物相关的不良反应。建议采用本指导原则所推荐的irAE定义,并参照已发布的《抗肿瘤药物说明书不良反应数据汇总指导原则》和《抗肿瘤创新药上市申请安全性总结资料准备技术指导原则》,以汇总形式在说明书【不良反应】项下呈现irAE。原则上,说明书【不良反应】信息的撰写基于申办者汇总判定后的数据。
说明书中应呈现重要器官/系统(如免疫相关性心肌炎、免疫相关性肺炎和免疫相关性内分泌疾病)的irAE信息,包括临床试验中发生率较高的irAE,以及发生率低但可导致严重后果的irAE。可合并情况下,建议以术语簇形式呈现irAE(例如免疫相关性内分泌疾病),减少呈现单个PT术语所导致的发生率分散和临床关注度的下降,汇总同时建议准确呈现单个免疫相关事件的发生率,如垂体炎、甲状腺功能减退症、肾上腺功能不全和糖尿病等。
在系统性呈现iAE时,建议涵盖如下因素:目标irAE在临床试验中的汇总累积发生率、严重级别3级及以上事件发生率、导致死亡结局的irAE发生率、典型临床表现、至事件发生时间、持续时间、是否导致治疗暂停或终止、剂量-暴露量-效应特点(如有)、高危人群特征(如有)、预后和临床转归等。建议明确目标irAE需要使用系统性皮质醇激素、其他免疫抑制剂治疗或内分泌替代治疗的比例以及转归,为医患提供更有价值信息。对于不同适应症,如果特定irAE在某个特定肿瘤类型下具有显著的性质、频率或严重程度差异,呈现时应加以强调同靶点产品可能具备的相似的irAE特征,靶点机制相关的严重、罕见和需要特别关注的irAE可能因产品当前暴露量和访视时间有限而尚未报告,因此,建议在说明书中提示本品尚未报告但同类上市产品已报告的irAE,以充分提醒医患用药风险。
(二)特殊情形的考虑
(1)对照设计的临床试验,在CSR和SCS中可考虑呈现试验组和对照组的irAE,但当对照组为安慰剂或非免疫治
疗药物/疗法时,不建议在说明书中呈现安慰剂/阳性对照药的irAE。
(2)对照临床试验中采用交叉设计时,由于试验组和对照组交叉人群所接受的免疫治疗方案和暴露时间可能不同,建议在CSR和SCS中单独呈现交叉人群的irAE。在说明书【不良反应】撰写中,可参照《抗肿瘤药物说明书不良反应数据汇总指导原则》,将相对同质人群的irAE数据汇总呈现。
(3)免疫联合治疗设计的试验,判定irAE与其中特定药物的相关性存在一定挑战,当前有如下建议:
①如免疫联合治疗与单药治疗具有相似的irAE特征,建议明确irAE与联合治疗的相关性,不过度强调与某一目标药物的相关性。与单药相比,免疫联合治疗在irAE性质、频率或严重程度方面观察到提高时,呈现时应加以强调。
②如免疫联合治疗与单药治疗具有显著不同的irAE特征,建议尽可能明确iAE与方案中的单药的相关性。
(4)免疫联合非免疫治疗中,如果免疫与非免疫治疗具有相似的AE特征(例如,免疫治疗和靶向治疗均已知与甲状腺疾病有关),经充分医学评价仍无法确定所观察到的AE是irAE还是非irAE时,须用保守方法,将AE视为irAE,不应仅依据两者特征相似,而排除irAE。
总结:
本技术指导原则旨在阐述药品监管机构当前对抗肿瘤治疗临床试验irAE的评价和说明书撰写考虑,目标是提高安全性报告和说明书等资料质量,加强对参与临床试验的受试者和上市后用药的患者人群的保护。本技术指导原则尚不能涵盖抗肿瘤治疗中iAE识别、判定和说明书撰写的所有情形,鼓励研发从业者与药品监管机构及时沟通,持续完善本指导原则。
本文是曹昊天版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论