 三甲
三甲
浅谈胰腺导管内乳头状黏液性肿瘤(IPMN)
胰腺导管内乳头状黏液性肿瘤(IPMN)指源于主胰管或胰管主要分支有大量黏液分泌的乳头状肿瘤。
IPMN具有恶变潜能,早期确定并采取适当手术方式或随访方案处理,对于获得良好预后十分关键。
一、分型
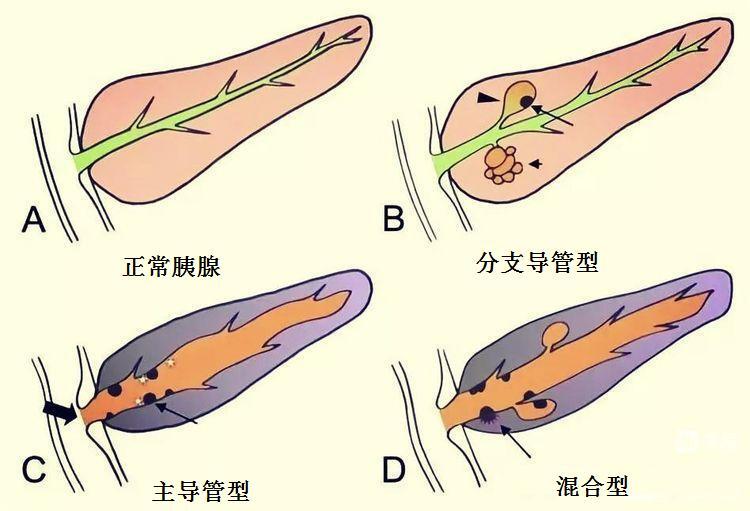
根据胰管受累情况,IPMN可分为3种类型:
(1)主胰管型(main duct-IPMN,MD-IPMN):恶变率较高,60%~70%
(2)分支胰管型(branch duct-IPMN,BD-IPMN):恶变率略低,15%~-25%
(3)混合型(mixed type-IPMN,MT-IPMN):恶变率认为与主胰管型相似
二、组织病理学
2019版WHO胰腺肿瘤分类将IPMN分为:
IPMN伴低级别异型增生(low grade dyplasia,LGD)、
IPMN伴高级别异型增生(high grade dyplasia,HGD)、
IPMN伴浸润性癌;
后两者通常被认为是恶性病变
在切除的MD-IPMN中,HGD和浸润性癌的比例分别高达61.6%、41.3%;
而切除的BD-IPMN标本中,HGD和浸润性癌的比例分别为31%、18.5%。

三、诊断
1.临床表现:
整个胰腺均可受累,胰头及钩突部最为常见,
因肿瘤生长缓慢,大多数患者仅在健康体检时发现而无任何症状。
部分出现上腹部疼痛,恶心、呕吐,腰背部疼痛,梗阻性黄疸,反复发作的胰腺炎
2.实验室检查:
血清CA19-9升高与恶性IPMN相关,敏感度为79%~100%,
但在正常范围内的CA19-9水平并不排除恶性可能。
3.囊液分析:
对超声内镜引导下细针穿刺活检获取的囊液进行综合分析,可能提高诊断的准确性。
二代测序技术(NGS)测定囊液中的KRAS和GNAS突变可区分黏液性与非黏液性肿瘤,
KRAS/GNAS突变见于73%的黏液性肿瘤,
而GNAS突变被认为仅存在于IPMN中,因而可作为鉴别IPMN与MCN的指标。
然而,不管囊液CEA水平还是KRAS和GNAS突变均无法鉴别良恶性病变。
因此,目前不做为常规推荐。
4.影像学检查:
MD-IPMN常见于胰头,为边界相对清晰的囊实性混合病灶,特征性表现为主胰管弥漫性或节段性扩张,可延伸至分支胰管,管腔内充满黏液,囊肿壁有时出现增厚增强并可见强化的乳头状结节。
BD-IPMN多见于钩突部,病灶呈分叶状或葡萄串样,可见分隔,与主胰管相通,BD-IPMN也可能出现主胰管扩张。
MT-IPMN则同时出现MD-IPMN、BD-IPMN的表现。
四、手术策略
目前缺乏IPMN最佳治疗策略高度统一的国际共识。
2017年修订版福冈指南将IPMN恶性危险因素分为“高危特征(high-risk stigmata,HRs)”和“忧虑特征(worrisome features,WFs)”(表1)。
2018版欧洲循证指南则采用绝对指征(absolute indications,AI)和相对指征(relative indications,RI)的手术策略(表2)。

目前国外指南均建议所有适合手术的MD-IPMN患者均应接受手术治疗;
而MT-IPMN发生HGD和浸润癌的几率与MD-IPMN相当,故治疗策略与MD-IPMN相同。
对于BD-IPMN,在切除的BD-IPMN中恶性病变(HGD、浸润性癌)发生率为25.5%(6.3%~46.5%),
而浸润性癌的发生率也达17.7%(1.4%~36.7%)。
因此,任何有HRs、AI的患者,只要适合手术也应接受手术治疗。
而欧洲指南支持更积极的策略,如果适合手术的患者存在一个或以上RI,
或在有严重合并症且未进行EUS的患者中发现两个或以上RI,则建议手术切除。
手术方式主要取决于肿瘤位置、大小、有无邻近侵犯及恶性征象,
具体包括胰十二指肠切除术、保留脾脏或不保留脾脏的胰体尾切除术、胰腺中段切除术、全胰腺切除术以及肿瘤剜除术,存在HFs、AI时应联合标准的淋巴结清扫。
五、随访策略
1.未行手术切除的IPMN随访:随着时间的推移IPMN进展的风险会增加,故对无手术指征的IPMN患者应终生随访,直到不再适合手术为止。
MRI应作为首选的影像学随访监测方法,在怀疑存在壁结节等恶性病变高危特征时进一步行EUS、EUS-FNA。
2.手术切除的IPMN随访:对于仍适合手术的患者,术后均继续进行随访监测直至不再适合手术治疗。
六、预后
IPMN预后比胰腺导管腺癌好,
非浸润型术后5年生存率77%~100%,浸润型5年生存率仅为24%。
(参考《中华肝脏外科手术学电子杂志》2022年第11期)
本文是陈勇版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论