 三甲
三甲
大医仑道|靶向联合免疫治疗背景下晚期肝细胞癌转化治疗的现状与展望
肿瘤资讯 肿瘤资讯 2022-11-11 19:59 发表于上海
整理:肿瘤资讯
来源:肿瘤资讯

我国是肝细胞癌(以下简称肝癌)高发国家,全世界近一半的肝癌新发病例和死亡病例发生在中国[1],严重危害我国人民的生命健康[2]。尽管根治性手术切除是肝癌的首选治疗方式,但超过2/3的肝癌病人在确诊时已达中晚期,错过了根治性手术的最佳时机。仅20%~30%的病人初诊时有手术切除的机会,导致肝癌病人的整体预后仍然较差[3]。
转化治疗旨在通过各种治疗手段实现肿瘤的缩小或降期,将不可切除肝癌转化为可切除,从而延长肝癌患者的总体生存时间。长期以来,由于缺乏有效的系统性治疗药物,肝癌的转化率低,导致“转化治疗”的概念在肝癌中较少被提及。
近年来,以抗肿瘤血管生成的靶向治疗联合以PD-1/L1抗体为代表的免疫治疗方案在晚期肝癌治疗领域取得了突破性进展[4-7]。靶向联合免疫治疗良好的疗效以及相对可控的副作用提升了系统性治疗在肝癌中的地位和作用。其较高的客观缓解率(ORR 30%~40%)和较长的缓解持续时间(≥6个月)使其成为肝癌转化治疗中的优选方案,也使得肝癌的转化治疗成为目前临床研究的热点之一。
目前,诸多临床研究正在开展,探索不同系统性治疗方案应用于肝癌转化治疗中的可行性。笔者结合自身临床经验、近期的研究进展及本中心病例资料的回顾性研究,对靶向联合免疫治疗背景下的初始不可切除或中晚期肝癌转化治疗策略进行分析和讨论,对肝癌转化治疗研究提出一些自己的见解和思路。

易勇
副主任医师、外科学博士
复旦大学附属中山医院副主任医师
复旦大学附属中山医院副教授
复旦大学附属中山医院科室教学秘书
上海市肝病学会肝肿瘤学组委员
主要从事肝癌复发转移的基础与临床工作。擅长肝癌微创外科(腹腔镜)治疗,有两千例肝切除主刀经验,对复杂肝癌、肝门胆管癌切除、晚期肝癌转化治疗等具有丰富的临床经验。主要研究方向为微环境与肝癌转移复发、肝癌转化治疗研究,负责两项国家自然科学基金项目。以第一作者或通讯作者(含共同)在Journal of Hepatology等杂志发表SCI论文二十余篇。入选2013年度上海市教委晨光计划及2016年度上海市优秀青年专科医师培养资助计划。
一、转化治疗的概念和定义
肝癌的转化治疗应以肿瘤手术切除为导向,病人的长期生存获益为目的
根据2021版《肝癌转化治疗中国专家共识》的定义,肝癌转化治疗是指将不可切除肝癌转为可切除肝癌,然后手术切除肿瘤[8]。肝癌的转化治疗可分为两类。第一类是指外科学技术上的不可切除:病人的全身情况、肝功能较差不能耐受手术,肿瘤毗邻重要血管、剩余肝体积不足,无法行根治性切除。第二类指肿瘤学意义上的不可切除:对于中晚期肝癌患者,如中国肝癌临床分期(CNLC)IIB和IIIA期肝癌,与非手术治疗相比,初始手术切除并不能给患者带来更好的生存获益。这类病人通常先接受系统治疗,使肿瘤缩小、降期后,再行根治性切除。第二类也是目前转化治疗研究的重点与难点。
二、转化治疗方案的选择
基于靶向联合免疫的联合用药方案是肝癌转化治疗的研究重点
无论是从临床研究还是真实世界研究数据看,靶向药物和PD-1/L1抗体单药治疗的疗效较为有限[9],ORR均在20%左右[10, 11]。药物联合应用,特别是抗血管生成靶向治疗和PD‑1/L1抗体的联合应用成为提高肝癌药物疗效的热点和重点:(1)IMbrave 150研究显示:阿替利珠单抗联合贝伐珠单抗(简称“T+A”方案)一线治疗晚期肝癌患者中位总生存时间(mOS)显著优于索拉非尼(19.2个月 vs 13.4个月,P<0.001)[4],被国内外指南推荐为晚期肝癌的一线治疗方案[12, 13];(2)我国多中心ORIENT-32研究显示:信迪利单体联合贝伐珠单抗类似物(“双达”方案)一线治疗晚期肝癌疗效显著优于索拉非尼[5];(3)KEYNOTE-524研究显示帕博利珠单抗联合仑伐替尼(“可乐组合”)一线治疗晚期肝癌的mOS和ORR分别达22.0个月和46.0%(mRECIST)[6];(4)RESCUE研究中卡瑞利珠单抗联合阿帕替尼(“双艾组合”),根据改良实体瘤疗效评价(mRECIST)标准评估一线治疗的ORR高达45.7%[7]。
目前国内已批准“T+A”方案、“双达”方案用于晚期肝癌患者的一线治疗,这两种方案均可用于晚期肝癌的转化治疗。“可乐组合”和“双艾组合”,由于其较高的ORR和较长的缓解持续时间,在临床实践中也是常用的转化治疗方案。此外,以靶免治疗为基础的系统治疗,联合局部治疗如肝动脉化疗栓塞、肝动脉灌注化疗、钇[90Y]微球放疗栓塞、外放射治疗等方案,目前也在不断的探索当中,有望成为潜在的转化治疗方案。
靶向联合免疫治疗对肝癌生物学行为的改善是转化治疗的立足之本
靶向联合免疫治疗杀伤肿瘤的同时,触发机体释放更多的肿瘤抗原,激活更多数量和亚群的T细胞,充分激活免疫应答。同时活化的T细胞通过血管或淋巴管到达并清除微转移病灶,引发更大范围的抗肿瘤免疫反应。在多项临床研究以及真实世界探索中,靶向联合免疫治疗后,肝癌患者的微血管侵犯(MVI)发生率显著下降。此外,笔者中心孙惠川教授团队的研究也表明,靶免治疗后大血管癌栓的器官特异性缓解率显著高于肝内病灶。靶向联合免疫治疗对肝癌生物学行为的改善作用,恰是患者治疗缓解后,接受手术切除,获得长期生存的根本所在。
三、转化切除时机的把握
目前普遍接受的观点是因外科学因素无法切除的患者一旦达到可切除标准,应尽早切除。而针对因肿瘤学因素不可切除的患者,则需要结合肿瘤治疗的反应、缓解持续的时间、肿瘤标志物下降的情况、药物治疗的不良反应、手术切除技术难度等,综合判断切除或继续用药间的临床获益。晚期肝癌临床研究药物治疗数据显示,目前一线治疗的中位至疾病进展时间(mTTP)3.7~11个月不等,表明药物治疗存在瓶颈,部分患者初始缓解后可出现耐药并导致疾病进展。若患者疾病缓解阶段能接受根治性手术切除,或可增加患者生存获益。多学科讨论在这种情况下是必要的。
四、转化切除后的治疗
成功转化切除后,首选沿用原来有效的药物治疗方案继续治疗。后续治疗中,仍需严密监测药物治疗可能导致的不良反应。一般而言,随着疗程的延长,累积的不良反应会逐渐增加。一旦出现III级及以上的不良反应,要尽早停药,并进行必要的临床干预。
术后辅助治疗时间的长短尚缺乏足够的证据,结合临床研究中药物治疗的无进展生存数据,一般建议辅助治疗持续时间>6个月。治疗过程中仍需密切监测肿瘤复发可能,包括随访肿瘤指标以及影像学检查。
五、影响转化切除后患者预后的因素
影响转化切除后患者预后的因素很多,总体而言,包括肿瘤因素(肿瘤大小、数目、肉眼癌栓、MVI、肿瘤分化、淋巴结转移等),药物治疗疗效(病理缓解程度),手术因素(R0切除、手术切缘)等。多项研究表明,药物治疗获得病理完全缓解的肝癌病人接受转化切除后,预后更佳。
六、肝癌转化治疗的临床研究进展
靶向治疗和PD‑1抗体联合
解放军总医院卢实春教授等报道33例大血管侵犯的肝癌病人接受仑伐替尼联合PD-1抗体治疗后,有10例(30.3%)患者后续接受手术切除(均为肿瘤与癌栓一起切除),术后1例(10%)病理学完全缓解。10例患者1年无复发生存率为75%[14, 15]。
孙惠川教授报道的一项回顾性研究结果显示:酪氨酸激酶抑制剂(TKI)仑伐替尼或阿帕替尼联合PD-1抗体一线治疗63例初始不可切除肝癌病人后,10例成功转化接受R0手术切除,转化切除率达15.9% [16]。
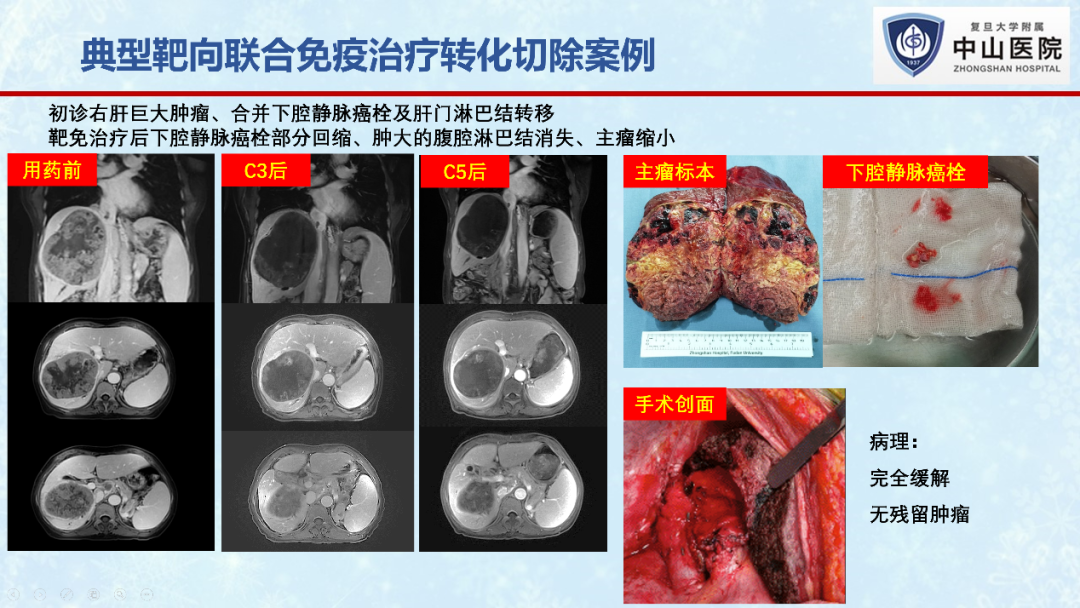
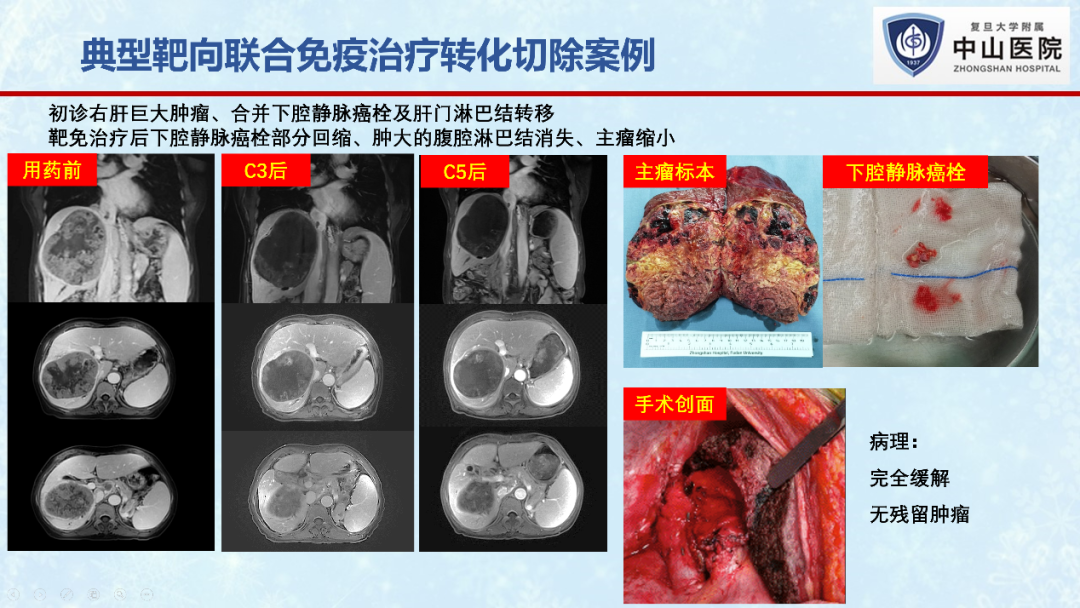
在2022年欧洲肿瘤内科学会(ESMO)年会上,笔者所在的复旦大学附属中山医院肝外科团队开展的“信迪利单抗联合贝伐珠单抗(“双达”方案)转化治疗潜在可切除中期肝癌”的II期临床研究初步结果喜人。作为首个免疫联合大分子抗血管生成药物贝伐珠单抗用于中期肝癌转化治疗的探索性研究,“双达”方案治疗不可切除肝癌的ORR为26.7%,手术转化率达56.7%[17]。
TKI联合PD‑1抗体和局部治疗的三联方案
北京协和医院赵海涛教授团队报道38例合并肝外转移(CNLC IIIB期)的肝癌病人接受TKI(仑伐替尼或阿帕替尼)联合PD-1抗体和肝动脉化疗栓塞/放疗后,9例接受手术切除,3例(3/9,33.3%)达到病理学完全缓解。术后中位随访10.2个月后,7例无肿瘤复发,2例患者肿瘤复发[18]。
中山大学肿瘤防治中心石明教授团队一项多中心回顾性研究显示,仑伐替尼、特瑞普利单抗联合肝动脉灌注化疗三联疗法的ORR高达67.6%(mRECIST),三联用药组转化切除率高于仑伐替尼单药组(12.7% vs 0 ) [19]。
天津市肿瘤医院报道了接受TKI联合PD-1抗体和肝动脉灌注化疗并完成术前评估的25例患者中,15例符合手术切除标准,转化率为60% (15/25),7例患者达到病理学完全缓解。转化切除患者的1年无进展生存率为92.9%[20]。
七、30例仑伐替尼联合PD-1抗体治疗后转化切除肝癌患者资料回顾性分析
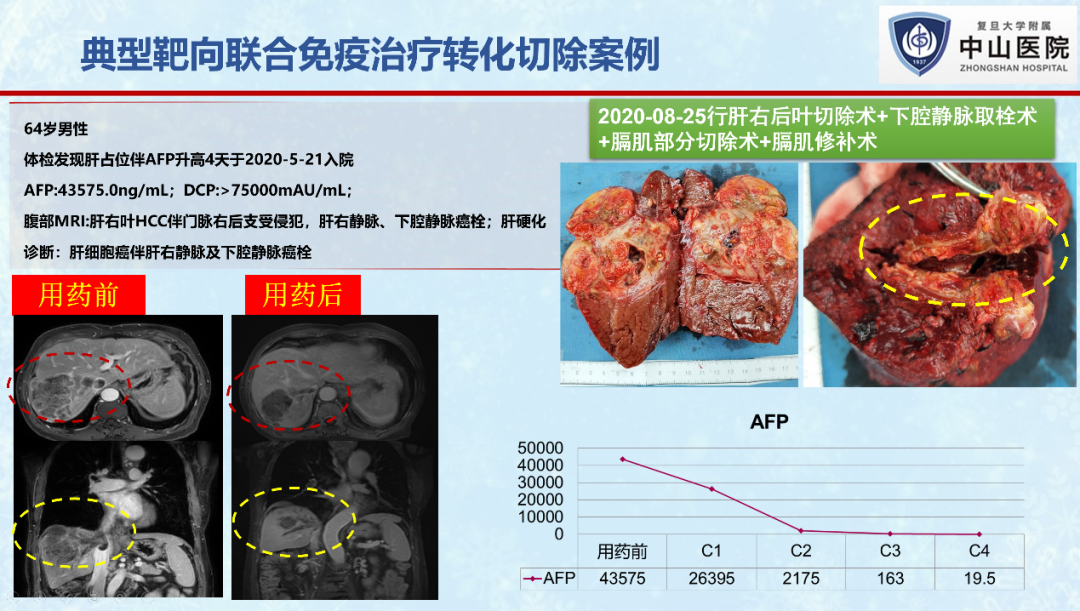
笔者所在团队近期的一项单中心、回顾性研究(未发表数据),共纳入了107例初始不可切除肝癌患者,接受仑伐替尼联合PD-1抗体治疗后,32例评估为可切除,最终30例(30/107, 28%)成功接受R0手术切除。10例(33.3%)达到病理学完全缓解。30例转化切除患者术后一年总体生存率为95.7%,无复发生存率为61.6%。术后中位随访16.5个月后,28例存活,11例患者肿瘤复发,表明转化切除对于改善患者生存预后的重要意义。
值得注意的是,虽然所有患者接受转化切除前,影像学上都表现出不同程度的肿瘤坏死,但生存分析发现,术前影像学评估(mRECIST标准)为完全缓解(CR)或部分缓解(PR)的患者,其无复发生存期显著长于评估为疾病稳定(SD)的患者(P=0.037)。10例病理学完全缓解患者的无复发生存期也显著长于未完全缓解患者(P=0.0041)。这表明肿瘤的缓解程度与患者转化切除术后无瘤生存时间密切相关,肿瘤达到客观缓解的病人在手术切除后能获得更长的无瘤生存期。也提示我们转化切除时机的选择除了考虑肿瘤的可切除性、手术本身的安全性外,还需考虑药物治疗后肿瘤的缓解程度,缓解程度越深的患者可能从转化切除中获益的可能性越大。但是,值得一提的是,影像学评估的缓解程度往往不能准确反映病理学缓解程度,今后的研究中还需结合深度学习、影像组学、血清标志物筛选等手段来进一步提高疗效评估的准确性。
肝癌的高早期复发率往往是由于肝内微转移灶的存在。在此项研究中,基线磁共振结果显示20例(20/30,66.7%)肝癌患者合并有大血管侵犯。手术后,仅在8例(8/30,26.7%)患者切除的肿瘤样本中检测到MVI。与之前报道的肿瘤大于6.5cm时63%的MVI阳性率相比[21],仑伐替尼联合PD-1抗体不仅可以导致大血管癌栓的坏死,还可以有效清除微脉管癌栓,降低MVI发生率。此外,术后生存分析发现MVI阳性患者的无瘤生存期和总生存期均显著短于MVI阴性的患者(P<0.05)。这表明MVI仍然是肝癌患者转化切除术后早期复发和不良预后的重要危险因素。针对转化治疗后MVI的术前无创预测[22-24],以及术后抗复发治疗策略也是未来研究的重点方向。
结语
肝癌的转化治疗将初始不可切除肝癌转化为可切除肝癌,提高手术切除率的同时,延长了晚期肝癌的生存时间。转化治疗对于提高我国肝癌患者的5年生存率,实现肝癌在“健康中国2030”规划纲要中的目标和任务具有重大意义。以靶向联合免疫治疗为基础的系统治疗方案,已成为肝癌转化治疗的重要手段和途径,掀起了肝癌转化治疗研究的新一轮高潮,各种基于中国国情的肝癌转化治疗研究探索方兴未艾。但是,目前肝癌转化治疗仍然面临诸多挑战,转化方案的选择、靶免治疗的疗效的预测以及评价标准、药物不良反应的应对、进展后的治疗方案选择等,仍处于探索阶段,需要进一步多中心、大队列前瞻性研究进行论证。同时也有赖于基础研究方面的突破,深刻认识肿瘤耐药的形成机制、筛选灵敏的疗效预测标志物,以及研发新的免疫检查点阻断剂等,均会极大地助力肝癌的转化研究。在肝癌的诊疗实践中,需要多学科诊疗团队精诚协作,实现患者的长期生存获益。
参考文献
[1]SUNG H, FERLAY J, SIEGEL R L, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries [J]. CA Cancer J Clin, 2021, 71(3): 209-49.
[2]中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗指南(2022年版) [J]. 中华消化外科杂志, 2022, 21(2): 143-68.
[3]LLOVET J M, ZUCMAN-ROSSI J, PIKARSKY E, et al. Hepatocellular carcinoma [J]. Nat Rev Dis Primers, 2016, 2: 16018.
[4]FINN R S, QIN S, IKEDA M, et al. IMbrave150: Updated overall survival (OS) data from a global, randomized, open-label phase III study of atezolizumab (atezo) + bevacizumab (bev) versus sorafenib (sor) in patients (pts) with unresectable hepatocellular carcinoma (HCC). 2021 ASCO GI, Abstract 267.
[5]REN Z, XU J, BAI Y, et al. Sintilimab plus a bevacizumab biosimilar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT-32): a randomised, open-label, phase 2-3 study [J]. Lancet Oncol, 2021, 22(7): 977-90.
[6]FINN R S, IKEDA M, ZHU A X, et al. Phase Ib Study of Lenvatinib Plus Pembrolizumab in Patients With Unresectable Hepatocellular Carcinoma [J]. J Clin Oncol, 2020, 38(26): 2960-70.
[7]XU J, SHEN J, GU S, et al. Camrelizumab in Combination with Apatinib in Patients with Advanced Hepatocellular Carcinoma (RESCUE): A Nonrandomized, Open-label, Phase II Trial [J]. Clin Cancer Res, 2021, 27(4): 1003-11.
[8]中国抗癌协会肝癌专业委员会转化治疗协作组. 肝癌转化治疗中国专家共识(2021版) [J]. 中华消化外科杂志, 2021, 20(06): 600-16.
[9]樊嘉,高强. 肝癌的免疫治疗:有希望便是光明 [J]. 中华消化外科杂志, 2022, 21(2): 199-240.
[10]KUDO M, FINN R S, QIN S, et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial [J]. Lancet, 2018, 391(10126): 1163-73.
[11]FINN R S, RYOO B Y, MERLE P, et al. Pembrolizumab As Second-Line Therapy in Patients With Advanced Hepatocellular Carcinoma in KEYNOTE-240: A Randomized, Double-Blind, Phase III Trial [J]. J Clin Oncol, 2020, 38(3): 193-202.
[12]REIG M, FORNER A, RIMOLA J, et al. BCLC strategy for prognosis prediction and treatment recommendation: The 2022 update [J]. J Hepatol, 2022, 76(3): 681-93.
[13]BENSON A B, D‘ANGELICA M I, ABBOTT D E, et al. Hepatobiliary Cancers, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology [J]. J Natl Compr Canc Netw, 2021, 19(5): 541-65.
[14]ZHANG W, HU B, HAN J, et al. Surgery After Conversion Therapy With PD-1 Inhibitors Plus Tyrosine Kinase Inhibitors Are Effective and Safe for Advanced Hepatocellular Carcinoma: A Pilot Study of Ten Patients [J]. Front Oncol, 2021, 11: 747950.
[15]张雯雯, 胡丙洋, 韩骏, et al. PD-1抑制剂与多靶点酪氨酸激酶抑制剂联合方案用于进展期肝癌转化治疗研究的初步报告 [J]. 中华肝胆外科杂志, 2020, 26(12): 947-8.
[16]ZHU X D, HUANG C, SHEN Y H, et al. Downstaging and Resection of Initially Unresectable Hepatocellular Carcinoma with Tyrosine Kinase Inhibitor and Anti-PD-1 Antibody Combinations [J]. Liver Cancer, 2021, 10(4): 320-9.
[17]SUN H, ZHU X, GAO Q, et al. Sintilimab combined with bevacizumab biosimilar as a conversion therapy in potentially resectable intermediate stage hepatocellular carcinoma (HCC): A phase II trial [J]. 2022 ESMO, Abstract 711P.
[18]YANG X, XU H, ZUO B, et al. Downstaging and resection of hepatocellular carcinoma in patients with extrahepatic metastases after stereotactic therapy [J]. Hepatobiliary Surg Nutr, 2021, 10(4): 434-42.
[19]HE M K, LIANG R B, ZHAO Y, et al. Lenvatinib, toripalimab, plus hepatic arterial infusion chemotherapy versus lenvatinib alone for advanced hepatocellular carcinoma [J]. Ther Adv Med Oncol, 2021, 13: 17588359211002720.
[20]ZHANG J, ZHANG X, MU H, et al. Surgical Conversion for Initially Unresectable Locally Advanced Hepatocellular Carcinoma Using a Triple Combination of Angiogenesis Inhibitors, Anti-PD-1 Antibodies, and Hepatic Arterial Infusion Chemotherapy: A Retrospective Study [J]. Front Oncol, 2021, 11: 729764.
[21]PAWLIK T M, DELMAN K A, VAUTHEY J N, et al. Tumor size predicts vascular invasion and histologic grade: Implications for selection of surgical treatment for hepatocellular carcinoma [J]. Liver Transpl, 2005, 11(9): 1086-92.
[22]LIM K C, CHOW P K, ALLEN J C, et al. Microvascular invasion is a better predictor of tumor recurrence and overall survival following surgical resection for hepatocellular carcinoma compared to the Milan criteria [J]. Ann Surg, 2011, 254(1): 108-13.
[23]ZHOU Y M, YANG J M, LI B, et al. Risk factors for early recurrence of small hepatocellular carcinoma after curative resection [J]. Hepatobiliary Pancreat Dis Int, 2010, 9(1): 33-7.
[24]SUN B Y, GU P Y, GUAN R Y, et al. Deep-learning-based analysis of preoperative MRI predicts microvascular invasion and outcome in hepatocellular carcinoma [J]. World J Surg Oncol, 2022, 20(1): 189.
责任编辑:Marie
排版编辑:邓文普
转自:良医汇-肿瘤医生APP
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论