 三甲
三甲
2022第六次全国幽门螺杆菌感染处理共识报告(非根除治疗部分)
一、H.pylori感染的诊断
【陈述1】尿素呼气试验(urea breath test,UBT)是临床最受推荐的非侵入性H.pylori感染诊断方法,单克隆粪便抗原试验可以作为备选;血清学试验主要用于流行病学调查,不作为H.pylori现症感染的诊断方法。(证据等级:B;推荐强度:强;共识水平:100%)
非侵入性H.pylori感染诊断的方法包括UBT、单克隆粪便抗原试验和血清学试验。UBT是临床最常用的非侵入性诊断方法,具有操作简便、准确性较高和不受H.pylori在胃内灶性分布影响等优点[1,5,6]。UBT包括13C-UBT和14C-UBT,前者包含的13C是稳定核素,无放射性;后者包含的14C是不稳定核素,具有放射性,不推荐妊娠期、哺乳期妇女及儿童使用14C-UBT。
大量临床研究证实13C-UBT和14C-UBT的灵敏度、特异度相似,均具有较高的准确性[7]。影响UBT检测结果准确性的主要因素如下:①近期使用药物,如质子泵抑制剂(proton pump inhibitor,PPI)、钾离子竞争性酸阻滞剂(potassium-competitive acid blocker,P-CAB)、铋剂和抗生素等,均可能导致UBT假阴性;②提高胃内酸度(如添加柠檬酸制剂)可能有助于提高检测的准确性;③13C-尿素剂量越高,13C-UBT检测准确性越高,75 mg的剂量用于成人和12~17岁的青少年,45 mg的剂量仅用于3~11岁的儿童[8];④上消化道急性出血和胃大部切除手术史可能导致UBT假阴性[9]。当UBT检测值接近临界值时,其结果可能不可靠,可间隔一段时间复查或用其他方法检测。
单克隆粪便抗原试验的准确性与UBT相似,但需收集粪便,在成年人中接受度有限;在不愿接受UBT,或呼气配合欠佳者(如儿童),单克隆粪便抗原试验有优势[10,11]。
血清学试验主要检测血清中的抗H.pylori IgG,常用于流行病学调查。但抗体阳性不能反映现症感染,不能用于H.pylori根除治疗后的复查;特殊情况下,如消化性溃疡出血、胃黏膜相关淋巴组织(mucosa-associated lymphoid tissue,MALT)淋巴瘤等疾病患者H.pylori抗体阳性,且未接受过根除治疗,可视为现症感染[12]。
H.pylori的细胞毒素相关基因A(cytotoxin associated gene A,CagA)和空泡变性细胞毒素A(vacuolation toxin A,VacA)蛋白是致病因子,检测血清抗CagA、VacA抗体,可以评价H.pylori菌株的毒力水平[13]。
【陈述2】除血清学试验、分子生物学检测方法外,使用其他方法检测H.pylori前必须停用PPI、P-CAB至少2周,铋剂、抗生素(包括具有抗菌作用的中药)至少4周。(证据等级:B;推荐强度:强;共识水平:100%)
除血清学试验、分子生物学检测方法外,其他检查结果的可靠性与胃黏膜H.pylori定植密度高低有关[6]。检测前2周内服用抗胃酸分泌药(如PPI、P-CAB),或检测前4周内服用铋剂、抗生素(包括具有抗菌作用的中药),将抑制H.pylori生长,导致胃黏膜H.pylori定植密度下降,尿素酶活性低,相关检查易出现假阴性[14,15,16]。H2受体拮抗剂对检测结果影响少,抗酸剂对其无影响[17,18,19,20]。
【陈述3】H.pylori根除治疗后应常规评估根除效果,评估的时间应在完成治疗至少4周后;评估的最佳方法是UBT,单克隆粪便抗原试验可以作为备选。(证据等级:B;推荐强度:强;共识水平:100%)
我国是H.pylori高感染国家和胃癌高发国家,H.pylori感染后临床结局难以预测,未根除者仍存在发生严重疾病的风险。因此,确认根除治疗结果十分重要,所有接受根除治疗者要复查H.pylori状态[5,17]。复查的时间应在治疗结束后4~6周进行,以避免根除治疗药物(如PPI、铋剂和抗生素等)对检测结果的影响。多数根除治疗者无需复查胃镜,建议采用非侵入性方法检测H.pylori,UBT是首选方法,单克隆粪便抗原试验可以作为备选。
【陈述4】对于行胃镜检查的患者,快速尿素酶试验(rapid urease test,RUT)可作为H.pylori快速检测方法。(证据等级:C;推荐强度:弱;共识水平:96%)
RUT具有快速、简便和准确性相对较高等优点,在完成胃镜检查后能较快获得H.pylori检测结果,阳性者即可行根除治疗[21]。
RUT准确性受活体组织检查(以下简称活检)标本细菌密度、检测时间和检测温度等因素影响。如果活检标本中细菌数量&lt1휐4可能出现假阴性结果[22],多点活检可提高检测准确性[23]。不同RUT试剂检测所需时间有所差异,临床应用时,检测时间应与试剂说明书推荐时间一致[24]。另外,适当提高反应温度可有效缩短RUT所需时间[25]。
H.pylori根除治疗后可能出现细菌密度降低和分布变化,易造成检测结果假阴性,故不推荐RUT用于H.pylori根除治疗后的复查[5]。
胃镜检查本身对H.pylori感染也具有一定的诊断价值,根据内镜下的黏膜形态学特点可将H.pylori感染状态分为无感染、现症感染和既往感染。
【陈述5】胃黏膜组织常规染色(苏木精-伊红染色)通常可有效诊断H.pylori感染。当患者胃黏膜组织学表现为慢性活动性炎症而常规染色为阴性时,可行特殊染色。(证据等级:C;推荐强度:弱;共识水平:100%)
组织学是评估H.pylori相关胃炎的有效标准[5]。在悉尼系统(Sydney system)的慢性胃炎组织学诊断和分类中包含了H.pylori客观评价指标。有经验的病理医师可通过胃黏膜常规染色(苏木精-伊红染色)作出有无H.pylori感染的诊断[1]。
慢性活动性胃炎和淋巴滤泡是H.pylori感染的重要线索,但当标本中H.pylori数量较少时,H.pylori很难被检测出来,可能出现苏木精-伊红染色阴性的情况。此时可使用特殊染色作为补充[26],包括Giemsa染色、Warthin-Starry银染色、免疫组织化学染色等,这些染色方法对比度大,有助于更准确地诊断有无H. pylori感染[27,28]。
【陈述6】H.pylori培养法主要用于H.pylori对相关抗生素的耐药检测。(证据等级:C;推荐强度:弱;共识水平:100%)
适当条件下胃黏膜活检组织H.pylori培养的特异度高,灵敏度为70%~90%[29]。标本保存和运输不当、H.pylori的接种浓度过低、H.pylori暴露于空气中的时间过长等均会影响培养的阳性率[30,31,32]。
H.pylori表型耐药检测方法包括琼脂稀释法、浓度梯度(E-test)法、纸片扩散法和微量肉汤稀释法,可以对阿莫西林、甲硝唑、左氧氟沙星、克拉霉素、四环素等目前用于H.pylori根除的抗生素进行耐药检测[5,33]。
【陈述7】分子生物学方法主要用于H.pylori耐药基因型的检测,克拉霉素、左氧氟沙星耐药基因型检测对H.pylori根除治疗有重要的指导价值。(证据等级:B;推荐强度:强;共识水平:88%)
分子生物学技术不是诊断H.pylori感染的常规方法,但其灵敏度、特异度高,与其他方法(如单克隆粪便抗原试验)相似[34];抗生素耐药是目前H.pylori根除失败的主要原因,H.pylori根除成功的主要决定因素是在治疗前了解其对抗生素耐药性[35]。如在行H.pylori药敏试验前,采用实时聚合酶链反应(polymerase chain reaction,PCR)技术检测克拉霉素、左氧氟沙星耐药基因型,对指导抗生素的选择有重要临床价值[1,36,37]。临床试验表明,前者具有快速、即时、灵敏度和特异度高,以及所需要实验条件比较简便等优点,优于传统的细菌培养和药敏试验[38,39]。但需注意,基因检测的临床应用须依据国家法规进行[39]。
二、H.pylori根除指征
【陈述1】根除H.pylori的获益和风险在不同个体之间存在差异,对于感染者应进行个体化评估和处理。(证据等级:B;推荐强度:强;共识水平:100%)
根除H.pylori可促进消化性溃疡愈合,降低溃疡及其并发症的发生率[40],根除H.pylori可使80%的早期胃MALT淋巴瘤患者获得缓解[41]。与无症状H.pylori感染者相比,上述患者根除H.pylori的获益更大。对于胃癌发生风险高的个体,如有胃癌家族史、早期胃癌接受内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)后、胃黏膜萎缩和(或)肠上皮化生等,根除H.pylori预防胃癌的获益高于低风险者[42]。
老年人群中慢性胃炎,尤其是胃黏膜萎缩和肠上皮化生的发生率比中青年人群高。一项回顾性研究纳入了73 237例H.pylori根除后随访近10年的患者,结果显示60岁以上人群H.pylori根除后胃癌的累积发生率较60岁以下人群下降更为明显[43]。老年人群服用低剂量阿司匹林和(或)非甾体抗炎药(nonsteroidal anti-inflammatory drug,NSAID)的比例相对较高,在拟服药之前根除H.pylori可明显获益[44]。然而,老年人群合并慢性疾病、肾损伤的比例高于中青年人,且老年人合并用药较中青年人多,药物不良反应的风险増加,应充分评估H.pylori根除治疗的风险和获益,个体化掌握根除指征[45]。
对符合根除指征(表1)的H.pylori感染者,在实施根除治疗前,应充分评估根除治疗的获益、一般健康状况,以及药物治疗可能带来的不良反应,进行个体化处理。
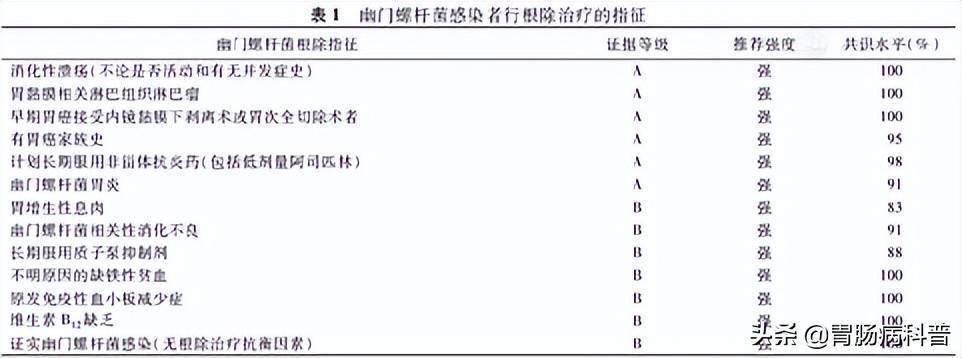
表1:幽门螺杆菌感染者行根除治疗的指征
【陈述2】H.pylori是消化性溃疡的主要病因,无论溃疡是否活动和有无并发症史,均应该检测和根除H.pylori。(证据等级:A;推荐强度:强;共识水平:100%)
H.pylori感染是90%以上十二指肠溃疡和70%~80%胃溃疡的病因,根除H.pylori可使绝大多数消化性溃疡得到永久治愈,根除H.pylori能显著降低溃疡复发率及其并发症的发生率[46]。
【陈述3】根除H.pylori是局部阶段胃MALT淋巴瘤的一线治疗。(证据等级:A;推荐强度:强;共识水平:100%)
对于H.pylori阳性的局部阶段(Lugano Ⅰ/Ⅱ期)胃MALT淋巴瘤,60%~80%的患者在根除H.pylori后可获得缓解[41,47]。因此,根除H.pylori是局部阶段胃MALT淋巴瘤的一线治疗。根除H.pylori治疗对大多数有t(11,18)易位的胃MALT淋巴瘤无效,该类型MALT淋巴瘤需要进行化学治疗和(或)放射治疗。2项新近发表的meta分析显示,部分H.pylori阴性的胃MALT淋巴瘤患者接受H.pylori根除治疗也可获得疾病缓解[48,49]。
胃MALT淋巴瘤患者在根除H.pylori后均需接受密切随访。如根除H.pylori治疗后病变无应答或继续进展,则应进行化学治疗和(或)放射治疗。
【陈述4】H.pylori感染导致慢性活动性胃炎,根除H.pylori可显著改善H.pylori胃炎患者胃黏膜炎症,延缓或阻止胃黏膜萎缩、肠上皮化生的发生和发展,在部分患者可逆转萎缩,甚至可能逆转肠上皮化生,降低胃癌发生风险。(证据等级:A;推荐强度:强;共识水平:91%)
几乎所有H.pylori感染者(包括体检证实的无症状感染者)都存在不同程度的慢性活动性胃炎(即H.pylori胃炎)[50],H.pylori感染与慢性活动性胃炎之间的因果关系符合科赫法则(Koch postulates)[51,52]。因此,H.pylori胃炎是一种感染性疾病,无论有无症状或并发症,只要证实H.pylori感染,且不存在抗衡因素者都需要接受根除治疗。根除H.pylori后胃黏膜活动性炎症可消退,慢性炎症反应也有不同程度减轻,其获益远大于可能出现的负面影响[1,53]。
H.pylori感染诱发的炎症反应与胃黏膜萎缩和(或)肠上皮化生的发生与发展密切相关[54]。根除H.pylori可延缓或阻止胃黏膜萎缩和(或)肠上皮化生的发生与发展,并使部分患者的胃黏膜萎缩、甚至肠上皮化生得到逆转[55,56],降低胃癌发生风险。
新近的一项meta分析纳入4项临床随机对照试验(randomized controlled trial, RCT)研究,H.pylori根除组共1 501例,安慰剂组共1 505例患者,H.pylori根除组患者萎缩性胃炎较基线改善程度优于安慰剂组(OR=2.61,95%置信区间1.41~4.81,P=0.002);同时,在2项RCT研究的526例患者中,H.pylori根除组有74例患者肠上皮化生获得逆转或改善,而安慰剂组相应的病例数为36例,差异有统计学意义(OR=2.61,95%置信区间1.66~4.11,P&lt0.001)[57]。
【陈述5】H.pylori根除后胃增生性息肉可以缩小或消失,根除H.pylori是胃增生性息肉的优选治疗。(证据等级:B;推荐强度:强;共识水平:83%)
胃增生性息肉常见于慢性萎缩性胃炎患者,文献报道其与H.pylori感染相关[58]。3项RCT研究显示,根除H.pylori后,胃增生性息肉缩小或消失,而对照组息肉无变化或增大[59,60,61]。新近的meta分析显示,接受H.pylori根除治疗后或根除成功者,胃增生性息肉的消除率达59%[62]。日本H.pylori感染的处理共识建议将根除H.pylori作为胃增生性息肉的首选治疗方法,尤其对于多发性胃增生性息肉[63]。
对H.pylori根除无应答的体积较大或伴有异型增生、出血的息肉,应考虑予内镜下切除[64]。
【陈述6】对未经检查的消化不良患者可实施H.pylori“检测和治疗“策略,但应综合考虑当地上消化道肿瘤发病率、成本-效益比、患者的年龄和意愿等因素。对于H.pylori感染伴消化不良症状的患者,根除H.pylori可使部分患者症状获得长期缓解,应优先选择。(证据等级:B;推荐强度:强;共识水平:91%)
“检测和治疗“策略是国际上广泛认可的用于未经检查的消化不良的处理策略[65]。该策略无需进行胃镜检查,但有漏检上消化道肿瘤的风险。在胃镜检查费用高和胃癌发病率低的地区实施该策略有较好的成本-效益比[66]。这一策略用于消化不良的治疗比使用PPI或H2受体拮抗剂进行经验性抑酸治疗更有效(RR=0.59,95%置信区间0.42~0.83)[67]。
我国胃镜检查费用较低,胃癌发病率存在显著的地区差异。该策略不适用于胃癌高发区的消化不良患者。在胃癌低发区实施这一策略,排除有报警症状和胃癌家族史者,将年龄阈值限制在小于35岁,可显著降低漏检上消化道肿瘤的风险。我国胃镜检查普及度广,胃镜检查作为备选还是首选,也可取决于患者意愿。
部分H.pylori胃炎患者可出现消化不良症状[68],H.pylori相关性消化不良是独立于功能性消化不良的另一种疾病,在作出可靠的功能性消化不良诊断前,需排除H.pylori相关性消化不良[69]。因为一次治疗可获得长期效果,所以根除H.pylori是治疗H.pylori相关性消化不良最经济、有效的方法[70],因此应作为优先选择的治疗。这一策略不仅疗效相对较好,而且可以预防消化性溃疡和胃癌,减少传染源。
【陈述7】H.pylori阳性的早期胃癌患者行ESD术后仍有发生异时性胃癌的风险,应尽早接受H.pylori根除治疗。(证据等级:A;推荐强度:强;共识水平:100%)
早期胃癌行ESD治疗的患者每年异时性胃癌发生率为3%[71],H.pylori持续感染是早期胃癌ESD治疗后异时性病变发生的独立危险因素[71,72]。对于H.pylori阳性的早期胃癌患者,ESD治疗后根除H.pylori可显著降低异时性胃癌的发生风险[73]。最近,Khan等[57]纳入4项RCT研究的meta分析,共包括2 658例H.pylori阳性的接受内镜下治疗的早期胃癌患者,发现ESD治疗后根除H.pylori可降低53%的异时性胃癌发生风险;且随着随访时间的延长,根除H.pylori降低异时性胃癌发生风险的效应进一步增加。
【陈述8】有胃癌家族史的H.pylori感染者胃癌发生风险增加,应接受H.pylori根除治疗。(证据等级:A;推荐强度:强;共识水平:95%)
H.pylori感染和胃癌家族史均为胃癌发生的主要危险因素。胃癌患者一级亲属患胃癌的风险是对照组的3倍以上,而H.pylori阳性胃癌患者的一级亲属患胃癌的风险是H.pylori阴性且无胃癌家族史者的5倍以上[74]。一项单中心、双盲、安慰剂对照研究纳入1 676例有胃癌一级亲属的H.pylori感染者,对受试者进行了超过9年的随访,H.pylori根除治疗组和安慰剂治疗组胃癌发生率分别为1.2%(10/832)、2.7%(23/844),提示H.pylori根除治疗可降低55%的胃癌发生风险。H.pylori根除成功组、H.pylori持续感染组胃癌发生率分别为0.8%(5/608)、2.9%(28/979),H.pylori根除成功可降低73%的胃癌发生风险[75]。
【陈述9】H.pylori胃炎是可传染的感染性疾病,对于家庭成员中与感染者共同居住且无抗衡因素的成年人,建议检测和根除H.pylori,以阻断H.pylori在家庭成员间的传播。(证据等级:B;推荐强度:弱;共识水平:96%)
H.pylori感染可在人与人之间传播,并且有家庭聚集现象,共同居住者H.pylori感染率高,家庭成员感染的菌株可完全相同或具有高同源性[76],被H.pylori感染的家庭成员始终是潜在的传染源,存在持续传播的可能性。
家庭成员共同治疗可阻断H.pylori在家庭中的传播,有助于减少根除后的再感染[77,78]。新近发表的1篇纳入12项RCT研究的meta分析显示,家庭成员共同治疗根除率较单独治疗更高(OR=2.93,95%置信区间1.68~5.13),且复发率较单独治疗降低(OR=0.30,95%置信区间0.19~0.48)[79]。因此,家庭成员中与感染者共同居住且无抗衡因素的成年人检测和根除H.pylori有助于阻断H.pylori在家庭成员之间的传播。家庭中的儿童和老年H.pylori感染者,应根据相关疾病状态和获益风险制订个体化管理策略。
新近发布的《中国居民家庭幽门螺杆菌感染的防控和管理专家共识(2021年)》[80]对我国居民家庭H.pylori感染和相关疾病的防控提供了指导和建议。
【陈述10】长期服用NSAID(包括低剂量阿司匹林)的H.pylori感染者消化性溃疡发生风险增加,应在服用前根除H.pylori。(证据等级:A;推荐强度:强;共识水平:98%)
阿司匹林、NSAID和H.pylori感染是消化性溃疡及其并发症发生的独立危险因素[81]。服用NSAID增加H.pylori感染者消化性溃疡发生风险;服用NSAID前根除H.pylori可降低溃疡发生风险[82]。
纳入17项研究的meta分析发现,在低剂量阿司匹林服用者中,H.pylori感染使消化性溃疡发生风险增加70%以上,故上述患者应检测并根除H.pylori,以降低消化性溃疡的发生风险[83]。老年人群服用低剂量阿司匹林和(或)NSAID的比例相对较高,在拟服药之前根除H.pylori可明显获益[44]。
一项单中心、回顾性队列研究显示,H.pylori感染可能增加非阿司匹林抗血小板药物服用者的消化性溃疡出血风险,但未增加抗凝药服用者的溃疡出血风险[84]。根除H.pylori是否降低服用非阿司匹林抗血小板药物和抗凝药物者消化性溃疡出血风险尚缺乏临床证据。
【陈述11】长期服用PPI会使H.pylori胃炎的分布部位发生改变,增加胃体胃炎发生的风险,根除H.pylori可降低这种风险。(证据等级:B;推荐强度:强;共识水平:88%)
H.pylori胃炎一般可表现为胃窦为主的胃炎。长期服用PPI者胃酸分泌减少,H.pylori定植部位从胃窦向胃体位移,发生胃体胃炎[85],增加胃体黏膜萎缩的风险[86]。根除H.pylori可降低或消除长期服用PPI者胃体胃炎发生的风险[87]。
【陈述12】H.pylori感染与不明原因缺铁性贫血、原发免疫性血小板减少症、维生素B12缺乏症等疾病相关。对于这些疾病患者,应检测并根除H.pylori。(证据等级:B;推荐强度:强;共识水平:100%)
H.pylori感染可能与某些胃外疾病相关[88]。H.pylori感染与成人和儿童不明原因缺铁性贫血密切相关,根除H.pylori可提高血红蛋白水平,与铁剂联合应用可提高疗效[89]。
对于H.pylori阳性的原发免疫性血小板减少症患者,约50%的成人患者和约39%的儿童患者在根除H.pylori后血小板水平可得到提高[90]。
有研究显示,H.pylori感染可能与维生素B12吸收不良相关,根除H.pylori可作为维生素B12缺乏的辅助治疗[91]。
三、H.pylori感染与胃癌
【陈述1】H.pylori感染是胃癌最主要的可控危险因素。
(证据等级:A;推荐强度:强;共识水平:100%)
早在1994年WHO下属的国际癌症研究机构就将H.pylori定义为Ⅰ类致癌原,2022年美国卫生和公共服务部将H.pylori列为明确致癌物。
非贲门型胃癌是H.pylori感染、环境因素、遗传因素共同作用的结果,小部分与EB病毒感染有关[92,93]。H.pylori感染在非贲门型胃癌中的人群归因危险度百分比为75%~89%[94,95]。肠型胃癌和弥漫型胃癌均与H.pylori感染相关[93,96]。
贲门型胃癌与H.pylori感染的关系在全球不同地区存在差异,H.pylori感染在我国贲门型胃癌中的人群归因危险度百分比为62%[97]。
大量研究证据表明,根除H.pylori可有效地降低胃癌的发生风险。因此,H.pylori感染是导致中国胃癌发病最主要的可控危险因素。
【陈述2】根除H.pylori可有效地降低胃癌发生风险。胃黏膜萎缩和(或)肠上皮化生发生前实施H.pylori根除治疗更有效。(证据等级:A;推荐强度:强;共识水平:100%)
根据Correa级联反应模式,肠型胃癌的发生经历正常胃黏膜→浅表性胃炎→萎缩性胃炎→肠上皮化生→异型增生→胃癌的演变进程[98]。根除H.pylori可有效降低胃癌发生风险[95,99]。
研究证明,胃黏膜萎缩的H.pylori感染者的胃癌发生风险比无萎缩者更高[100]。在胃黏膜萎缩和(或)肠上皮化生发生前的个体中根除H.pylori以预防胃癌的发生,其效果优于在已有胃黏膜萎缩和(或)肠上皮化生的个体中根除[101,102]。
根除H.pylori可改善胃黏膜炎症反应,阻止或延缓胃黏膜萎缩、肠上皮化生的发生和发展,部分逆转萎缩和肠上皮化生,但肠上皮化生的逆转似在根除H.pylori很长时间后发生[103,104,105]。
【陈述3】在胃癌高发区人群中,筛查并根除H.pylori以预防胃癌具有成本-效益比优势,推荐筛查并根除H.pylori。(证据等级:A;推荐强度:强;共识水平:100%)
全球共识将胃癌发病率&gt20例/(10万·年)的地区定义为胃癌高发区[35]。我国整体上属于胃癌高发区[发病率为30例/(10万·年)],但仍需根据各省市的详细数据来划分胃癌高、中、低发区[106]。
根据统计模型分析结果,筛查并根除H.pylori以预防胃癌对于东亚人群、无症状中国人群均具有成本-效益比优势[107,108,109,110,111]。
筛查并根除H.pylori不仅可以降低胃癌发生风险,还可以预防H.pylori相关消化性溃疡和消化不良,一举多得。因此,在胃癌高发区人群中,推荐筛查并根除H.pylori。
该策略的实施过程应做好质控,包括筛查方法的准确性、治疗方案的有效性和患者的依从性等[35]。
【陈述4】推荐胃癌高风险个体筛查并根除H.pylori。(证据等级:B;推荐强度:强;共识水平:100%)
胃癌患者一级亲属、已证实有胃黏膜萎缩和(或)肠上皮化生、来自胃癌高发区或存在其他胃癌危险因素(包括摄入高盐、油炸、腌制食品,吸烟,大量饮酒)、早期胃癌ESD治疗后等均属于胃癌高风险个体[75,112,113,114,115,116,117,118,119]。
有研究表明,年龄是胃癌的独立危险因素,胃癌发病风险随年龄增长不断增加。我国一项研究评估了H.pylori“筛查和治疗“策略预防H.pylori相关疾病的成本-效益比,结果显示在20~60岁任何时间点开始实施“筛查和治疗“策略较不实施均具有优越性[108]。此外,我国香港的研究显示,相比于一般人群,60岁以上人群接受根除治疗后,胃癌风险大幅降低;同时根据患者完成根除治疗的时间进行分层,治疗完成10年以上人群的胃癌风险显著降低。因此认为,对于老年人和尽早接受根除治疗的个体,根除H.pylori对降低胃癌发生风险的效果显著[43]。
【陈述5】根除H.pylori预防胃癌,并未增加其他严重疾病的发生风险,而且通过预防相关胃十二指肠疾病带来了额外获益。(证据等级:B;推荐强度:强;共识水平:95%)
两项大样本长期随访研究证实,规范根除H.pylori降低胃癌发生风险,并未带来严重不良反应[99,111]。
根除H.pylori不仅可以预防胃癌,还可以降低H.pylori相关消化性溃疡、消化不良等疾病的发生风险[120,121,122,123],且在年轻成人中根除H.pylori还可以降低向子代传播的风险。此外,根除H.pylori不增加胃食管反流病和代谢综合征等疾病的发生风险[35,124,125,126]。
【陈述6】血清胃蛋白酶原、胃泌素-17和H.pylori抗体联合检测可用于筛查胃癌高风险人群。(证据等级:A;推荐强度:强;共识水平:86%)
包括胃蛋白酶原(Ⅰ和Ⅱ)、胃泌素-17和H.pylori抗体在内的一组血清学试验已被证实可用于筛查胃黏膜萎缩,包括胃窦或胃体黏膜萎缩[127],被称为“血清学活检“。非侵入性血清学筛查可用于胃癌高风险人群的筛查[114,128,129,130,131]。
我国学者设计并验证了基于年龄、性别、血清学指标、饮食习惯的胃癌风险分层量表,发现胃癌患者中70.8%属于中高危人群[114]。血清学筛查与内镜检查相结合,有助于提高胃癌预防水平[128]。
【陈述7】根除H.pylori后有胃黏膜萎缩和(或)肠上皮化生者需要随访。(证据等级:C;推荐强度:弱;共识水平:98%)
已经存在胃黏膜萎缩和(或)肠上皮化生者,根除H.pylori后不能完全消除胃癌发生风险[132],因此,需要对其进行定期内镜随访[133],随访间隔时间应根据癌前病变的范围、程度,以及患者意愿共同决定。
内镜下胃黏膜萎缩和(或)肠上皮化生范围及其严重程度可根据京都内镜胃炎分类系统判断[134],组织病理学评估可依据胃黏膜萎缩性胃炎评价系统(operative link for gastritis assessment,OLGA)或胃黏膜肠上皮化生评价系统(operative link for gastric intestinal metaplasia assessment,OLGIM)分期[135,136]。
OLGA或OLGIM有助于病变的监测,分期为Ⅲ期和Ⅳ期者的胃癌发生风险显著增加[112,137]。内镜下中至重度胃黏膜萎缩的患者(木村-竹本分类C3~O3)胃癌发生风险显著升高[138]。日本一项大样本研究表明,木村-竹本分类为O1~O3者胃癌年发病率为0.31%,约为非萎缩者(C1型)的3倍[100]。
【陈述8】应提高公众对根除H.pylori可预防胃癌的知晓度。(证据等级:B;推荐强度:强;共识水平:97%)
加强公众对根除H.pylori可预防胃癌的认识,有助于推动胃癌的预防[139]。公众应知晓的内容如下:H.pylori可导致多种消化道疾病包括胃癌;根除H.pylori可降低胃癌的发生风险,特别是在胃黏膜萎缩和(或)肠上皮化生发生前根除获益更大。此外,纠正不良生活习惯(摄入油炸、腌制、高盐食品,吸烟,大量饮酒等)和增加新鲜蔬菜、水果的摄入对预防胃癌也很重要。
开展公众教育的方式包括提高政府关注度,加强大众媒体宣传和基层保健宣教,正确引导社会公众对H.pylori危害和其他胃癌危险因素的认知[140]。
接种有效疫苗可能是H.pylori感染防控的最佳措施。国内外H.pylori疫苗的前期研发已取得初步进展[141],但其保护作用是否足够持久有待进一步评估,短期内尚不具备大规模应用于临床的条件。
四、H.pylori感染与胃肠道微生态
【陈述1】H.pylori感染降低了胃内微生物种群的丰度和多样性,根除H.pylori有助于正常胃内微生物种群的恢复。(证据等级:B;推荐强度:强;共识水平:100%)
健康人胃内寄居着众多微生物,绝大多数是细菌,主要分为5个门:厚壁菌门、变形菌门、放线菌门、拟杆菌门和梭杆菌门[142,143]。感染H.pylori之后,H.pylori占据了胃内大多数的生态位,成为优势菌群,比例最高可达到95%,其所属的螺杆菌属和变形菌门的相对丰度显著增高[144,145,146]。其他细菌的生存空间被挤压,乳酸菌、放线菌、普氏菌和拟杆菌等的相对丰度明显降低,导致胃内微生物的多样性显著下降[146,147]。研究表明,H.pylori感染者胃内微生物多样性显著低于匹配人群中的非感染者,而在成功根除H.pylori后胃内微生物的丰度和多样性随之升高,并逐渐恢复至与H.pylori阴性对照者相似的程度[148,149]。
【陈述2】根除H.pylori短期改变了肠道微生物种群的多样性和结构,但对肠道微生物种群的长期影响较小。(证据等级:B;推荐强度:强;共识水平:90%)
H.pylori根除方案主要由PPI和2种抗生素组成,两者均可影响肠道微生物种群的结构和功能[150,151]。研究表明,H.pylori根除治疗可使菌群Alpha多样性明显降低,Beta多样性也发生显著改变[151,152]。三联疗法可使大多数患者肠道内条件致病菌如大肠埃希菌、志贺菌和肺炎克雷伯菌等的比例上升[153];铋剂四联疗法可导致青春双歧杆菌的多样性和相对丰度显著下降,屎肠球菌的相对丰度增高[154]。此外,H.pylori根除治疗还可能引起肠道大肠埃希菌耐药率和红霉素耐药基因表达水平增高[152],甚至可能出现抗生素多重耐药细菌[154]。但是,H.pylori根除治疗引起的肠道微生态变化基本呈短期改变,停药8周后肠道菌群失衡开始逐渐恢复,接受三联疗法者1年后基本恢复到基线水平,而采用四联疗法和序贯治疗者1年后仍未完全恢复[151,152,153,154]。
【陈述3】胃内其他微生物与H.pylori的相互作用促进了胃癌的发生和发展。(证据等级:D;推荐强度:弱;共识水平:88%)
尽管H.pylori是肠型胃癌的促发因素,但仅有约1%的H.pylori感染者最终会发生胃癌[155],表明胃癌的发生是多因素共同作用的结果。与慢性胃炎患者相比,胃癌患者胃黏膜内叶杆菌、肠杆菌、梭状芽孢杆菌、红球菌等,以及产硝基细菌显著富集,而螺杆菌丰度明显下降[144,156];动物实验表明,仅感染H.pylori的无菌小鼠发生胃癌的时间比同时感染H.pylori和其他胃内微生物的小鼠明显延迟[157,158],提示除H.pylori外,胃内其他微生物也参与了胃癌的发生和发展[158]。我国一项基于人群的前瞻性研究发现,胃黏膜萎缩、肠上皮化生和异型增生患者胃内H.pylori与梭杆菌、奈瑟菌、普雷沃菌、韦荣球菌等相互作用可能与胃癌前病变的进展有关[159]。胃内链球菌、丙酸杆菌等微生物在胃癌的进展中也可能具有潜在的促进作用[156,160,161]。
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论