
术前无解?甲状腺滤泡癌(FTC)与滤泡性肿瘤的鉴别
转发Jeff卸甲而行文章
前 言
甲状腺滤泡癌(FTC)
是仅次于乳头状癌的第2大常见甲状腺癌
滤泡癌准确的名称为滤泡性甲状腺癌
Follicular Thyroid Carcinoma
是一种来源于甲状腺滤泡细胞的分化型甲状腺癌
发病率约占所有甲状腺癌的10-15%
滤泡癌通常有包膜、浸润性生长
容易经血行转移到肺部和骨骼
初次就诊时约有10-15%的患者已经发生远转
整体患者群体远转概率为15-27%
滤泡癌整体预后较乳头状癌差
10年生存率约为78%
恶性的滤泡癌和良性的滤泡性腺瘤
术前鉴别非常困难
超声、穿刺、冰冻病理都帮助不大
导致滤泡癌患者经常当做良性切除
大病理出来之后才发现手术清扫范围不足
这是术前临床无解的专业顶级难点问题
本期Jeff和大家一起进行分析和系统探索
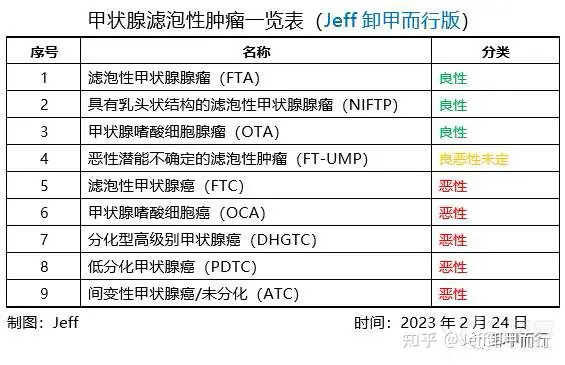
一、甲状腺滤泡癌及诊断
01、什么是滤泡性肿瘤?
在弄清楚滤泡癌之前
需要了解什么是滤泡性肿瘤
滤泡性肿瘤是甲状腺结节病变中
显微镜下具有滤泡结构的肿瘤性病变的统称
包括良性的到恶性肿瘤的一个谱系
因为乳头状癌有比较典型的核型
因此滤泡性肿瘤排除明确的乳头状癌核型
但这个分类常常存在交叉
结合2022年第5版甲状腺肿瘤分类标准
Jeff界定滤泡性肿瘤的范围包括
其中个别有乳头状结构的分类可能会有争议
就先这么分吧
02、什么是滤泡性甲状腺癌?
滤泡性甲状腺(FTC)
定义为滤泡上皮细胞来源
没有乳头状癌核型的恶性甲状腺肿瘤
滤泡癌(恶性)和良性腺瘤的区别
就在于是否存在包膜侵犯和(或)血管侵犯
存在包膜侵犯和(或)血管侵犯的为癌
不存在侵犯的属于良性肿瘤
不确定是否侵犯的划入恶性潜能不确定的滤泡性肿瘤
由于生理形态和病理结构和良性肿瘤高度相似
滤泡癌和良性腺瘤术前超声几乎难以有效分辨
细针穿刺(FNAC)和粗针活检(CNB)
因无法提供完整的纤维包膜和血管浸润情况
对辅助诊断没有帮助
术中冰冻病理同样难以发现包膜或血管侵袭
最终需要等到术后石蜡病理才能进行鉴别
因此滤泡癌和良性腺瘤术前鉴别诊断
是临床医生“术前无解”难以逾越的挑战性课题
甲状腺滤泡癌示意图 ,显微镜下可见包膜侵犯
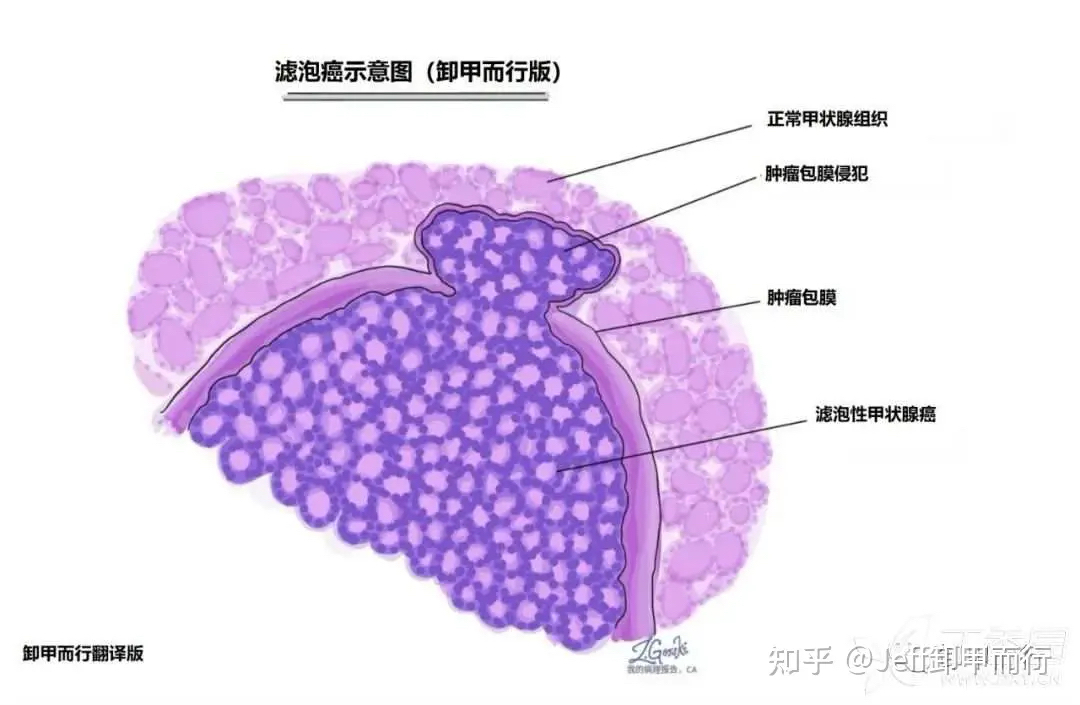
来源:http://mypathologyreport.ca
甲状腺滤泡性肿瘤示意图,显微镜下肿瘤没有包膜侵犯
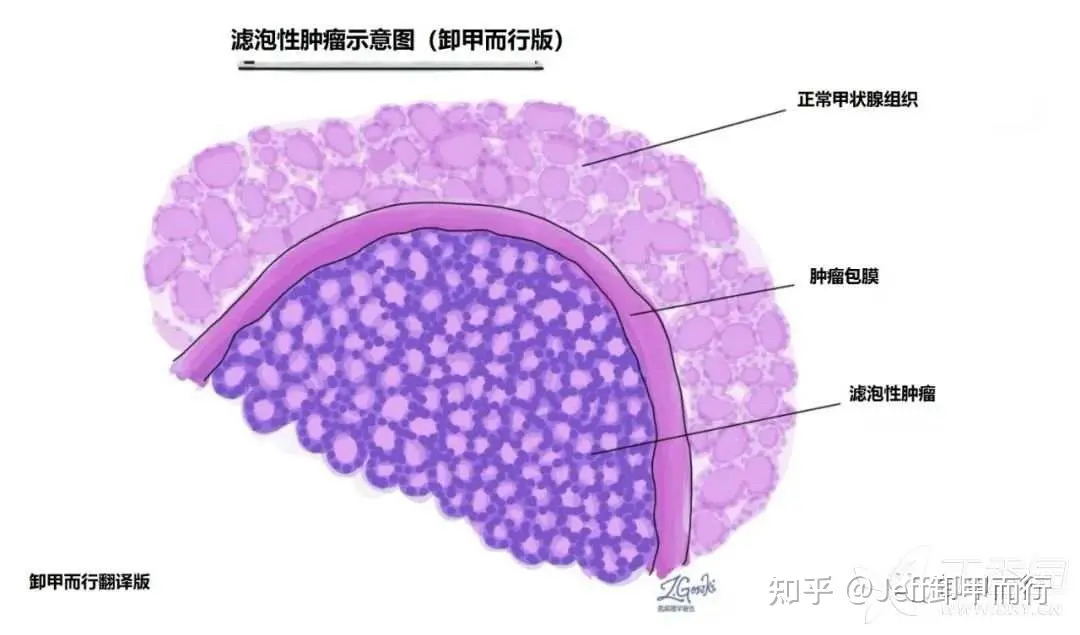
来源:http://mypathologyreport.ca
03、滤泡性甲状腺癌的病理诊断
根据2022年第5版甲状腺肿瘤分类标准
滤泡性甲状腺癌的病理诊断
是一套类似低分化都灵协议的决策树算法
需要经过7个环节的决策过程
在上一期文章Jeff已经进行了完整介绍
根据肿瘤包膜浸润和血管浸润灶程度
滤泡性甲状腺癌(滤泡癌)
分为微小浸润型、包裹性浸润性和广泛浸润型
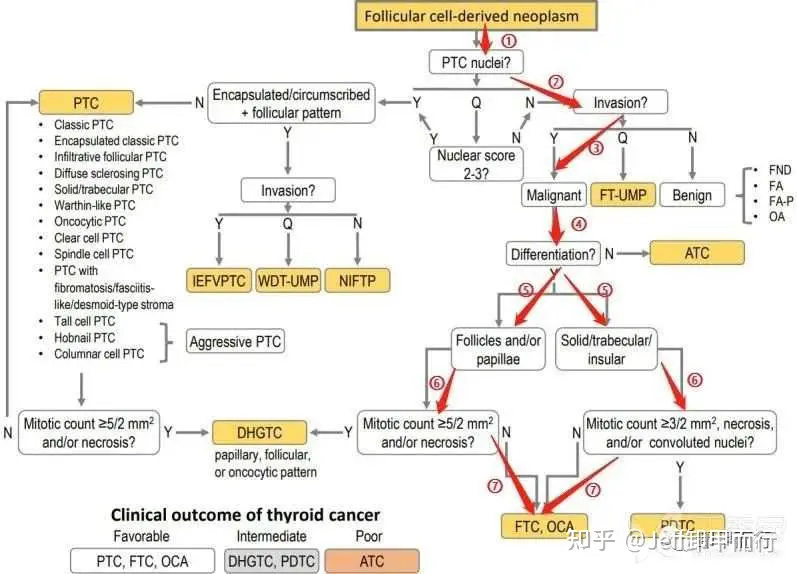
2022年WHO(世界卫生组织)滤泡性甲状腺癌诊断决策树
DOI:10.3803/EnM.2022.1553
二、滤泡癌的术前诊断
尽管滤泡癌术前诊断困难
超声、细针穿刺、粗针穿刺、冰冻病理毫无帮助
这种情况下
Jeff分析预判体系的逻辑算法正好派上用场
原理非常简单
我们根据术后病理复盘后的风险因素
术前患者指标中指向滤泡癌的风险因素越多
诊断为滤泡癌的概率越大
这是未来我们分析任何事物的标准方法
01、通过基本特征预测滤泡癌
滤泡癌患者的发病年龄
通常在40-60岁
女性与男性比例是2:1-3:1
且碘缺乏地区滤泡癌发病率较高
滤泡癌通常表现为>2cm的单发结节
微小浸润性滤泡癌患者年龄通常为35-49岁
广泛浸润型滤泡癌患者年龄平均为60岁
02、通过术前tg预测滤泡癌
血清tg是甲状腺癌的标志物
多项研究表明
不同甲状腺肿瘤患者的血清tg之间存在差异
血清tg可以用来有效预测滤泡癌
以及滤泡癌的类别和进展情况
综合全球各项研究数据
Jeff综合得出术前血清tg和滤泡癌的关系
血清Tg >75ng/ml,预测滤泡性肿瘤
血清Tg >187.5ng/mL,预测滤泡癌
血清Tg>5000ng/mL,提示滤泡癌转移
血清Tg>10000ng/mL,提示滤泡癌出现远转或低分化
基于研究者提供的一些数据
我们甚至可以进行不同结节大小
不同类别甲状腺癌之间的tg值比较和预测
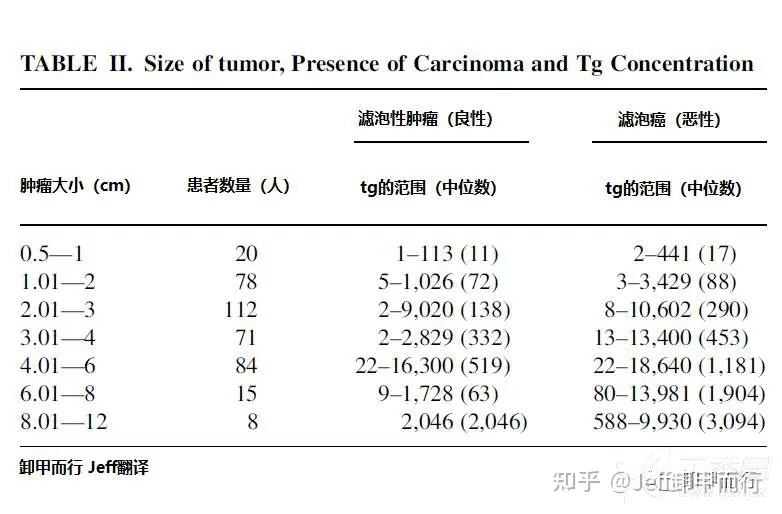
DOI: 10.1002/jso.22030
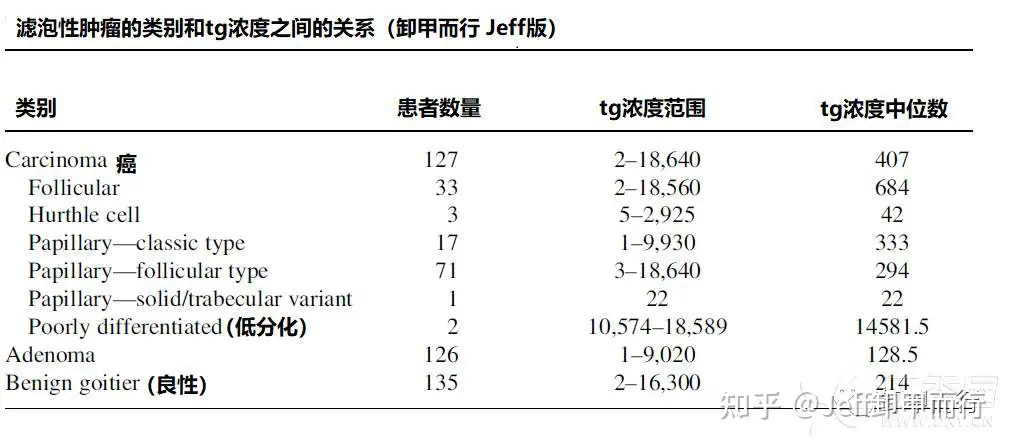
DOI: 10.1002/jso.22030
03、通过超声特征预测滤泡癌
综合性研究结果表明
甲状腺滤泡癌超声声像图特征如下
(1)实性为主
(2)低回声为主
(3)内部回声不均匀
(4)常合并钙化,包括微钙化、粗大钙化
(5)多为椭圆形
(6)边缘不规则
(7)声晕消失或不完整、厚薄不均匀,不规则
(8)血流丰富、紊乱
(9)罕见囊性变
(10)硬度较大
主要声像原理
是因为良性肿瘤内部整齐均一
而恶性肿瘤生长快速紊乱、几何层级增长
破坏了正常的滤泡细胞结构
并且肿瘤细胞向周围侵袭反应性增生或者纤维化
恶性肿瘤很少自我溶解因此囊性变罕见
超声对滤泡癌的鉴别并不理想
提示我们可能需要研究其他更有效的鉴别方法
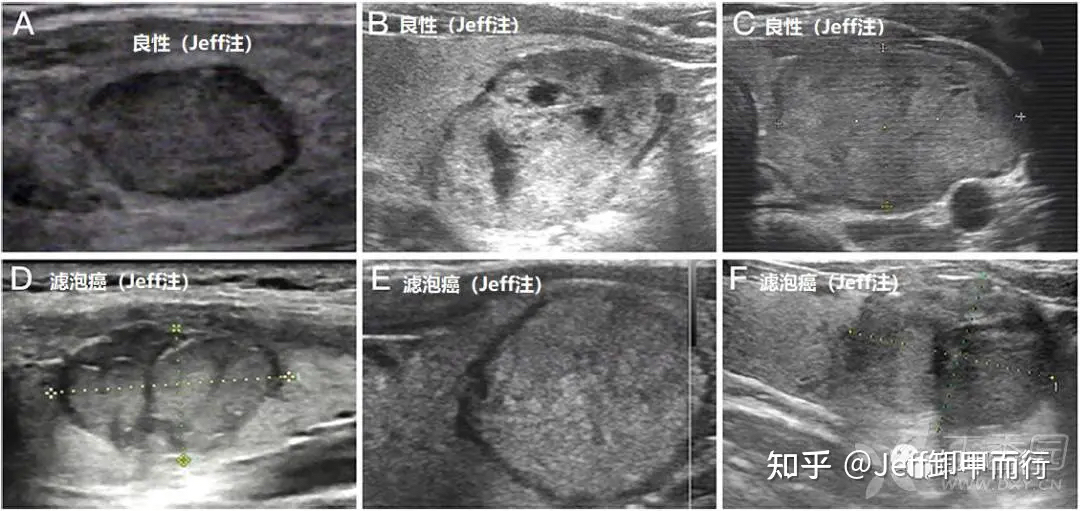
滤泡癌和腺瘤的对比
DOI: 10.3389/fonc.2022.1013410
04、核素扫描预测滤泡癌
滤泡癌在放射性核素检测下
多表现为“冷结节”
而良性滤泡腺瘤则表现为温、热结节
这也是一个术前评估的有效方法
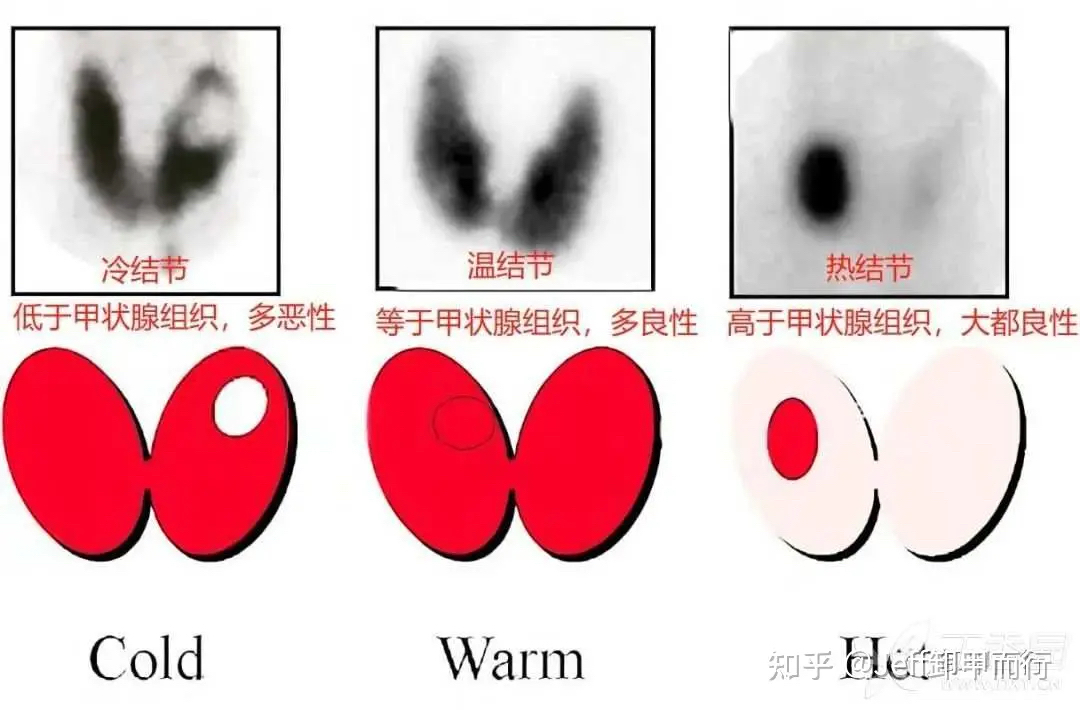
具体参见:
7-36:ECT、PET-CT显像下甲状腺“热、温、凉、冷”结节与甲状腺癌关系
05、超声造影预测滤泡癌
2013年-2014年
包头医学院第一附属医院闫国珍等医生
对58例滤泡癌患者进行了超声造影
并将结果和良性患者对比
发现滤泡癌患者造影病灶检测值大于造影前
并且病灶周边无增强,可见穿支血管并呈快进慢出
病灶内造影剂分布不均匀、呈离心性增强
并且还出现局部造影剂滞留的现象
DOI:10.16833/j.cnki.jbmc.2016.03.009
由于甲状腺癌的细胞、血管大量破坏
尽管滤泡癌结节血流丰富
但造影呈现出低增强
滤泡癌中心部血流相对密集
边缘部血流稀疏
这种差异导致其造影时呈离心性增强
06、分子检测预测滤泡癌
基因检测可以用于滤泡癌的鉴别
滤泡癌基因突变主要表现为
(1)RAS突变(40-50%)
(2)PAX8/PPARg重排(12-35%)
(3)PIK3CA突变少见(<10%)
(4)PTEN突变(<10%)
滤泡癌也表现为非高倍体增加
尽管基因检测诊断的整体效率不高
但不失为一种有效的辅助性鉴别方法
通过基因检测
还可以和其他类型的甲状腺癌进行区分
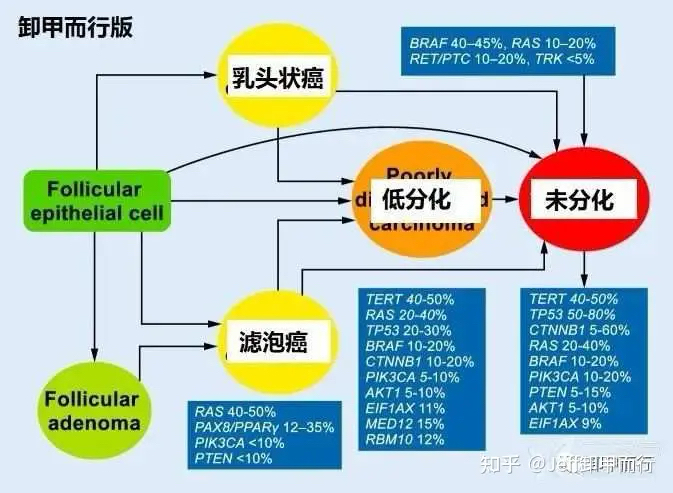
DOI:10.1007/s00292-019-0600-9
基于同样的原理
我们也可以结合免疫组化进行鉴别
滤泡癌表现出典型的滤泡细胞来源
也就是tg、TTF-1、CK阳性
并且排除神经内分泌来源(降钙素3项阴性)
因为同为滤泡细胞来源
滤泡癌免疫组化可能难以和乳头状癌区分
但是恰好提供了和腺瘤区分的正确方法
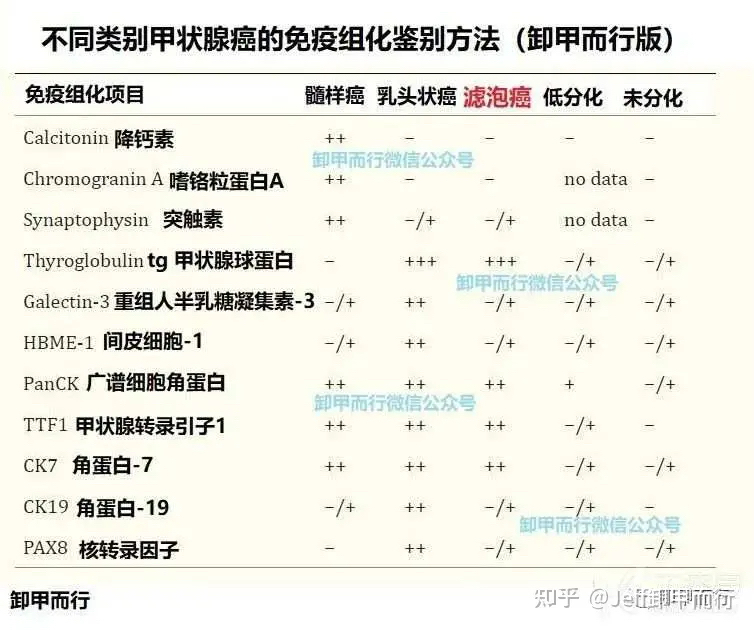
DOI:10.1007/s00292-019-0600-9
2022年
西湖大学等研究团队
尝试通过DIA蛋白质组学结合甲状腺组织谱库
辨别甲状腺滤泡腺瘤和滤泡癌
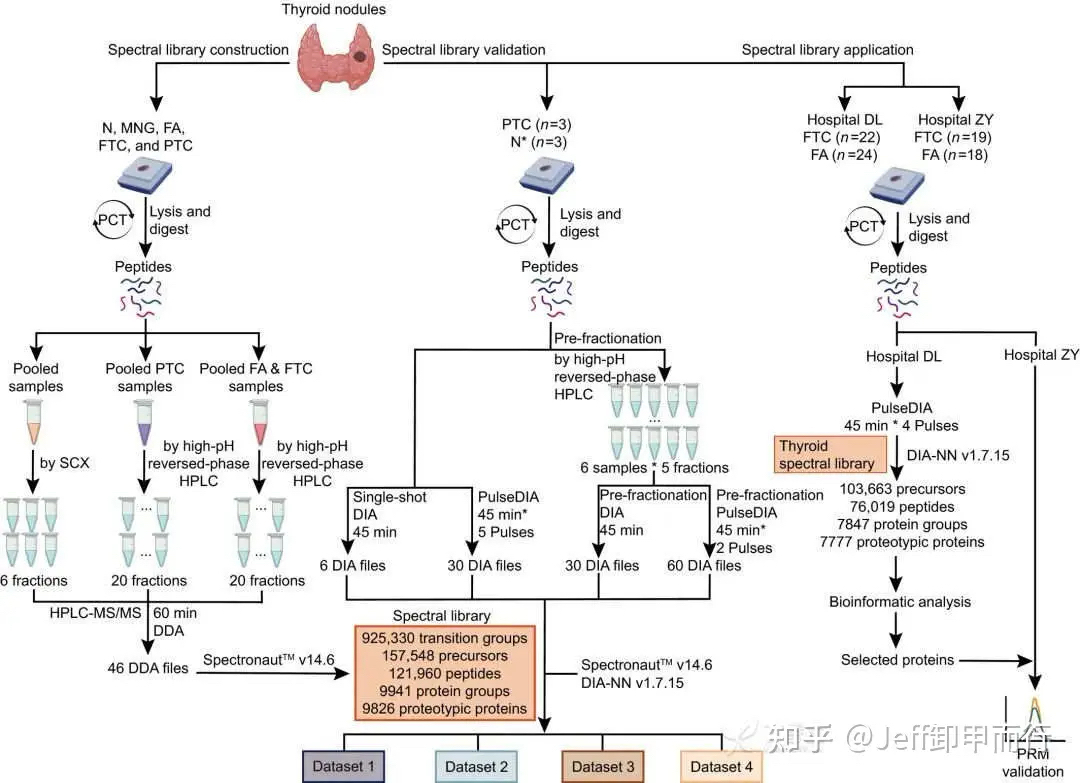
DOI:10.1002/1878-0261.13198
研究者通过 PRM (一种靶向蛋白质组学策略)
检测到的 37 种蛋白质
并且初步筛选除了 9 种蛋白质
这9种蛋白质有望成为区分滤泡癌和腺瘤的生物标志物
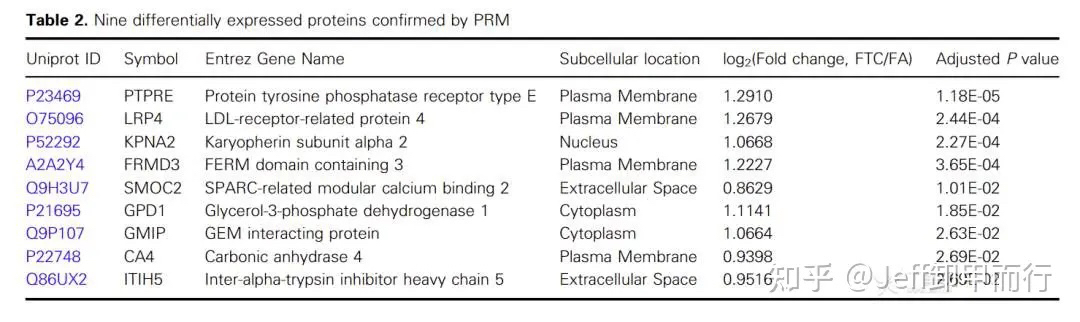
DOI:10.1002/1878-0261.13198
后 记
Jeff看来
在这个世界上解不开的并不是难题
而是算法
我们更多的时候是在评估投入、资源和成本
和收益是否匹配
滤泡癌术前鉴别困难
术后大病理确诊严重影响手术范围
如果我们辅助必要的基因检测和免疫组化
几乎所有的问题都能迎刃而解
接下来的时代毫无疑问是分子检测的时代
基因检测在未来将得到极大的推广
对于甲状腺癌的术前判断和预后评估
发挥积极且重要的作用
我们也看到了一些前沿性的研究
试图从其他的方向进行破题
但不得不说
大部分患者还是要评估投入和效益之间的关系
毕竟几千上万的投入很多家庭难以承担
Jeff还是期待能早日找到新的突破口
寻求到更为简单、经济和准确率更高的破题方法
更方便快捷区分出腺瘤和滤泡癌
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论