
【慢性前列腺炎-14】慢性前列腺炎迁延不愈,细菌生物膜或是元凶?
拥有健康的前列腺,是男性健康的重要标志之一。而提到慢性前列腺炎,很多男性都会下意识地“虎躯一震”,在不少男性眼中,这种病的可怕程度甚至不亚于恶性肿瘤。前列腺堪称人体的生命腺,足以证明前列腺的重要性,慢性前列腺炎在男性中比较常见,久治不愈是不少患者在治疗中经常会遇到的问题,于是,很多关于慢性前列腺炎的担忧和困惑在广大男性人群中流传。
当我们想到细菌时,大多数人会将其想象成单细胞生物体,它们聚集在一起后导致某些疾病或使食物酸败,一旦完成“任务”,细菌就会回到孤立的存在。事实证明,这种细菌形象不仅过于简单,而且可能会产生误导。细菌生物膜作为微生物群落,若在人体组织或无生命物体上形成则可能会导致严重感染等问题。
有学者对 20例既往有明确细菌学证据、应用抗菌约物效果不佳的慢性细菌性前列腺炎患者进行了前列腺穿刺活检或经尿道前列腺电切活检,在 60% 患者的前列腺组织中发现了和既往发作同样的细菌,这些细菌以生物膜形式牢固地附着在前列腺导管和腺泡壁上上。近年来,越来越多的证据显示,细菌生物膜在前列腺慢性感染和炎症迁延不愈中起的重发作用。临床研究发现,慢性细菌性前列腺炎分离出的常见致病菌中,有94% 的大肠埃氏菌是产生物膜菌株(其中有63%是强产生物膜菌株),分别有75%和15% 的革兰氏阴性菌株具有强的和中等的产生物膜能力,革兰氏阳性菌中常见的葡萄球菌分别有 46%和36% 具有强和中等产生物膜能力。产生物膜菌株感染的患者较非产生物膜细菌感染的前列腺炎患者具有更高的美国国立卫生硏究院慢性前列腙炎症状评分(National Institute of Health Chronie Prostatitis Symptom Index, NIH-CPSD。在接受标准的抗菌药物治疗后的随访中,虽然接近 60% 的患者细菌学转阴,但 NTH-CPS1 改善的患者不足 10%。
前列腺炎患者的细菌生物膜形成黏附于导管系统的上皮细胞或存在于前列腺的钙化灶内,抗菌药物治疗容易清除游离细菌,但对生物膜内的细菌清除能力有限,细菌持续存在唤醒持续的免疫反应刺激和炎症浸润,导致症状迁延不愈或临床细菌检出困难,使抗菌药物的应用失去指导。目前对于这种发况,临床检测能力有限。而在治疗中,在初始标准疗程抗菌药物治疗失败后,有硏究显示使用阿奇霉素和左氧氟沙星或环丙沙星联合用药进行又一个周期的治疗中可以取得很好的效果,其中阿奇霉素不仅可以杀灭细菌,同时具有很好的对抗细菌生物膜的作用。
一.细菌生物膜是什么?
生物膜(biofilm)是微生物存在的自然状态,J. William Costerton在19世纪70年代首先提出了生物膜概念及理论,作为描述表面上各种各样微生物聚集体的一个简单表达;是依附于某载体表面的由胞外多聚物(EPS)和基质网(matrix)包被的高度组织化、系统化的微生物被膜性聚合物。
细菌生物膜是聚集的微生物和它们的细胞外产物在固体表面形成的集落样结构,是细菌为适应恶劣环境而采取的一种生长方式。人体植入物表面生物膜的形成是一种自然现象,是细菌为了适应环境维持生存而发生的形态以及生理功能的改变,以微菌落为基本单位,包裹于多聚糖、蛋白等物质构成的基质中,形如膜状不可逆地附着于物体表面。细菌生物膜形成对于暂时或永久性人体植入物感染(如阴茎假体及人工括约肌)问题有重要的影响。
二.细菌生物膜形成
它的形成可以用下图所示的事件顺序进行简要描述:可逆附着到表面、不可逆附着、定植、成熟和扩散。区别于浮游细菌状态,由于缺乏氧气和其他营养物质,生物被膜内细菌的生长速度明显低于浮游细菌。
生物被膜形成示意图。(i) 浮游细菌在表面可逆附着;(ii)表面不可逆附着;(iii)外部基质网形成;(iv)形成三维结构;(v)脱落扩散。
1.调节膜形成 这一步的形成来自机体对外来异物的宿主反应。以尿路为例:异物进人尿路与尿液接触,尿液中的 Tamm-Horsfall 糖蛋白、各种离子、多糖及其他成分数分钟内聚集到异物表面,体液中的大分子成分如血清白蛋白、纤维蛋白原、 胶原与纤维连接蛋白在细菌微生物到达之前快速在异物表面形成调节膜。调节膜的形成改变了异物的表面特性,使得病原微生物容易在异物表面聚集。
2.病原微生物的聚集和黏附 这是生物膜形成的第二步。病原微生物黏附于异物表面的能力受到静电力和疏水性的相互作用、离子强度、渗透压和尿pH等的影响。其确切的生物学机制仍在研究中。
浮游细菌感受到环境的生存压力,通过释放细胞释放质子和信号分子感知异物平面的存在向异物表面聚集,通过疏水性和静电力的作用黏附于异物表面开始生长繁殖。
3. 表层生物膜结构的形成 此时微生物已经创造了一个躲避抗菌药物和宿主免疫反应的微环境。
依菌种不同,微菌落可能由 10%~25%细菌和75%~90% 胞外多糖 (exopolysaccharide,EPS)基质组成。
这些微菌落构成了生物膜的基本单元,并进一步发展形成具有异质性粗糙表面的结构。生物膜通过“水通道”运输必要的营养和氧气,同时内部也通过基因表达分泌化学信号调控细菌密度。生物膜调节细菌群体感应 (quorum sensing, QS) 即细菌细胞之间通过感受自诱导物来调控细菌群体行为的现象,是细菌调控生物膜形成的重要机制之一。通过信号分子调控基因表达,这种交流可使细菌表达不同的生理行为,包括病原微生物的毒性、对抗菌药物耐药的形成、生物膜的形成与生长等。生物膜的形成与微生物代谢、毒力因子表达等密切相关。群体感应现象与生物膜的形成相互依赖,生物膜提供菌体聚集场所,避免群体感应信号分子的扩散,聚集菌体的群体感应现象为生物膜的形成提供基础。群体感应糸统不仅可直接介导细菌生物膜的形成,还可调节胞内第二信使分子水平。
细菌在biofilm内生长环境变得极度拥挤,且代谢速率降低,细菌此时会表现出对抗生素明显的耐药性,并逐渐形成蘑菇样或塔状结构的成熟生物膜(mature biofilm)。
4.脱落扩散 细菌对biofilm内环境生长不适应,细菌可分泌胞外水解酶水解EPS,细菌脱离biofilm,成为游离状态细菌(plankton cell)。
这些从biofilm内释放出的游离菌可继续黏附、生长、定植、分化,附着于其他载体表面,形成新的biofilm。细菌就是以形成游离细菌—细菌生物膜—游离细菌—细菌生物膜这样的生存方式循环往复,不断地释放浮游细菌并引发持续性感染。
细菌形成生物膜过程图
三.生物膜细菌的抗菌药物耐药机制
biofilm耐药机制复杂,是多种因素综合作用的结果,主要包括以下几方面:
1.渗透限制学说认为,biofilm内细菌分泌的胞外多聚物EPS结构相对致密形成生理性屏障,使许多水溶性的抗菌药物难以渗入发挥作用,导致biofilm内的细菌对抗菌药物的敏感性降低。此外,由于biofilm中呈负电荷的EPS可与大量抗菌药物结合,使到达细菌部位的药物浓度显著降低;同时EPS中含有许多抗菌药物水解酶,如β-内酰胺酶,可使进入biofilm内的抗菌药物失活。由于以上原因,生物膜内细菌通常可以在抗菌药物浓度比杀死生物膜外同种游离细菌时高1000~1 500 倍的环境中存活。
2.营养限制学说认为,营养物质和氧气等难以到达biofilm深部的细菌,由于受到营养供给的限制,处于缓慢生长或饥饿状态,生长代谢速率明显下降。这种状态的细菌对抗菌药物不敏感,或者使部分以细菌增殖过程为靶点的抗菌药物的疗效急剧下降,这是由于生物膜内细菌启动基因转变改变了细菌外膜、分子靶点(研究显示会出现 65~80个蛋白的改变),而表型的改变对细菌耐药起重要作用。
3.适应性耐药机制:指细菌生物被膜在存在抗菌药物的情况下对耐药机制的暂时诱导,可以是特异性或非特异性的。特异性耐药机制包括β-内酰胺抗菌药物存在时诱导β-内酰胺酶,或者在黏菌素存在时G-细菌外膜上的脂多糖变化。非特异性耐药机制包括外排泵的上调、野生敏感型细菌转化为耐药突变群或对药物诱导的氧化应激的保护等。乍一看,这些不同的机制涉及到生物被膜对抗菌药物的耐药性似乎是独立的,然而在铜绿假单胞菌生物被膜中有证据表明,调节因子(如转录调节因子brlR) 共同参与了对氧化应激的耐药性和外排泵表达的调节。
4.表型推断学说认为,biofilm内的细菌和游离状态的细菌在基因表达、生理结构上有显著差异,研究证实biofilm内部的细菌会表达一些专一性的保护因子,例如多药外排泵(multidrug efflux pumps)和压力响应性调节因子。此外,细菌生物膜还是质粒的重要储备库,可促进细菌耐药基因的获得和传播。
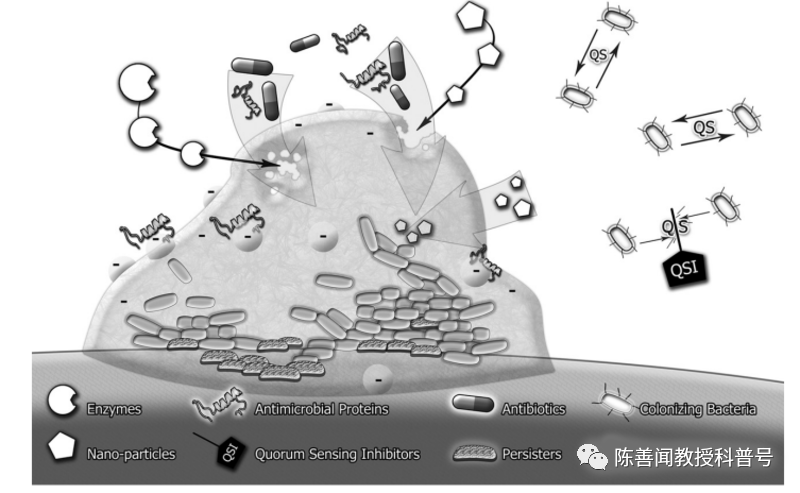
四.如何治疗生物膜感染
目的是抑制生物膜中的细菌生长,以减少炎症反应。我们重点阐述抗菌药物的合理应用。
大多数抗菌药物的药代动力学(PK)和药效动力学(PD)研究都是在浮游细菌上进行的,不宜将其结果外推至生物膜细菌。最小生物被膜抑制浓度(MBIC)和最小生物被膜清除浓度(MBEC)是在生物膜感染治疗中应该参考的界值,可想而知的是杀灭生物被膜细菌所需的抗菌药物浓度比浮游细菌高得多,事实上抗菌药物的MBEC在体内也往往难以达到。因此,仅通过全身使用常规剂量的抗菌药物似乎是不可行的,而通过高剂量,局部治疗以及联合治疗可在生物膜感染部位提供较高药物浓度,是提高抗生物被膜感染疗效的可能手段。
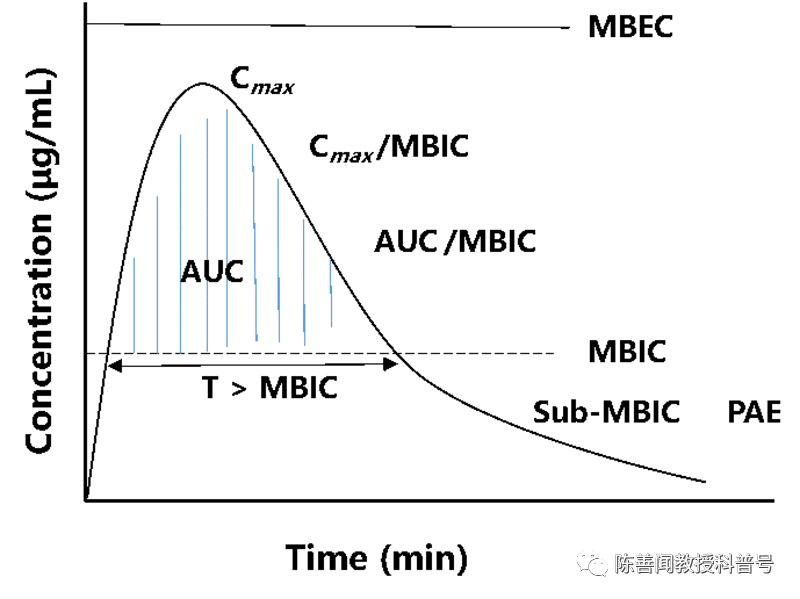
PK–PD与生物膜的抗菌效果相关。参数包括最小生物被膜抑制浓度(MBIC)、最小生物被膜清除浓度(MBEC)、亚最小生物被膜抑制浓度(Sub-MBIC)、抗生素后效应(PAE)、峰浓度(Cmax)和抗生素时间-浓度曲线下的总面积(AUC)。PK–PD指数为Cmax/MBIC、AUC/MBIC,以及抗生素浓度保持在MBIC以上的时间(T>MBIC)。当MBEC超过Cmax时,生物被膜很难在体内清除。
具体而言,生物被膜的治疗需要有效且渗透性良好的抗生素,以确保在生物被膜感染部位有足够浓度的有效抗生素。一般来说,大环内酯类、林可酰胺类、四环素类、利福霉素、喹诺酮类、夫西地酸、硝基咪唑、磺胺类和恶唑烷酮类比β-内酰胺类、氨基糖苷类、糖肽类和多黏菌素更好地渗透到组织和细胞中,抗菌药物组合例如美罗培南、黏菌素和阿奇霉素等抗菌剂是组合策略的良好候选者,能在生物被膜较深层氧张力降低和代谢活性低的条件下保持其活性。另外,一些广泛使用的抗生素如阿奇霉素、头孢他啶和环丙沙星,除了具有常规抗生素活性外,还具有群体感应抑制 (QSI) 活性。
本文是李建辉版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论