放射外科(Radiosurgery,RS)生物学基础
放射外科(Radiosurgery,RS)生物学基础

1例(女/58岁)晚期胸腺低分化鳞癌综合治疗后进展-以局部治疗为先导的综合治疗胸部三程放疗-5D放疗

放射外科生物学基础
与常规分割放射治疗不同,放射外科治疗有其独特的剂量分割模式和放射生物效应。研究表明,分次大剂量照射除造成DNA双链断裂直接杀伤细胞效应外,还可产生血管内皮细胞损伤等次生放射生物效应。
一、放射外科肿瘤杀伤效应
随着射线聚焦技术和精准施照技术的进展放射外科治疗采用的分次高剂量照射可直接增强对肿瘤细胞的杀伤作用,同时减少周围正常组织受照体积而降低正常细胞损伤。因此,放射外科治疗与经典放射生物学理论的“5R“原则有所不同,现将放射外科中的肿瘤杀伤生物效应阐述如下.
(一)存活细胞再氧合(reoxygenation)
19世纪30年代,越来越多的学者开始逐渐认识并关注不同氧含量对细胞放射敏感性的影响。由于肿瘤生长速度与血管生成速度不匹配,引起肿瘤组织内部出现单个或多个乏氧区域,从而产生了氧含量的差异。根据氧含量差异出现的快慢程度,分为急性乏氧(acutehypoxia)和慢性乏chronic hypoxia)两类。急性乏氧是由于肿瘤内血管平滑肌细胞缺失或内皮细胞和基膜不完整,导致血管暂时性闲合而引起,此种现象在血管再次打开时氧供应即可恢复正常,因此是可逆的;而重瘤组织内部,由于距离毛细血管的远近差异,产生不同的氧浓度梯度,导致远离毛细血管的慢性氧区域产生。慢性乏氧细胞很少能被再合,而持续一段时间的乏氧状态,最终会导致不可逆的细胞坏死或凋亡。
相比于正常组织中40~60mmHg的氧含量,90%左右的实体肿瘤存在不同程度乏氧,多数肿瘤中位氧分压低于10mmHg,尤其是快速增殖肿瘤,较大瘤体内肿瘤细胞乏氧现象更为显著,肿瘤放疗后的局部控制率更低。
常规放疗时,肿瘤退缩带来的慢性乏氧区域再氧合需要数小时甚至数天,因此缩短总的治疗时间会降低肿瘤的再氧合水平。而放射外科治疗时肿瘤退缩更快,短期内肿瘤细胞死亡更多,氧耗量减少,残存的肿瘤细胞可发生一定程度再气合,但总治疗时间的缩短十分不利于乏氧肿瘤细胞再氧合。特别是对于单次的放射外科治疗,实施过程中几乎不存在肿瘤细胞的再氧合。30年前Fowler 等报道,在相同程度皮肤损伤时,通过比较不同分割模式治疗乳腺癌移植瘤小鼠的肿瘤控制率,发现:①单次大剂量辐射暴露后的肿瘤局部控制率明显低于其他分次分割模式;②使用乏氧细胞增敏剂米索硝唑可显著提高肿瘤控制率,且在单次大分割照射中此现象更为明显。一项RTOGⅡ期临床研究也证明,对于不宜手术的Ⅰ期外周型非小细胞肺癌患者而言,采用48Gy/4f照射组的2年生存率及无病生存期均高于单次34Gy照射组。
Brenner等研究发现,在达到相同生物有效剂量(biologically effective dose、BED)的前提下,单次大剂量放疗模式的肿瘤控制率远低于分次大剂量。以上研究证明,采用分次大分割模式治疗肿瘤的局部控制和生存更好。Shibamoto等比较了革次13Gy或15Gy照射3种不同类型体积均为lcm的小鼠肿瘤后,乏氧细胞比例在不同时间的变化情况。研究结果表明,照射24小时内,3种瘤体内乏氧比例均明显下降,且在24小时后乏氧比例依然下降但幅度明显降低。上述说明,一段足够长的时间范围内,分次间隔时间越长,细胞乏氧比例越低,肿瘤细胞再氧合越充分,此时肿瘤辐射敏感性将越强。
严格意义上讲,肿瘤体积大小直接影响瘤体内乏氧细胞比例,放射外科治疗小病灶肿瘤时,依赖超大物理剂量消融肿瘤细胞。此时乏氧细胞比例小,对再氧合依赖性低,分次治疗过程中再氧合产生的影响不大;但当肿瘤体积>3cm时,应充分考虑分次剂量大小和再氧合发挥的作用来安排剂量分割模式。因此,在探索放射外科治疗分割模式时,需要充分考虑肿瘤类型、细乏氧情况、单次剂量和分次间隔时间等因素所带来的影响。
(二)亚致死性损伤修复(repair)
放射亚致死性损伤是指正常条件下,有害因素消除后可修复的损伤。而逐渐累积照射剂量额外增加的亚致死性损伤将导致细胞死亡。亚到死性损伤的修复反映的是致死性损伤前DNA双链断裂的修复情况。单次照射时,射线产生断裂的DNA可相互作用,形成双着丝粒。若相同剂量分两次照射,在第1次照射产生的DNA双链断裂可能得到修复,而双着丝粒形成减少,细胞存活增加。相比单次照射,分次照射间期亚致死性损伤修复导致每次照射产生的细胞存活曲线存在肩区且细胞存活分数随间隔时间增长面增加,进一步延长分次间期,细胞进入细胞周期导致辐射敏感性增加,存活分数反而又下降。当分次间隔时间足够长,细胞会再次出现分裂增殖,存活分数又会增加。相比于直径较大且含有较多缺氧细胞的6日龄肿瘤,直径较小的1日龄肿瘤中存在更多的细胞修复,这就说明细胞修复是需要氧气和营养的过程。
快速增殖的肿瘤细胞亚致死性损伤修复所需时间较短。一般认为,快速增殖的肿瘤细胞亚致死性损伤的半数修复时间为30分钟。在间隔24小时照射模式,下一次照射前快速增殖的肿瘤细胞亚致死性损伤基本能得到完全修复,很少出现亚致死性损伤累积。常规分次放射治疗的每次剂量实施过程很少超过15分钟,因此,该过程发生亚致死性损伤的修复微不足道。现有临床给予的处方剂量将分次间的肿瘤修复这一因素考虑在内就放射外科治疗而言,每次放射治疗需要相对较多时间,有时甚至超过1小时。若每次施照剂量过程都超过30分钟,则在此期间发生的亚致死性损伤修复会减弱射线对肿瘤的生物效应,此时更需要对剂量予以补偿。若将较长分次时间放射治疗实施过程中肿瘤损伤修复效应纳入分析范围,生物有效剂量(BED)可用以下方程估算:
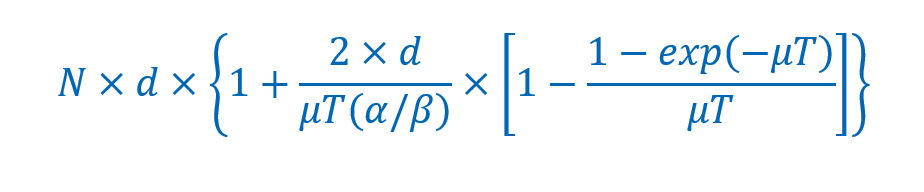
其中,N为总治疗次数,d为分次照射剂量,T为分次照射时间,μ为与亚致死性损伤半数修复时间(T1/2)相关时间常量(μ=0.693/T1/2)
目前仍缺乏大宗放射外科治疗相关亚致死性损伤修复的数据,,有学者建议在临床放射外科治疗实施过程中对分次时间长于30分钟的情况进行详细记录,用于放射生物学研究。此外,高剂量电离辐射杀伤肿瘤血管内皮细胞损伤而导致肿瘤微环境改变引起肿瘤细胞亚致死性损伤修复过程的影响也尚待探讨。同时,放射外科治疗大分割照射以致死性损伤为主,亚致死性损伤比例极小,也值得临床观察。
(三)照射后细胞加速再增殖(repopulation)
照射后肿瘤细胞加速再增殖主要指分割照射时,存活的克隆源性肿瘤细胞发生的增殖。射线照射会启动肿瘤内的克隆源性细胞,使这些细胞较前次分裂速度加快,代偿性加速增殖。Withers首先发现在放射治疗开始后(4±1)周,头颈部鳞癌细胞出现加速再增殖现象,此时需要每天增加0.6Gy额外剂量以抵消加速再增殖引起的治疗效益损失。
在不同分割模式的常规放疗生物模型中,肿瘤增殖修正值仅为粗略估算。特别是对于前列腺癌等增殖较慢的肿瘤,,这一修正因子可忽略不计。而目前尚无放射外科治疗实施过程中肿瘤细胞加速再增殖的数据。由于放射外科治疗的总时间比常规分割放疗短,加速再增殖在放射外科治疗中的作用相对较弱,甚至可能在采用大分割或单次剂量的放射外科治疗时不存在该现象。Kestin等回顾性分析了505例采用不同放射外科分割模式治疗肺癌患者的数据发现,治疗时间不超过10天的患者2年局部复发率仅为4%,而治疗时间超过10天的患者2年局部复发率为14%。在治疗分次剂量和总剂量一致的前提下,缩短治疗时间可获得更高的肿瘤局部控制。因此,在评价放射外科治疗这种时间相对短的方案时,加入时间因子的必要性值得考量。
(四)细胞周期再分布(redistribution)与细胞内在放疗敏感性(radiosensitive)
细胞的放射敏感性与其在辐射暴露时所处的细胞周期时相有关。细胞周期中对辐射最敏感的时相为M期和G期;S末期辐射抗性最大,这是由于两个姐妹染色单体间同源重组修复所致;G期和S初期放射敏感性介于两者之间。而细胞期较长的细胞还存在G期初期的另一抗性波峰次辐射暴露后,处在细胞周期内辐射敏感期的细胞被杀死,处在抗性时相的细胞死亡较少,细胞群体趋于细胞周期同步化,下一次辐射暴露前,细胞会再次进入细胞周期辐射敏感时相而对下次辐射敏感,即细胞周期再分布。
Eley等使用胶质瘤细胞系建立不同类型放射外科剂量效应模型,比较给子单次大剂量12Gy和1小时内多次暴露总剂量达12Gy时的细胞放射敏感性。结果显示,两种照射均有部分细胞停滞在G2/M期,该效应与相对辐射抗性有关。从常规放射生物理论看,放射外科治疗时间缩短对细胞居期再分布使肿瘤细胞进入更加敏感时相不利。但采用大分割剂量或单次大剂量照射对不同周期时相的细胞杀伤效应极强,两种效应叠加效果有待于临床治疗证明。


参考书籍:
[1]夏廷毅,张玉蛟,王绿化.肿瘤放射外科治疗学[M].人民卫生出版社,2022.
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论