周围型肺癌——放射外科(Radiosurgery,RS)治疗
周围型肺癌——放射外科(Radiosurgery,RS)治疗



放射外科(Radiosurgery,RS)生物学基础概念内涵
中心型肺癌——放射外科(Radiosurgery,RS)治疗

放射外科已经成为无法或拒绝手术的早期非小细胞肺癌(non-small-cell carcinoma, NSCLC)安全的根治性手段。治疗周围型早期非小细胞肺癌已有20多年临床应用经验,肿瘤局控率高、不良反应小,患者生存时间明显优于常规放疗,有临床前瞻性对照研究和回顾性荟萃分析结果表明,可手术患者的3年生存率放射外科优于外科手术,目前治疗死亡风险为0。
周围型肺癌的定义是,在各方向上距离支管树、气管隆嵴、左右主支气管、叶支气管和段支气管开口2cm以外的肺,广义的周围型肺癌还要包括肿瘤周围的食管、脊髓、神经及心脏等相关组织结构在2cm 以外。
简而言之,放射外科已成为早期非小细胞肺癌的重要根治性手段,在有外科手术条件的患者中可作为备选项,在不能外科手术或拒绝外科手术的患者中是首选项。而且,随着中国老龄化社会发展,肺癌早期发现以及不能承受外科手术惠者的增多,放射外科治疗的作用和地位变得更为重要。
一、 非小细胞肺癌诊断要点
肺癌是我国发病率和死亡率均居首位的癌症与我国吸烟人群较多有关。肺癌主要分为非小细胞肺癌和小细胞肺癌,非小细胞肺癌占肺癌的80%~85%。非小细胞肺癌在不同发病阶段、不同分期和不同部位临床表现截然不同。当临床症状明显、患者自觉异常时,多数已到中晚期。因此对肺癌高危人群和40岁以上人群定期行胸部低剂量电子计算机断层扫描(computed tomography,CT)筛查是发现早期肺癌的最有效简便的方法。
肺癌是我国发病率和死亡率均居首位的癌症与我国吸烟人群较多有关。肺癌主要分为非小细胞肺癌和小细胞肺癌,非小细胞肺癌占肺癌的80%~85%。非小细胞肺癌在不同发病阶段、不同分期和不同部位临床表现截然不同。当临床症状明显、患者自觉异常时,多数已到中晚期。因此对肺癌高危人群和40岁以上人群定期行胸部低剂量电子计算机断层扫描(computed tomography CT)筛查是发现早期肺癌的最有效简便的方法。
早期周围型肺癌患者主观并无症状,客观检查可以发现肺内有结节或阴影,中心型肺癌根据所处的位置和生长速度可有不同程度咳嗽,特别是刺激性干咳、阻塞性肺炎、发热、咯血等症状,无论是体检发现肺内新近出现实性结节或主观有不断加重的症状表现,都要高度重视早期肺癌的出现而做详细检查,行胸部CT检查,当发现疑似病变时病灶穿刺活检或支气管镜检取材组织细胞学诊断是最可靠的直接证据,各部位超声、CT、共振成像(magnetic resonance imagery, MR)、骨扫描或正电子发射计算机断层显像(PET/CT)检查是明确诊断分期的重要环节。
非小细胞肺癌病理诊断主要有鳞状细胞癌腺癌以及细支气管肺泡癌等类型。从目前的临床资料看,早期非小细胞肺癌不同病理类型的放射外科治疗结果并没有明显差异。因此,在采用放射外科治疗方式和剂量上没有不同,只有在肿瘤体积大小和不同部位上考虑剂量模式的差异。
对于接受放射外科治疗的组织学或细胞学诊断问题,美国为主的共识规定接受放射外科治疗的早期NSCLC必须要获得组织学或细胞学确认才能治疗。而欧洲、日本以及中国等在临床实践中,针对一些因肿瘤部位、身体条件甚至是患者强烈拒绝行穿刺活检取材,无法取得组织学确认的患者,通过临床病史、影像诊断及多学科会诊确认的早期肺癌,可以推荐接受放射外科治疗。
癌症没有病理诊断不能治疗的医学规定,随着医学发展和技术进展,以及对癌症生物学行为深入认知,临床诊断技术的显著进展,治疗方式的巨大改变,不用外科手术切除同样可以根治癌症的时代来临而发生改变。癌症的病理组织学诊断是“金标准”,但在很多早期肿瘤临床影像诊断与病理诊断的符合率已高达90%以上,而且有些病例要取得病理诊断又非常难或风险高,甚至是不可能的,非手术治疗的局控率和生存率又可以优于手术。修订50年前医学技术落后时代的规定根据医学技术发展结合患者的实际要求,推荐安全有效方案,是符合医学伦理及切实解决患者疾苦的合理之举。
因此,癌症科学诊治的规定应该修订为:癌症的组织病理学诊断是“金标准”,采用任何治疗手段前能取病理必须取,科研项目病例必须有病理诊断支持,但临床及影像诊断明确的早期病灶,确实无法获得病理诊断,又没有手术条件或拒绝手术切除时,在家属和患者知情同意下可选用放射外科治疗。
二、手段选择原则
(一)外科手术治疗
目前非小细胞肺癌发现时 20%~30%为早期(Ⅰ、Ⅱ期),外科手术仍是可以首先选择的方法。早期非小细胞肺癌外科手术切除后I期5年生存率为 55%~80%,Ⅱ期为35%~55%。
随着时代发展和技术进步,外科手术方式在发生着不断变化,从开胸直视下肺叶手术切除,逐渐发展到小切口手术、胸腔镜以及机器人导航手术等变化,使外科手术表面创伤减小,手术风险明显降低,对手术期管理及患者术后恢复等更加有利。但是,手术方式无论如何进展,手术过程需要麻醉,手术切除肿瘤发生出血、伤口感染以及手术创伤对患者有较高身体条件要求无法改变。因此有相当一部分患者因内科疾病或高龄因素无法承受手术而不能外科手术治疗,当然也有部分患者了解新技术进展的治疗结果或恐惧外科手术而拒绝手术。更值得高度关注的是,放射外科治疗可手术切除的早期 NSCLC 的效果远优于手术切除,而且治疗风险更低。因此,早期肿癌已经不是唯一依赖外科手术切除才能根治的时代。
(二)放射外科治疗
放射外科治疗不能手术的早期非小细胞肺癌经历了半个多世纪技术发展过程。最初采用放疗由于技术落后、定位不准、正常组织受照剂量大、剂量聚焦性不强,在所谓常规放疗时代,只能对肿瘤病灶实施每次2Gy,每周5次,总剂量66Gy/6~6.5周的治疗。这个剂量范围和这种剂分割模式是基于当时的放疗技术和条件,对早期患者治疗的局部失败率高达30%~66%,治疗早肺癌的5年生存率仅有20%左右,因此,有外科手术条件的病例在常规放疗时代选择手术治疗是无可厚非的。
进入 20 世纪 90年代,随着 CT定位技术、立体定向技术、医学计算机技术及放射治疗装备的射线聚焦技术的临床应用和成熟,放射外科逐渐从颅内发展到颅外,最先在肺癌及肺转移癌开展了系列临床试验,从体部框架、体表标记定位到图像引导实时靶区验证提高治疗精度。从慢CT描,膈肌加压到 4D-CT 扫描,从呼吸控制到金标植入实时呼吸追踪技术应用等多种方式来降低呼吸影响和缩小治疗范围,从而将放疗常规剂量模式60~66Gy/30~33f提升到45~70Gy/3~10f的大分割剂量模式,充分表明技术进展快速推进放射外科临床应用的进程。
采用放射外科治疗早期NSCLC照射范围明确的,不必要对区域淋巴结进行预防性照射,只需照射影像学所见原发灶。早期非小细胞肺癌只照射原发灶的区域淋巴结失败只有4%。
采用放射外科治疗早期周围型NSCLC的最高耐受剂量模式60Gy/3f,这一结果来源于Timmerman等最早开展放射外科治疗早期NSCL的剂量递增研究,明确了3次照射,每次 20Gy 为最大耐受量。但这一剂量模式并不适用于中央型早期非小细胞肺癌。放射外科治疗早期NSCLC的量效关系可以通过线性二次方程转换的生物等效剂量(biologically effective dose, BED), BED[nxdx(1+d/α/β), α/β=10]进行评估,大量临床结果证明BED>100Gy的肿瘤局控率和患者生存率明显高于BED≤100Gy。
值得一提的是,放射外科技术中的体部γ刀是具有中国元素和智慧的放射外科技术,体部伽马刀放射外科技术治疗早期NSCLC的临床结果与国外X刀技术相似。体部γ刀通过采用多个CO-60。放射源旋转聚焦方式使病灶受到持续性高剂量照射,周围正常组织受到扫描式低剂量照射,在获得肿瘤高局控率的同时,肿瘤周围正常组织放射损伤更轻。
(三)治疗手段选择
早期非小细胞肺癌是指T1-2N0M0病例,目前从治疗手段选择上主要分为外科手术治疗和放射外科治疗;从部位分为周围型、中心型和胸壁宽基型:从大小分为T1a、T1b、T1c、T2a、T2b和T2c从手术风险年龄可分为高龄(>80 岁)、中龄(70~79 岁)低龄(<70岁);从手术可承受度可分为健康人可承受、伴内科疾病有风险、伴重度慢阻肺等不能承受;从外科手术顺从度可分为顺从、犹豫、拒绝情况。
面对以上如此多元素交错的错综复杂状况医师如何更好为患者选择或推荐治疗手段,不仅是医学技术问题,还涉及医师传统思维、习惯做法、自身对专业的执着、对创新技术的接受以及对患者的人文关怀等;对患者而言,由于信息不对称、对各种方法了解不深入、理解不全面,特别对新技术认知短缺,存在随大流、按传统习惯、盲目顺从等问题。
早期非小细胞肺癌既然有外科手术和放射外科双项选择的机会,就需要遵循一系列选择原则,为患者争取治疗安全、功能保障、结果满意的最大获益感。
1.从肿瘤T分期而言
发现越早病灶越小,选用放射外科优于外科手术,放射外科的优势是不担心部位担心体积,因为体积大需要剂量高,周围正常组织范围大,放射损伤相对就会增加:而外科手术治疗的优势是不担心体积担心部位,体积大外科手术不困难,肿瘤太小则外科手术摸不着找不到反而变得困难。而且,外科手术的有创过程并不因肿瘤大小而改变。因此,单从治疗手段选择和治疗结果相关性和治疗过程的安全性而论推荐顺序T1优选放射外科:T2根据情况能外科手术可选外科手术,不能外科手术优选放射外科;T3原则上外科手术优先,不能外科手术推荐放疗为主的综合治疗。
2.从肿瘤部位而言
周围型或胸壁宽基型放射外科治疗难度不大,高剂量放疗安全、可根治。同样遵循T分期手段选择推荐顺序。中心型肺癌以往外科手术切除一直是主要手段,但切净率低,气管再造、血管重建手术创伤大且并发症多,肿瘤切不净复发率和死亡率均较高。因此,中心型肺癌手术切除并非是最好的选项,只是常规放疗时代技术落后的无奈之举。采用放射外科治疗中心型早期非小细胞肺癌的临床结果与周围型肺癌结果类似,不良反应可以接受,治疗风险明显降低。因此,中心型早期肺癌选择放射外科还是外科手术要根据治疗风险和肿瘤切净程度综合考虑。
3.从患者年龄和有无内科疾病而言
原则上是高龄和严重内科疾病不能承受外科手术者优先选择放射外科,其他情况同样遵循以上1、2原则。放射外科治疗的最大优势就是治疗过程无创伤,不需要麻醉,对身体产生的负担和额外影响非常小。因此,任何年龄都不是选用放射外科治疗的禁忌,即使有不能承受外科手术的糖尿病、心脏病和慢阻肺等,也不是采用放射外科治疗的禁忌证。
4.从患者依从度而言
我国多数患者及家属都有“得了癌症应该外科手术,只有手术才能根治的传统认知,接受外科手术治疗的依从度极高因此,早期非小细胞肺癌无外科手术禁忌、愿意手术切除者,不必反对手术治疗,但患者拒绝外科手术时应推荐采用放射外科治疗,在放射外科和外科手术都可选时,不能完全违背患者及家属的意愿,强制推荐医师自己专业的治疗手段。
早期非小细胞肺癌治疗手段在临床实践中还可以见到采用射频高温消融治疗、氩氦刀低温治疗以及放射性粒子植入治疗的病例报道。这些技术的临床应用开展时间短、病例少,治疗本身有穿刺创伤风险,临床不应作为常规方法应用。因此目前为止,外科手术和放射外科应作为主要治疗手段。
综上所述,早期非小细胞肺癌治疗结果的预后较好,治疗手段的选择或推荐非常关键,无论是放射外科还是外科手术,都需要从患者、医学、技术和医疗过程多角度全方位考虑,让患者获得治疗过程安全、低风险、治疗后生活质量高、器官功能影响小、不良反应轻、治疗肿瘤的局控率高、患者生存时间长的高质量医疗服务。
三、放射外科临床实践
(一)临床操作路径
1.患者选择
影像学发现和组织细胞学确认的早期非小细胞肺癌,特别是周围型早期非小细胞肺瘤,都可以成为放射外科治疗的适应患者目前的临床实践结果表明,早期非小细胞肺癌放射外科治疗并不劣于外科手术治疗。因此,符合条件治疗的早期非小细胞肺癌患者经多学科综合治疗(multi-disciplinary team, MDT)讨论推荐治疗方法。放射外科治疗是拒绝外科手术和不能耐受外科手术患者的优先治疗选择。对于既可外科手术也可放射外科治疗的患者,要依据治疗手段选择原则全面考虑,为患者推荐最优治疗方案。关于病理诊断问题,能取病理必须取,如果不能取或患者拒绝取时,应该在多学科会诊确认为早期肺癌,并且获得患者、家属知情同意下可以推荐放射外科治疗或外科手术治疗。
采用放射外科治疗患者是否必须PET/CT进行N和M分期检查并没有严格规定。但是如果PET/CT分期检查,应该在治疗2个月内进行。之所以各国对 PET/CT检查未做严格要求,可能与各国经济发展水平和医保覆盖范围有关。从早期非小细胞肺癌的诊断方式,放射外科治疗与外科手术治疗方式截然不同的角度看,PET/CT检查对提高N分期以及对不能穿刺活检的患者提供肿瘤代谢信息,帮助提高定性诊断可信度方面都是有益的。因此,在有条件的情况下,早期非小细胞肺癌如果在采用放射外科治疗前进行PET/CT检查还是有必要的,无论是对T分期或是定性,还是N分期以及 M分期,都是有临床应用价值的。
放射外科治疗早期NSCLC有无禁忌证?在目前临床实践中的答案是没有。包括年龄大、有慢性阻塞性肺疾病(chronic obstructive pulmonary diseases, COPO)以及心肺功能差等情况都不是绝对禁忌证。但接受放射外科治疗患者的活动状态按美国东部肿瘤协作组评分(eastern Cooperative Oncology Group, performance status, ECOG PS)N该≤3分,预期寿命大于1年。在已行单侧全肺切除、双原发肿瘤和中心型肺癌采用放射外科治疗的肿瘤直径最好<5cm。
2.定位与图像获取
(1)体位固定:
可选用专用的体位固定装置(如立体定向框架)、体位固定板或体位固定网以及全身体位固定袋。
(2)图像获取:
图像获取主要以 CT 扫描为主根据科室使用放射外科技术和经验不同,分别可用慢 CT 扫描、腹部膈肌加压减少呼吸动度扫描,自动呼吸状态下 CT 扫描, CT增强或脱氧葡萄糖(fluorodeoxyglucose, FDG)PET/CT 扫描主要用于中心型肺癌。对于图像获取的呼吸动度处理方式也有多种选项,采用4D-CT进行呼吸运动不同期图像采集,将所有时期图像融合获得呼吸动下的 (internal target volume, TV)边界。如果采用这种4D-CT呼吸运动补偿策略,必须利用4D进行治疗计划设计,4D-CT图像重建应该采3mm(2~3mm)的层厚,至少6个(2~10个)呼吸时相扫描评估呼吸运动,重建常基于呼吸时相排序算法。采用呼气中期扫描可以得到呼吸动度平均状态的图像,但患者配合有相当大难度,呼吸控技术获实时肿瘤追踪照射可缩小呼吸动度的影响,但需要患者呼吸训练配合,而且还需要较好的肺功能。
3.靶区勾画与计划要求
早期肺癌放射外治疗的靶区勾画与肺癌常规放射治疗的靶区勾画有明显的不同。早期肺癌放射外科治疗只对影像学所见病灶进行治疗,不做区域淋巴结预防性照射,这一点是和外科手术治疗早期肺癌截然不同的治疗要求。外科手术切除肿瘤的同时,还要对肺门及纵隔淋巴结进行清扫。从外科手术治疗习惯和临床结果得到的结论是,淋巴结清扫越多,患者的生存结果越好。从早期诊断的角度分析,清扫淋巴结越多,早期诊断越准确,因此生存时间越长。但从机体免疫的角度看,当清扫的淋巴结均为阴性,过度清扫的免疫破坏造成的后果和大面积创伤对机体的影响值得考虑。从这一点看,早期非小细胞肺癌外科手术清扫淋巴结只是精确诊断的需要,而不是治疗的必要,希望放射外科治疗更多早期NSCLC患者的结果来证明淋巴结过度清扫不是必要这个科学问题。
周围型肺癌靶区勾画要求在CT肺窗上进行肿瘤区(gross tumor volume, GTV)是影像所见肿瘤的实际大小,受影像技术分辨率的限制,影像上并不能看见细胞水平的肿瘤生长边界,因此多数研究认为应放适当的临床靶区(clinical target volume, CTV)边界中位数为5mm(3~7mm)。临床实践中应评估本单位系统控制误差决定CTV到PTV(planning target volume, PTV)的边界,以保证GTV的处方剂量不受影响。有学者认为放射外科治疗剂量极高,GTV外周不用放CTV边界,也可以获得很高剂量治疗,因此,有GTV外 CTV为0的报道,无论外放或不外放CTV边界,关键要保证肿瘤受到足够根治剂量照射的边缘剂量范围以达到放射外科治疗的结果。
放射外科技术有的在专用机如射波刀或伽马刀上完成,更多的是在直线加速器通用机上的放射外科功能上完成。采用三维适形放疗(3D-CRT)治疗计划就能完成放射外科治疗。采用容积旋转调强(VMAT)或螺旋断层调强(TOMO)计划设计以及非共面多野聚焦计划设计能更好完成放射外科治疗。射波刀和伽马刀采用特殊方式进行剂量聚焦计划设计。所有治疗计划剂量计算常用迭代卷积或简串卷积算法,蒙特卡洛算法是有效方法。采用直线加速器放射外科功能治疗肺癌,治疗计划的处方剂量通常给予包绕PTV的等剂量线或PTV的D95%~D99%,PTV内剂量分布不要求均匀。而在伽马刀或射波刀的处方剂量通常给予更低处方剂量线,通常50%~70%等剂量线包绕PTV,PTV内剂量分布极不均匀,但采用体部γ刀治疗必须保证PTV剂量分布的适形度(D95%~D99%),覆盖GTV剂量范围要足够大(D90%~D95%)。
4.剂量模式
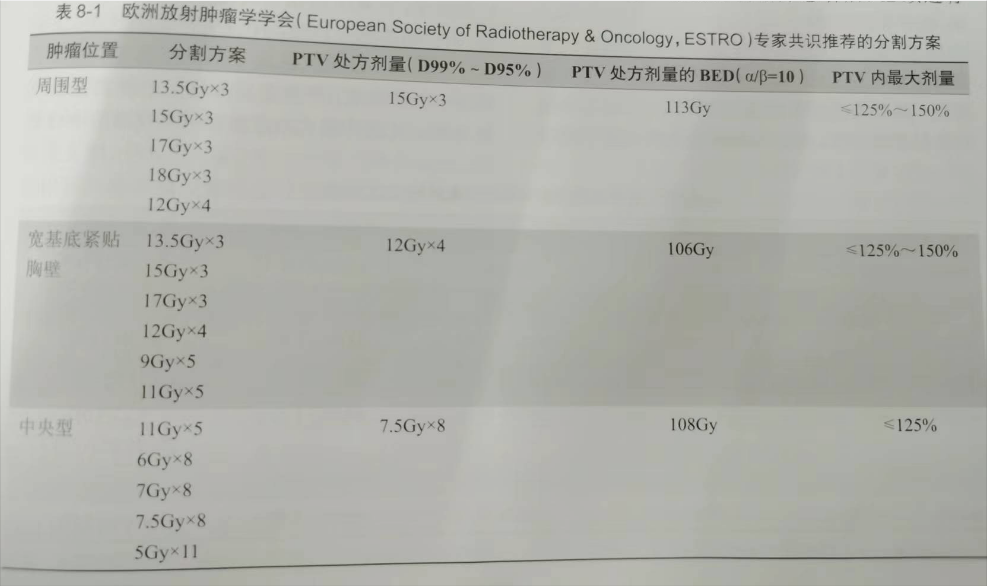
剂量分次模式是决定放射外科治疗早期肺癌成败的关键,决定治疗剂量模式的前提条件是治疗风险。在最大限度控制治疗风险条件下提高肿瘤局控,选择安全、高效的剂量模式。目前为止,世界各国所采用的剂量模式并不相同。在肿瘤高局控率目标一致前提下,通常根据肿瘤位置和大小、采用放射外科技术和治疗风险高低来决定治疗剂量模式。欧洲根据肿瘤位置的治疗风险,将肺癌分为周围型、宽基胸壁接触型和中央型。处方剂量和分割方式如表8-1所示。日本主要对T1期周围性肺癌采用48Gy/4f的剂量模式。美国对周围型肺癌采用60Gy/3f、50Gy/4f或 70Gy/10f的剂量模式,对中心型肺癌多用50Gy/5f或 70Gy/10f,中国对周围型肺癌采用70Gy/10f方案,对中心型肺癌采用 60~70Gy/10~15f方案。
5.图像引导施照
放射外科治疗肺癌最初使用的医科达(Electa)体架和中国体部伽马刀体架体表坐标进行摆位和引导,最终实施治疗的方法目前已经很少使用,因不能保证靶区治疗精度,也不推荐使用。目前常用的图像引导方法有锥形束CT(CBCT)或自带CT 图像引导,4D 容积图像引导以及利用植入金标和x射线平板进行图像引导等技术实施精准施照。必须强调的是,在放射外科治疗患者首次实施照射时,应该有经治医师、物理师和治疗技师团队一同参与,全面了解治疗全程的一致性和精准掌控质量标准,有任何环节出现误差或与定位、计划以及靶区位置不符时,必须做出调整和修正。在每次治疗过程中,也就是一次治疗期间内,不需要也没必要做任何技术的图像再验证。

6.不良反应与正常组织限量
放射外科治疗早期NSCLC 的不良反应不是一成不变的,取决干肿瘤的体积、肿瘤所处的位置、放疗剂量分次模式以及患者个体差等因素。一贯以来,放射性肺炎都被视为肺癌放疗中最常见,最可能引起致死性后果的并发症,因此,正常组织体积剂量限制和放射损伤风险评估是决定放射外科治疗的关键因素。如Timmerman等在Ⅱ期临床试验中,同样采用放疗60Gy/3f剂量模式,周围型肺癌Ⅱ级以上放射反应仅为 17%,而中心型肺癌有14例患者出现严重放疗并发症,包括肺功能指标下降、胸腔积液及放射性肺炎,发生率高达46%,最终有6例患者死亡。这一试验充分表明同样的技术在不同剂量模式下不良反应有显著差异,Barriger等总结251例接受放射外科治疗的I~ⅡB期NSCLC 患者2 级及以上肺炎的发生率为9.4%,其中2级7%,3级 2%,4级0.4%。夏廷毅等采用总剂量 70Gy/10次,Lagerwaard 等采用 60Gy/8 次,Chang 等采用50Gy/4次,对包括中央型在内的临床Ⅰ期或局部复发肺癌患者进行照射,获得了理想的局部控制率,同时毒性反应轻微。
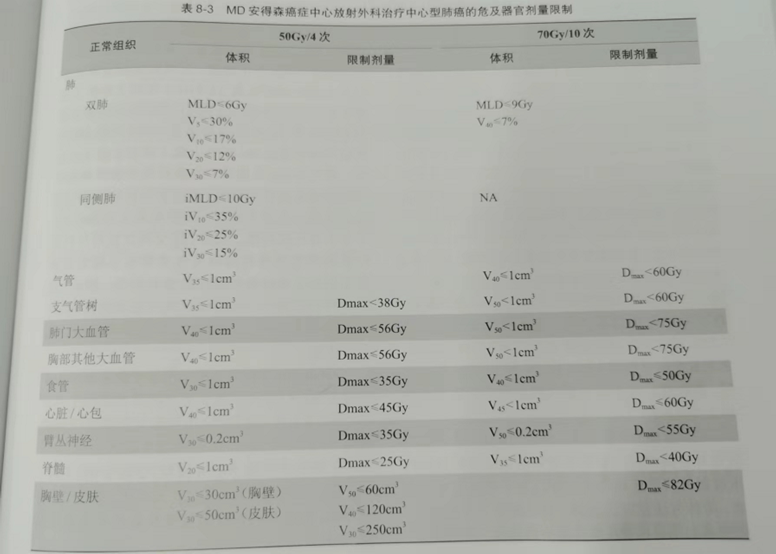
由此可见,在放射外科治疗中,保持正常器官体积剂量最小化至关重要。大多数体积剂量限制都是根据传统分次放疗的经验和相对生物效应计算得出。安德森癌症中心(MDACC)常用的两种分割模式 50Gy/4 次和 70Gy/10 次的危及器官限量可参考表8-3,这个方案是张玉蛟等根据放射外科治疗的经验进行重新优化后制定的。
临床上需要根据分割次数,参考这两种分割模式的限量,也可参考 NCCN 指南或是 RTOG 临床试验,但MDACC 的危及器官限量要比NCCN或RTOG相对保守(表8-4)。如果患者以前有放射治疗史,放疗医师需要评估以往的放疗计划,特别是正常组织接受的剂量,根据以前放疗和目前放疗的有效生物剂量,参考上述剂量体积限制做出一个临床判断。
7.随访
放射外科治疗患者后,必须进行定期随访。在原治疗单位进行影像等检查和评估,详细掌提息者放射外科治疗计划的剂量分布对正确解读随访影像等检查的对应关系至关重要。不能到原治疗单位随访检查评估,至少应该定期将影像检查结果和电话或微信随访结果记录,了解患者治疗情况。如果CT检查怀疑局部复发,可以进行FDG PET检查鉴别。如果影像学检查(CT和FDG PET)怀疑局部复发的患者,如有进一步采用挽救性治疗机会时,建议活检病理确认后进行下一步治疗,周围型肺癌在放射外科治疗失败后接受再程放射外科治疗是安全、有效的选项,但必须调整剂量模式和掌握周围正常组织限量。
8. 挽救治疗
早期 NSCLC 患者接受放射外科治疗后局部复发患者的挽救治疗包括再次放射外科治疗和手术治疗。对于可以手术的患者,两种方法都可以选择;无法耐受手术的患者,放射外科治疗是首选的挽救治疗措施。
参考书籍:
[1]夏廷毅,张玉蛟,王绿化.肿瘤放射外科治疗学[M].人民卫生出版社,2022.
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论