2021年 WHO CNS 5 中枢神经系统肿瘤分类概述
2021年 WHO CNS 5 中枢神经系统肿瘤分类概述

1例(男/50岁)复发性胶质母细胞瘤再程同步放化疗- 4D TOMO放疗+电场治疗(TTF)

【摘要】
本文综述了2021年6月29日《Neuro-Oncology》上线的第五版中枢神经系统肿瘤分类概述的总体变化。2021年第五版世界卫生组织中枢神经系统肿瘤分类(WHO CNS5),是最新版脑和脊髓肿瘤分类国际标准。WHO CNS5建立了CNS肿瘤命名和分级的不同方法,并强调了综合诊断和分层报告的重要性。同时新定义了多种肿瘤类型和相关亚型,包括胶质瘤、室管膜瘤,髓母细胞瘤均有重大改变。WHO CNS5将弥漫性胶质瘤分为成人型和儿童型,成人型弥漫性星形胶质细胞瘤具有微血管增生、坏死和/或特定的分子特征如TERT启动子突变、EGFR基因扩增和/或7号染色体扩增/10号染色体缺失应诊断为胶质母细胞瘤,IDH野生型;IDH突变的胶质母细胞瘤现被称为IDH突变的星形细胞瘤WHO4级。所有IDH突变型弥漫性星形细胞肿瘤被认为是同一类型,分为CNS WHO2级、3级或4级,并且新增CDKN2A/B位点纯合缺失为IDH突变型星形细胞瘤中WHO4级的重要分子标记物。同时新增儿童弥漫性低级别胶质瘤和儿童弥漫性高级别胶质瘤两种类型,各包括4种类型,这些肿瘤的精确分类需要明确其关键分子特征,新增分子标志物包括:弥漫性星形细胞瘤,伴MYB或MYBL1改变;弥漫性低级别胶质瘤,伴MAPK信号通路改变以及弥漫性中线胶质瘤,伴H3 K27改变;弥漫性半球胶质瘤,H3 G34突变型;弥漫性儿童型高级别胶质瘤,H3及IDH野生型,需要综合组织学外观和分子特征做出诊断。WHO CNS5对室管膜瘤、髓母细胞瘤分类也有重大改变,包括幕上室管膜瘤ZFTA融合和YAP1融合、脊髓室管膜瘤MYCN扩增以及后颅窝室管膜瘤PFA组和PFB组以及髓母细胞瘤新增多个亚群,以反映其临床和生物学异质性。此外,WHO CNS5纳入了更多新的诊断技术如DNA甲基化谱分析、光学显微镜、组织化学染色、电子显微镜、分子遗传学用于中枢神经系统肿瘤分类的分子方法。
2021年第五版世界卫生组织中枢神经系统肿瘤分类(the fifth edition of the WHO Classification of Tumors of the Central Nervous System,WHO CNS5),是最新版脑和脊髓肿瘤分类国际标准。WHO CNS5是基于2016版和之后该领域的重大发展,以及中枢神经系统肿瘤分类分子信息和实践方法联盟(cIMPACT-NOW)的建议进行更新。WHO CNS5通过进一步推进分子诊断在中枢神经系统(central nervous system,CNS)肿瘤分类中的作用从而实现了实质性的变化,但仍然依赖于其他已建立的包括组织学和免疫组化在内的肿瘤特征诊断方法。 WHO CNS5肿瘤分类标准具体详见表1,本综述总结了主要的和具体的变化。

表1 2021年 WHO 中枢神经系统肿瘤分类(第五版)
总体改变
1. 中枢神经系统肿瘤分类
一直以来,中枢神经系统肿瘤的分类是基于组织学相关辅助检测的结果(例如免疫组织化学,超微结构)。近年来,分子标记物在提供辅助诊断和明确诊断信息方面越来越重要。因此,WHO CNS5包含了许多对中枢神经系统肿瘤的准确分类有临床病理学意义的分子的改变。表2列举了对CNS肿瘤整合分类诊断变更有重要意义的关键基因和蛋白。WHO CNS5没有推荐对单个诊断改变进行分子评估的具体方法,除非该方法是诊断一种不同的肿瘤类型或亚型所必须的(详见下文)。

表2 不同中枢神经系统肿瘤中关键的基因、分子及信号通路改变
随着分子标记物在脑和脊髓肿瘤诊断中不断进展,如何进行肿瘤分类成为新的挑战。有些肿瘤可以按照分子特征来定义,有些肿瘤分子参数虽然支持它们的分类但并不是必须的,而其它一些肿瘤则很少或不需要使用分子方法来做诊断。因此,疾病病理分类是混乱的。对于一些肿瘤家族,WHO CNS5 已经根据以下特点来完成肿瘤分类诊断:通过基因变化(比如,IDH 和 H3状态);通过松散的致癌相关性,比如MAPK 通路改变;通过组织学和组织基因相似性甚至分子信号改变(比如,其它胶质瘤下面列举的肿瘤,胶质神经元肿瘤和神经元肿瘤);或许多是通过分子特征来定义新类型或亚型(比如,髓母细胞瘤)。这种混合分类法代表了当前该领域的状态,但可能只是向未来更精确分类过渡阶段。比如儿童弥漫性低级别胶质瘤,在该肿瘤中一些肿瘤类型包含几种共同分子特征的亚型,而其它类型则能根据一种单一特征来准确定义,根据最终编辑的讨论来达成共识。
为了使 WHO CNS5与其它五版的蓝皮书标准一致,将使用“type”替代“entity”,“subtype”替代“variant”。表1的分类中只列出类型,亚型列举在亚型部分,并在组织学和/或诊断分子病理学的各个章节中描述。例如,由于上述改变以及类型中分级的使用(见下文),脑膜瘤是一个单一的类型,在分类中只有一项,亚型和分级详见下文。
2. 中枢神经系统肿瘤命名
WHO CNS5遵循2019年cIMPACT-NOW 乌得勒支会议建议,使得中枢神经系统肿瘤命名更加一致简单。过去一些肿瘤的命名以解剖学位置修饰(如第三脑室脉络膜胶质瘤),而另外一些发生在特定部位(如髓母细胞瘤)的肿瘤却没有。某些肿瘤的命名包括基因分型(如胶质母细胞瘤,IDH 野生型),而另一些有特定基因分型的肿瘤(如非典型畸胎样/横纹肌样肿瘤[AT/RT])却没有。因此新版中枢神经系统肿瘤的命名尽可能简化,仅使用具有重要临床价值的位置、年龄或基因分型来命名(例如,脑室外神经细胞瘤与中枢神经细胞瘤)。特别是具有高度典型特征的肿瘤(例如,发生在第三脑室的脊索样胶质瘤),也包含在肿瘤的定义和描述中。此外,肿瘤命名反映的形态学特征并不是在所有该类型肿瘤中都会出现,例如粘液乳头型室管膜瘤,一些粘液样改变不明显,另外一些可能乳头状结构不明显。同样,在多形性黄色星形细胞瘤中,黄色瘤的改变可能仅限于一小部分细胞。尽管如此,这样的肿瘤名称也代表着特定的特征。这些肿瘤命名术语同时可能反映一定的历史关联的通用用法;例如,尽管在发育研究中尚未发现髓母细胞,但髓母细胞瘤一词在肿瘤命名术语中已根深蒂固,改变名称可能会对依赖先前数据的临床护理和科学研究以及流行病学研究造成重大影响。随着肿瘤类型分级的改变(见下文),诸如“间变性”之类的修饰词未被常规包括在内;因此,类似“间变性星形细胞瘤”和“间变性少突胶质细胞瘤”的肿瘤名称并不出现在这一分类中。
3. 中枢神经系统肿瘤分类中基因和蛋白命名规则
WHO CNS5参照 HUGO 基因命名委员会(HUGO Gene Nomenclature Committee,HGNC)的 基因符号和基因名称系统 (https://www.genenames.org/)、人类基因组变异学会(Human Genome Variation Society,HGVS)对序列变异的建议(http://varnomen.hgvs.org/)及《国际人类细胞遗传学命名体系2020染色体改变报告指南》。基因符号以斜体显示,但蛋白质和基因家族(如IDH 基因家族)不以斜体显示。
序列改变的编码方式:编码 DNA 序列,用前缀“c.”报告相对于转录本参考序列的序列改变,后跟核苷酸编号和核苷酸变化。编码蛋白质序列用前缀“p.”后跟参考氨基酸、氨基酸编号和突变产生的变异氨基酸。例如,最常见的BRAF突变就是BRAF:c.1799T>A p.Val600Glu(若选择选单字母氨基酸代码则为BRAF:c.1799T>A p.V600E)。值得注意的是,该示例建立在先前已定义了特定的 BRAF 转录参考序列版本的基础上,例如 NM_004333.5。对于某些基因,例如 H3组蛋白中的基因,可能会与氨基酸编号混淆。由于组蛋白氨基酸位置通常是在缺乏起始蛋氨酸的蛋白质序列的背景下描述的,导致与来自相应基因转录本的预测序列相比,在编号上存在单个氨基酸的差异。因此,因为省略了第一个氨基酸,到目前为止对许多癌症中组蛋白序列改变的描述与 HGVS的编号不同。然而,下一代测序报告遵循HGVS指南。这两个命名方法的共存可能会导致病理学家、肿瘤学家和研究人员的混淆,为了解决这个问题,WHO CNS5在蛋白质水平变异描述后的括号中使用了传统的蛋白质编号系统,例如 H3-3A:c.103G>A p.Gly35Arg (G34R),或 H3-3A:c.83A>T p.Lys28Met(K27M)。在上述例子中,需要预先定义参考转录序列的版本。
4. CNS肿瘤分级
几十年来,CNS肿瘤的分级一直不同于其他非中枢神经系统肿瘤。由于过去的 CNS肿瘤分级在神经肿瘤学实践中已经根深蒂固,在保留过去 CNS肿瘤分级关键要素的基础上,WHO CNS5已将CNS肿瘤的分级向非CNS肿瘤分级靠拢。WHO CNS5对 CNS肿瘤分级有两个具体的改变:使用阿拉伯数字(而不是罗马数字)和肿瘤按类型 (而不是跨不同肿瘤类型)分级。尽管如此,由于 CNS肿瘤分级仍然与其他肿瘤分级系统不同,WHO CNS5赞成在肿瘤分级时使用术语“CNS WHO 分级”(表3~6)。

表3 CNS WHO 肿瘤分级,包括新的分级方法、更新的分级或新发现的具有可接受分级的肿瘤

表4 分层报告结构

表5 分层报告举例

表6 分层报告举例
阿拉伯数字和罗马数字——传统上,CNS WHO肿瘤分级是用罗马数字表示。然而,WHO CNS5强调了更统一的肿瘤分类和分级方法,并支持使用阿拉伯数字进行分级。此外,在肿瘤分级系统中使用罗马数字的隐患在于,“Ⅱ”和“Ⅲ”或“Ⅲ”和“Ⅳ”可能会被相互误认,印刷错误可能会导致严重的临床后果。而当每种肿瘤类型都有不同的名称时,这是不太可能发生的,例如,除了“Ⅲ”级之外,还存在 “间变性”(见表3)。
肿瘤类型内分级——传统上每个 CNS肿瘤实体都有分级,并且该分级适用于不同的肿瘤实体。例如,在 WHO 以前的分类中,如果肿瘤被分类为间变性星形细胞瘤,它被自动匹配为 WHO Ⅲ 级。而间变性(恶性)脑膜瘤也被归为 WHO Ⅲ级,这些不同类别的WHO Ⅲ级肿瘤预计有大致相似的生存时间。但间变性星形细胞瘤的临床演变通常与间变性(恶性)脑膜瘤有很大不同。因此,该方法将肿瘤分级与理想化的临床生物学行为相关联,例如,WHO Ⅰ级肿瘤可以通过手术切除治愈;而WHO Ⅳ级肿瘤是高度恶性的,若缺乏有效治疗则会在相对较短时间内死亡。
这种实体特异性和基于临床肿瘤分级方法不同于其它非 CNS肿瘤的分级方法,其他器官系统中的大多数肿瘤都在肿瘤类型内分级,例如,乳腺癌或前列腺癌是根据其特定的分级系 统进行分级的。在2016年CNS WHO 分类中,对孤立性纤维性肿瘤/血管外皮细胞瘤的分级采用了这种方式,使用单一名称,但可选择3个级别。在 WHO CNS5中,在肿瘤类型内进行分级的转变已扩展到许多类别的肿瘤(表3和表5)。这种转变的原因如下:①在使用与肿瘤类型相关的分级方面提供更大的灵活性;②强调肿瘤类型内的生物学相似性而不是相似的临床行为;③符合非 CNS肿瘤类型的 WHO 分级方式。
临床病理分级——尽管几十年来 CNS肿瘤级别一直与临床生物学行为相关联(见上文),WHO CNS5大体上保留了以前版本中肿瘤级别的范围。因此,IDH突变型星形细胞瘤来自 CNS WHO 2~4级,脑膜瘤来自 CNS WHO 1~3级。也就是说,至少到目前为止,没有CNS WHO 1级的IDH突变型星形细胞瘤,也没有CNS WHO4级的脑膜瘤。此外,鉴于肿瘤是据其预期的自然病程进行分级的,某些恶性肿瘤(如髓母细胞瘤、生殖细胞瘤)即使经过有效治疗后预后良好,在 WHO CNS5中也被指定为 CNS WHO4级,特别是在具有特定分子分型如 WNT 活化髓母细胞瘤。
上述分级方法是一种折衷,因为最初的肿瘤预后相关性研究是基于自然病程,当时有效的治疗方法很少。在现代治疗的背景下,可以极大地影响患者的生存,对每种肿瘤类型进行分级的必要性是值得商榷的。事实上,在 WHO CNS5的编辑讨论中,有专家认为,如果分级可能会混淆临床护理,则不应进行分级(表6)。例如,WNT 活化的髓母细胞瘤是一种胚胎性肿瘤,如果不治疗会有侵袭性,但其对目前的治疗方法反应较好,因此几乎所有患者都能长期存活。将这种肿瘤分类为 CNS WHO4级,相当于许多不能治疗具有较差结局的儿童脑肿瘤,在临床上讨论治疗方案时,可能会有对预后做出错误估计的风险。相反,根据其良好的结果将该肿瘤指定为 CNS WHO 1级,并因此等同于仅基于手术具有相似预后的肿瘤,这无疑给出了肿瘤是生物学良性的误判。
结合分子和组织学分级——传统 CNS肿瘤分级主要基于组织学特征,但某些分子标志物现在可以提供强有力的预后信息。为此,分子标志物现已被添加为分级的生物标志物,并用于进一步评估多种肿瘤类型的预后。WHO CNS5中的例子包括IDH 突变型星形细胞瘤中的 CDKN2A/B纯合性缺失,以及IDH 野生型弥漫性星形细胞瘤中 TERT 启动子突变、EGFR扩增和+7/-10拷贝数变化(即使在组织学级别较低的情况下,允许分类为胶质母细胞瘤,即IDH 野生型CNS WHO 4级)。换言之,分子标志物有时可以增加组织学在分级中的价值。需要注意的是,CNS WHO级别因此不再局限于以前建议的组织学级别。
5. NOS(非特指)和 NEC(未分类)诊断
后缀 NOS和 NEC的使用能够区分标准的、特征明确的WHO诊断和其它诊断:①缺乏必要的诊断信息(如分子)或②无法进行诊断(如WHO诊断)或检测结果为阴性。添加 NOS后缀表示给出特定 WHO诊断所需的诊断信息(组织学或分子)不足,表明分子检测尚未进行或检测失败。另一方面,NEC后缀表示已经成功进行了必要的诊断检测,但结果并不允许进行 WHO 诊断;例如,临床、组织学、免疫组化和/或遗传特征不匹配。NEC诊断是病理学家所称指的“描述性诊断”,病理学家使用非 WHO 诊断来对肿瘤进行分类。在这方面,NEC 的诊断提醒肿瘤学家,即尽管符合病理诊断,但肿瘤不符合标准的 WHO 诊断。与WHO 的诊断一样,使用分层综合报告 (见下文和表4~6)有助于 NEC和 NOS的诊断。
6. 新的诊断技术
许多新技术影响着肿瘤的分类。这些方法包括光学显微镜、组织化学染色、电子显微镜、免疫组化、分子遗传学,以及最近的各种组学分析方法。每一次新方法的出现都对肿瘤的分类进行了补充和辅助,而不是彻底取代其他方法。在过去的几十年里,基于核酸的方法(例如,DNA 和 RNA 测序、DNA 荧光原位杂交、RNA 表达谱分析)已经清楚地显示了它们对肿瘤诊断和分类的贡献能力,并且已在第四次修订(2016版)和WHO CNS5中得到印证。随着2016年分类的修订,此类技术在全球范围内的实用性不断增加。因此,WHO CNS5纳入了更多用于中枢神经系统肿瘤分类的分子方法。
在过去的十年里,甲基化谱-使用氩射线确定基因组中的 DNA 甲基化模式-已经成为中枢神经系统肿瘤分类的一种强有力的方法,在过去几年的各种出版物中有详细介绍。大多数中枢神经系统肿瘤类型可以通过其甲基化谱有效地识别,但要注意的是,甲基化谱的最佳检测方法和调节问题仍有待解决,且该技术目前尚未广泛应用。拷贝数改变也可以从甲基化数据中获得,例如,1p/19q共缺失、+7/-10特征谱、扩增、纯合性缺失以及基因融合等事件。目前,当与包括组织学在内的其他标准技术一起使用时,甲基化谱是脑和脊髓肿瘤分类的有效辅助方法。事实上,绝大多数肿瘤类型和亚型也可以通过其他技术可靠地识别,例如,结合形态特征和特定遗传学改变。另一方面,甲基化谱可能是表征某些具有异常形态特征的肿瘤的最有效的方法,也可能是目前识别某些罕见肿瘤类型和亚型的唯一方法。当少量的活组织样本限制了标准技术的使用时,该方法也是有用的。甲基化谱也可以用作遗传事件的替代标记,例如,在没有检测IDH 突变状态的情况下,甲基化特征可以作为IDH-野生型胶质母细胞瘤的替代标记,但是当靶向治疗和临床试验需要在患者治疗前证明特定突变时,甲基化谱不能作为替代。对于甲基化谱分析的结果,必须注意校准分数阈值;阈值可以设置为0.84或0.90,病理学家应当在分数低于0.84时谨慎做出建议诊断,如果分数低于0.50则应放弃。与其他诊断检查一样,病理学家在解释结果时必须考虑组织学特征(如肿瘤细胞数量和纯度);例如,甲基化谱可能难以对低级别弥漫性胶质瘤进行分类。因此,对于 WHO CNS5,假设几乎所有(但不是所有)肿瘤类型都有着对应的甲基化特征;然而,关于甲基化谱的信息包括在基本和理想诊断标准及定义部分,该方法可以为诊断提供更关键的指导。
7. 综合和分层诊断
由于分子信息在 CNS肿瘤分类中越来越重要,诊断报告需综合不同类型数据。WHO CNS5体现了综合诊断的运用。即使是不包含分子术语的诊断也可能需要一个分子特征来进行诊断(如 AT/RT)。因此为了全面展示现有的诊断信息,强烈建议使用分层诊断报告,这一点得到了国际神经病理学会-哈勒姆共识指南和癌症报告国际合作组织的认可。报告特点是在顶部有一个整合诊断,然后是分层显示组织学、分子和其他关键类型信息(表4)。部分肿瘤类型列出的诊断命名是通用的(例如,儿童弥漫性高级别胶质瘤,H3-野生型和IDH-野生型以及弥漫性低级别胶质瘤,MAPK通路改变型);对于这些类型,从相关组织学和分子生物学指标中提取相关诊断信息,对于达到特定的整合诊断是必要的。此方法在每个肿瘤分组中都有描述,并与2016 年 CNS WHO 对髓母细胞瘤的分类以及cIMPACT-NOW Update4对小儿低级别弥漫性胶质瘤的建议相似:组织学命名与基因学定义联合整合诊断(表4~6)。尽管每个列表可能包含许多项,但某些组合比其他组合更常见。以弥漫性低级别胶质瘤,伴MAPK 通路改变为例,由分层描述形成的整合诊断数量是可控的,而其中常见的整合诊断作为该类肿瘤的一种亚型。
在 WHO CNS5中,主要以表格方式陈列肿瘤类型的基本和可用的诊断标准,旨在评估诊断标准以及整合诊断。包括基本诊断(必须具备的特征),但可能有不同的组合,即不是所有诊断标准都需要。对于这些诊断类型,应该密切注意基本诊断标准表中“和”与“或”的使用。另一方 面,诊断标准中还有“充分非必要”的特征,是明确支持诊断,但本身不是必需的特征。
8. 肿瘤新类型和修订命名
具体变化见下文。 WHO CNS5接纳了多种新类型(表7),以及显示更明显的微观特征(图1~8)。此外,更改一些肿瘤实体的命名方法,既阐述分子表型改变,又遵循了 cIMPACT-NOW Update6的命名指南(表8)。其他命名方法修订为与其他蓝皮书一致。

表7 《2021年 WHO CNS5》中新认定的肿瘤类型

表8 《2021年 WHO CNS5》中修订命名或修订位置的肿瘤类型
部分新类型肿瘤需要进一步研究才能被认可,因为它们在临床病理学上似乎不同。这3种新肿瘤实体在表格中用斜体表示;具有少突胶质细胞瘤样特征和簇状核(DGONC)的胶质神经元肿瘤;筛状神经上皮肿瘤;颅内间叶 性肿瘤,FETCREB融合阳性。已发表的文献仍然质疑肿瘤新类型的性质,例如神经上皮肿瘤,PATZ1融合阳性,文献中只描述了少数病例。虽然未发表的数据表明这些病变具有明显的分子改变,但它们的组织病理学外观和临床发展存在明显的异质性,因此需要更多已发表的数据来评估这些病例是否是不同的肿瘤类型。
具体改变
1. 胶质瘤,胶质神经元肿瘤,神经元肿瘤
WHO CNS5采取了一种新的方法来区分胶质瘤、胶质神经元肿瘤、神经元肿瘤,并将它们分成了以下六类:①成人弥漫性胶质瘤(成人原发性脑肿瘤中最常见的神经源性肿瘤,例如:胶质母细胞瘤,IDH 野生型);
②儿童弥漫性低级别胶质瘤(预后较好);
③儿童弥漫性高级别胶质瘤(常具有侵袭性);
④局限性星形细胞胶质瘤(与第1、2、3组的“弥漫性”不同,“局限性”指的是肿瘤更坚实的生长模式;
⑤胶质神经元性和神经元性肿瘤(一组不同的肿瘤,以神经元分化为特征);
⑥室管膜瘤(现在根据位置,组织和分子特征进行分类)。
脉络丛肿瘤具有明显的上皮特征,不同于胶质瘤、胶质神经元肿瘤和神经元肿瘤。
胶质瘤、胶质神经元肿瘤和神经元肿瘤的分类增加了14种新的类型(表7)。对于其中的一些类型,特别是儿童弥漫性高级别胶质瘤 H3野生型和IDH野生型以及弥漫性低级别胶质瘤 MAPK 通路改变,需要综合组织学外观和分子特征才能做出诊断。也有一些现有的命名发生了变化,比如弥漫性中线胶质瘤现在被命名为 “H3K27改变型”,而 不 是 “H3K27M 突 变型”。星形母细胞瘤被分为“MN1改变型”,尽管还需要进一步的工作来建立明确的组织病理学和分子标志物,MN1改变的星形细胞瘤可以与具有相似基因改变的形态相似的神经上皮肿瘤区分开来。对于其他肿瘤类型,包括遗传和解剖位点修饰物的命名变化遵循cIMPACT-Now Update 6和cIMPACT-Now Update 7的建议。几乎所有这些新发现的类型都可以根据标准的组织学、免疫组织化学和分子分型进行诊断。
弥漫性胶质瘤分为成人型和儿童型
重要的是,WHO CNS5认识到主要发生在成人 (称为“成人型”)和主要发生在儿童(称为“儿童型”)的弥漫性胶质瘤之间的临床和分子差异。请注意最后一句中“主要”一词的使用,因为儿童型肿瘤有时可能发生在成人身上,尤其是年轻人,而成人型肿瘤可能更少发生在儿童身上。然而,成人型和儿童型弥漫性胶质瘤在明确预后和生物学上不同的肿瘤分类方面更进一步。这样区分旨在改善儿童和成人中枢神经系统肿瘤患者的护理。
简化常见成人型弥漫性胶质瘤的分类
在 2016年更新的第四版CNS分类中,成人常见的弥漫性胶质瘤分为15类,并且加以分级(例如,间变性少突胶质细胞瘤与少突胶质细胞瘤类型不同),有些附加 NOS(例如,弥漫性星形细胞瘤,NOS)。而 WHO CNS5只包括3种类型:星形细胞瘤,IDH 突变型;少突胶质细胞瘤,IDH 突变伴1p/19q联合缺失;胶质母细胞瘤,IDH 野生型。
此次分类重点是:①更加普遍地使用 NOS 和NEC术语;②认识分子诊断意义,更客观的定义肿瘤类型(例如,少突星形细胞瘤或IDH 野生型弥漫性星形细胞瘤);③使用分级进行分类,而不是要求每个分级有不同的名称(见上文)。此外,在第五版世卫组织蓝皮书中,亚型(如胶质肉瘤和巨细胞胶质母细胞瘤)未列入分类,但这些经典亚型在各自章节中进行讨论。
常见成人型弥漫性星形胶质细胞瘤命名和分级
在2016年 WHO 分类中,IDH 突变型弥漫性星形细胞瘤根据组织学参数分为3种不同的肿瘤类型(弥漫性星形细胞瘤、间变性星形细胞瘤和胶质母细胞瘤)。现在,所有IDH 突变型弥漫性星形细胞肿瘤被认为是单一类型(星形细胞瘤,IDH 突变型),然后被分为 CNS WHO 2级、3级或4级。此外,分级不再完全是组织学的,因为CDKN2A/B纯合缺失的存在导致 CNS WHO 分级为4级,即使没有微血管增生或坏死。
对于成人的IDH野生型弥漫性星形胶质细胞(NB:弥漫性和星形胶质细胞)肿瘤,许多文献已表明存在3个基因参数中的1个或多个(TERT 启动子突变,EGFR基因扩增,7号染色体增加和10号染色体完全丢失[+7/-10])组合似乎足以确定 WHO 最高等级。因此,成人IDH 野生型弥漫性和星形胶质细胞瘤如果有微血管增生或坏死、TERT 启动子突变、EGFR基因扩增、+7/-10染色体拷贝数改变,应诊断为胶质母细胞瘤,IDH 野生型。然而,发生在年轻人群的IDH 野生型弥漫性星形细胞瘤,应考虑为不同类型的儿童弥漫性胶质瘤(见下文)。
儿童弥漫性低级别及高级别胶质瘤
从概念和实践上新增两种新类型用以区分儿童类型胶质瘤与其他弥漫性胶质瘤是非常必要:分别是儿童弥漫性低级别胶质瘤和儿童弥漫性高级别胶质瘤。
低级别组包括4种,其特征是脑内弥漫性生长,但存在重叠的组织学特征,特异性较差;总之,分子研究有助于病变定性。在 CNS5中这4种类型分别为弥漫性星形细胞瘤,伴 MYB或 MYBL1改变;血管中心型胶质瘤;青少年多形性低级别神经上皮肿瘤(通常缩写为 PLNTY,图1);以及弥漫性低级 别胶质瘤,伴MAPK 信号通路改变。最后一种诊断包括星形细胞或少突胶质细胞形态的肿瘤。与大多数其他胶质瘤类型一样,这些肿瘤的精确分类需要分子特征,并以分级诊断形式综合组织病理学和分子信息。并且明确的分子特征为这类肿瘤的靶向治疗奠定基础。
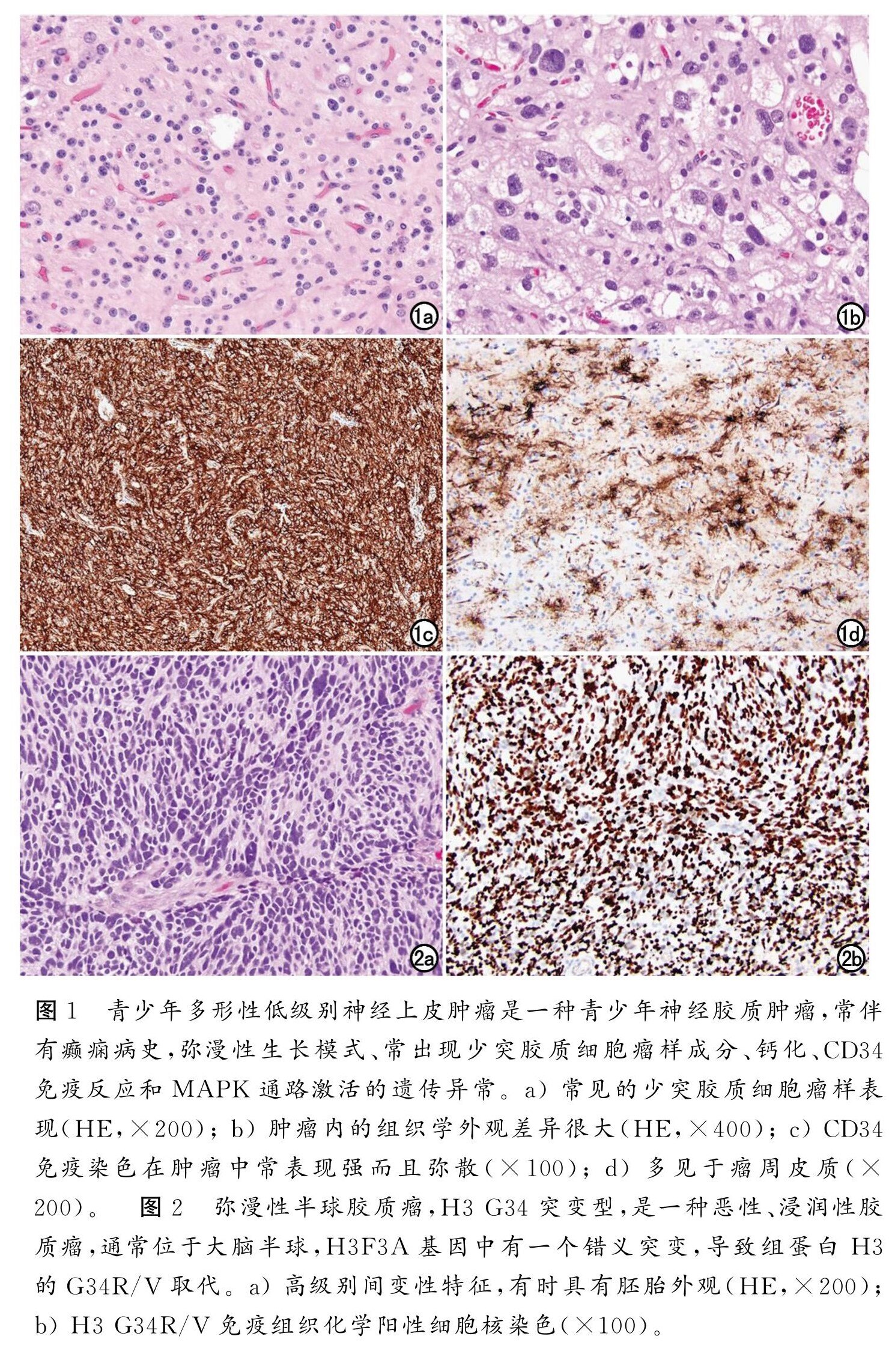
图1、图2
高级别组 也包括4种类型:弥漫性中线胶质瘤,伴H3 K27改变;弥漫性半球胶质瘤,H3 G34突变型(图2);弥漫性儿童型高级别胶质瘤,H3及IDH 野生型;婴儿型半球胶质瘤。弥漫性中线胶质瘤,H3 K27改变曾被列入2016年的分类,但如上所述,它的名称已被更改,以反映这样一个事实,即除了先前发现的 H3 K27突变外,其他变化 (例如,EZHIP 蛋白过度表达)也可以定义这一实体,其余3个为新识别的类型。弥漫性儿童型高级别胶质瘤,H3野生型和IDH 野生型都是 H3和IDH基因家族的野生型,和许多其他中枢神经系统肿瘤类型一样,需要分子特征以及整合组织病理学和分子数据来诊断。神经元和胶质神经元肿瘤在 WHO CNS5中,所有含有神经元成分的肿瘤仍归为一类。新增三种类型,尽管第一种是临 时的(即:很可能在未来的分类中成为一种完全被认识的类型,但目前正在等待进一步的特征描述):DGONC(临时性);粘液样胶质神经元肿瘤(图3);以及曾在2016年关于神经节细胞瘤中被讨论的多结节及空泡状神经元肿瘤(图4)。
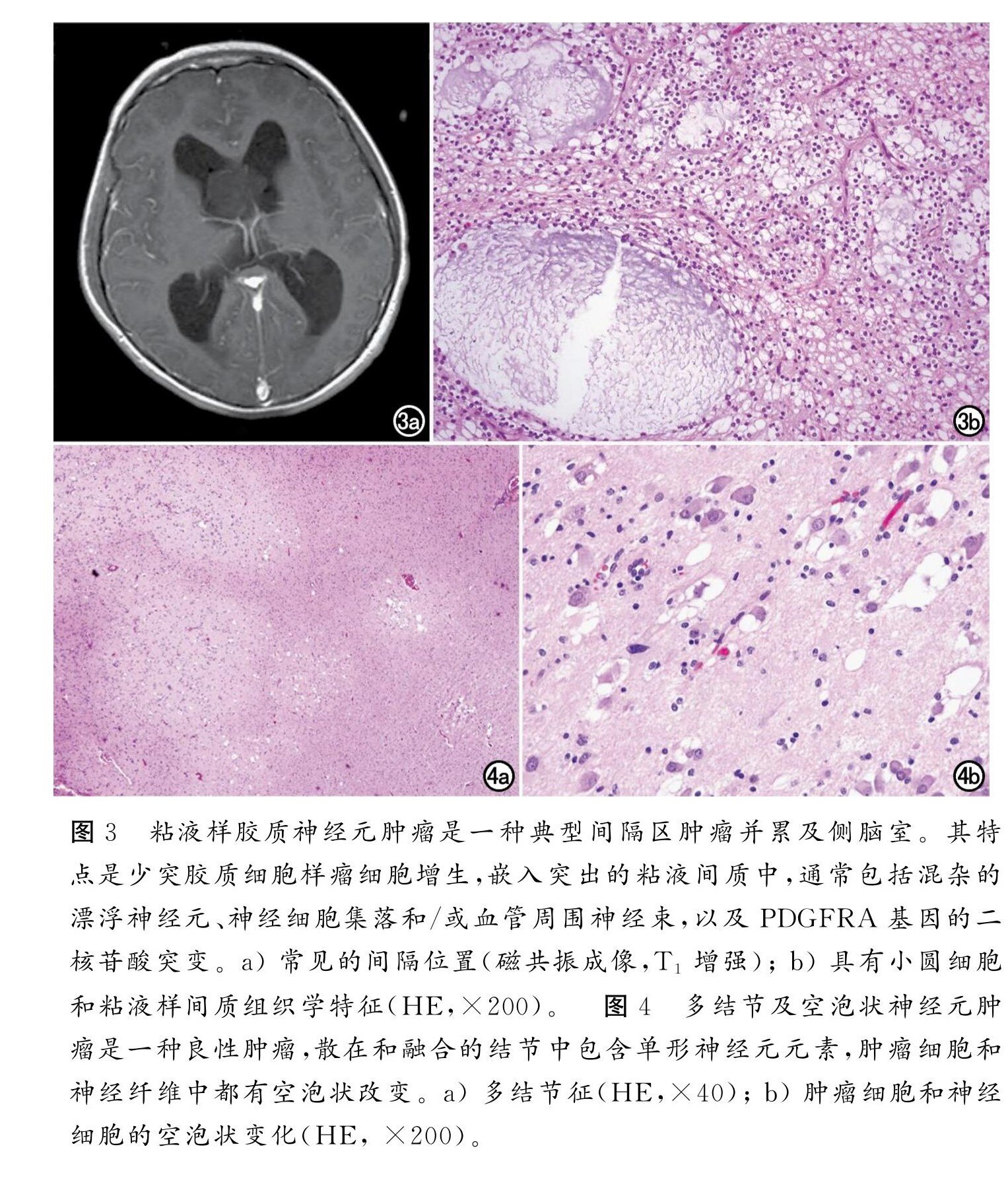
图3、图4
室管膜瘤
现在应该根据组织学和分子特征以及解剖部位组合分类,它们分为幕上、后颅窝(PF)和脊髓间的分子群(表1)。WHO CNS5现列出幕上室管膜瘤的两种分子分型:一种是ZFTA(Cllorf95的新名称,它比RELA 更能代表肿瘤类型)融合,另一种是 YAP1融合。和用 MYCN 扩增状态定义脊髓肿瘤一样,PF 室管膜瘤同时也有两种分子定义类型:PFA 组和 PFB组。还列出了由解剖位置而不是分子改变定义的室管膜瘤,当分子分析发现特定部位的室管膜瘤与用于定义室管膜瘤的分子改变不同时,或者当分子分析失败或不可用时,可以用解剖位置来定义室管膜瘤。如上所述,前一种情况使用 NEC 后缀,而后者使用 NOS后缀。粘液乳头状室管膜瘤和室管膜下瘤仍然是肿瘤类型;目前虽然可以通过甲基组研究来鉴定这些肿瘤,但分子分类并不能为这两种肿瘤提供额外的临床病理价值。与 WHO 以前的分类不同,粘液性乳头状室管膜瘤现在被认为是 CNS WHO2级而不是1级,因为现在认为它的复发可能性与传统的脊髓室管膜瘤相似。乳头状室管膜瘤、透明细胞瘤和伸长细胞瘤亚型不再被列为室管膜瘤的亚型,被室管膜瘤的组织学描述取代。
长期以来,关于室管膜瘤分级的可重复性和临床病理效用一直存在争议。尽管在幕上室管膜瘤成人患者的治疗分层中使用WHO 分级仍然是既定的做法,但是该患者群体中分子改变的全部临床相关性正在评估中。 WHO CNS5只允许在3个解剖部位中的一个作出室管膜瘤的组织学诊断;不再列出“间变性室管膜瘤”。尽管如此,对于 WHO CNS5中的其他肿瘤,病理学家仍然可以根据室管膜 瘤 的 组 织 学 特 征,选 择 将CNS WHO 分 级 为2级 或3级。在综合诊断中,可以在特定级别中显示 CNS WHO 分级。
2. 脉络丛肿瘤
分类基本保持不变,尽管这个肿瘤家族已经与原发性神经上皮肿瘤分开,原发性神经上皮肿瘤的特征是胶质和/或神经元分化较多,上皮分化较少。
3. 髓母细胞瘤
WHO CNS5 改变了髓母细胞瘤的分类,以反映其临床和生物学异质性。最初,Consensus建立了4个主要分子群:WNT 激 活、SHH 激 活、第3组和第4组。2016 年的分类包括 WNT 和SHH 髓母细胞瘤,SHH 肿瘤根据TP53状态进行划分 (其中TP53突变型和 TP53野生型肿瘤具有明显不同的临床病理特征)。非WNT/非 SHH髓母细胞瘤 包括第3组和第4组肿瘤。这些群体在 WHO CNS5(表1)中有代表;然而,通过大规模甲基化和转录组图谱,在4个主要分子群体以下的更小的水平上出现了新的亚群。SHH 有4个亚组,非 WNT/非SHH 髓母细胞瘤有8个亚组。像髓母细胞瘤的四个主要分子群一样,这些亚群中的一些与临床病理和遗传学特征有关,具有诊断、预后或预测价值。一个例子是 SHH1和SHH2两个亚型(4个亚型中的2个),这两个亚型均以儿童髓母细胞瘤为主。这些亚组显示出明显不同的结果,最近的临床试验数据表明,特定的化疗方案可以帮助那些预后较差的肿瘤患者,表明这些差异可能是预测性的,而不仅仅是预后。
2016年 WHO 分类中列出的髓母细胞瘤的组织病理学分类包括4种形态学类型:经典型、结缔组织增生性/结节性、髓母细胞瘤伴广泛结节(MBEN)和大细胞/间变型。这些现在已经合并成一个部分,描述它们为一种包含性肿瘤类型的形态学模式,组织学定义的髓母细胞瘤。形态学上的差异有其特定的临床联系,分子定义的髓母细胞瘤与形态学模式有明显的联系。几乎所有的 WNT 肿瘤都具有典型的形态学,大多数大细胞/间变性肿瘤要么属于 SHH-3亚组,要么属于Grp3/4亚组2。
考虑到髓母细胞瘤的异质性和根据组织病理学和分子特征相结合对髓母细胞瘤进行分类的需要,这些肿瘤应该以分层和综合的形式报告。对于这些病变,在适当的情况下也存在 NOS和 NEC选项。
4. 其他胚胎性肿瘤
除髓母细胞瘤外包括非典型畸胎样/横纹肌样瘤(AT/RT);多层菊形团胚胎性肿瘤(ETMR);CNS神经母细胞瘤,FOXR2激活型;和伴 BCOR 内部串联重复(ITD,图5)的中枢神经系统肿瘤。在旧版分类中已包括了 AT/RT 与 ETMR,新增伴 FOXR2激活的CNS神经母细胞瘤和伴 BCOR ITD 的中枢神经系统肿瘤。此外 CNS5新识别了3种分子亚型的 AT/RT和一种伴 DICER1 改变的 ETMR(区别于更常见的C19MC类型)。伴 BCOR ITD 的中枢神经系统肿瘤在 WHO CNS5中被归为胚胎性肿瘤,但并未明确这些肿瘤是否为神经外胚层来源。BCOR 外显子15内部串联重复在一些形态相似的肉瘤中有报道,但目前对于这些肿瘤是神经上皮还是间质性肿瘤暂未达成共识;这些肿瘤的病理分型可能会根据今后的发现而改变。筛状神经上皮肿瘤(CRINET)是一个新引入该分类的暂定类型。广义的 CNS胚胎性肿瘤也被包括在胚胎性肿瘤内,从而定义某些特定类型的诊断,如NEC或 NOS。考虑到有时病变中存在组织学与分子的复杂性,一份完整的分级诊断报告有助于透明和有效地交流相关肿瘤特征。
5. 松果体肿瘤
松果体肿瘤包括松果体细胞瘤、中度分化的松果体实体瘤和松果体母细胞瘤,以及松果体区乳头状瘤(PTPR)。WHO CNS5新增松果体区促纤维增生型粘液样肿瘤,SMARCB1突变型(图6),这是一种缺乏恶性组织病理学征象的罕见 SMARCB1突变型。关于松果体肿瘤的生物学行为,PPTID、PTPR 和SMARCB1突变型促纤维增生型粘液样肿瘤的组织学分级标准仍有许多问题有待确定。
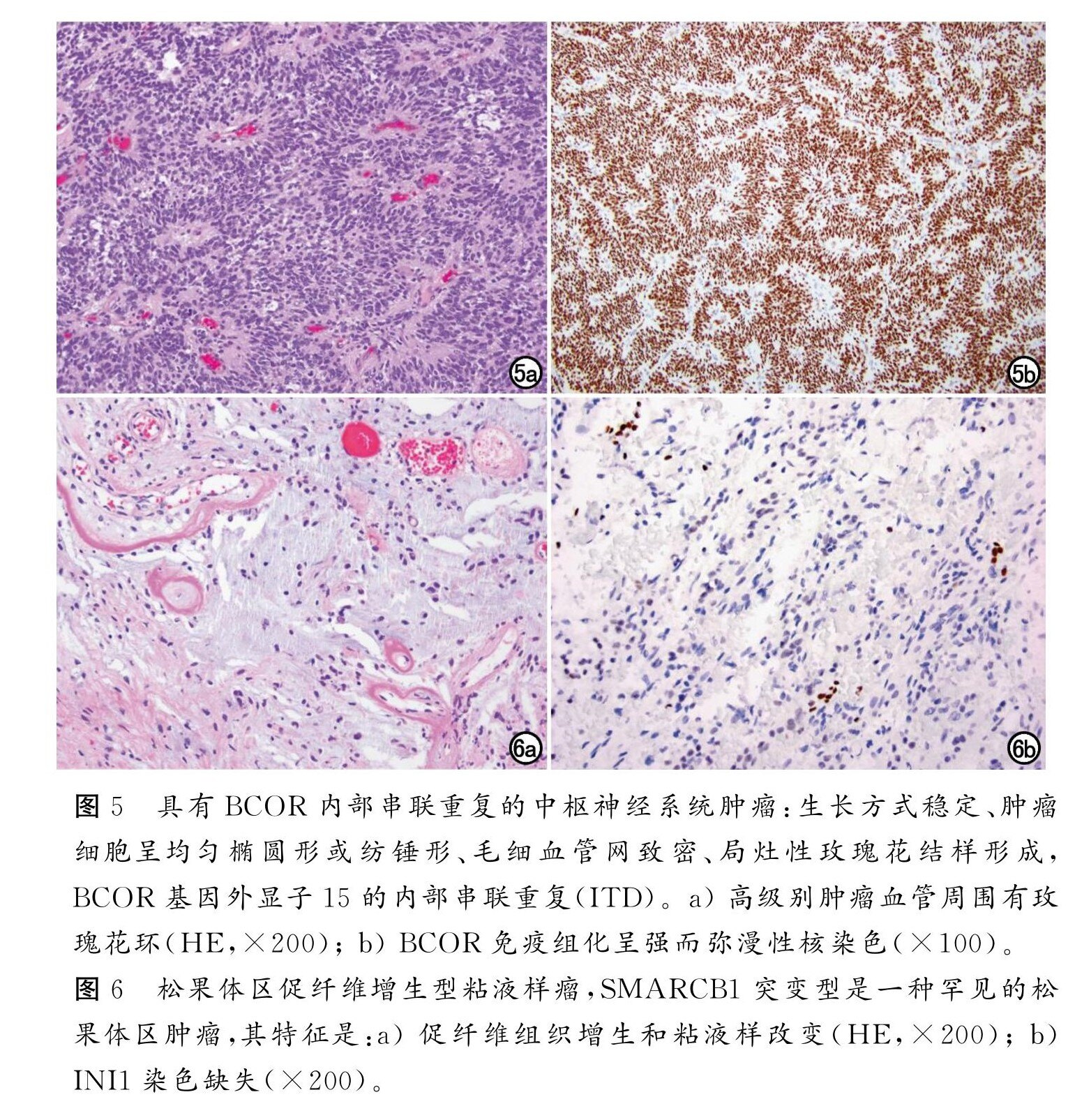
图5、图6
重要的是,分子研究在松果体肿瘤的诊断中发挥了作用。例如,KBTBD4框内插入是诊断 PPTID 的理想标准。使用甲基化分析,松果体母细胞瘤可分为4种分子亚型:松果体母细胞瘤,miRNA 加工改变1型,见于儿童且以 DICER1、DROSHA 或 DGCR8突变为特征;松果体母细胞瘤,miRNA 加工改变2型,多见于大龄儿童且预后相对较好,也以DICER1、DROSHA 或 DGCR8突变为特征;松果体母细胞瘤,MYC/FOXR2 激活型,见于婴儿,有 MYC激活和FOXR2过表达;松果体母细胞瘤,RB1突变型,见于婴儿且与视网膜母细胞瘤相类似。
6. 脑膜瘤
脑膜瘤在WHO CNS5中被认为是单一类型,其15个亚型反映了广泛的形态学谱。现在强调定义不典型或间变性(即2级和3级)脑膜瘤的标准应适用于任何潜在亚型。在以前的分类中,脊索样型脑膜瘤和透明细胞型脑膜瘤的复发率高于普通 CNS WHO1级脑膜瘤,因此被归为 CNS WHO2级;更大规模的前瞻性研究将有助于验证这些建议的 CNS WHO2级分类,并提供额外的预后生物标志物。过去横纹肌样型脑膜瘤和乳头型脑膜瘤符合 CNS WHO3级,不考虑其他任何恶性肿瘤指征。然而乳头状和横纹肌样特征常伴有其它侵袭性特征,因此最近的许多研究建议这些肿瘤的分级不应仅以横纹肌样细胞学或乳头状结构为基础。一些分子生物标志物也与脑膜瘤的分类和分级相关,包括 SMARCE1(透明细胞亚型)、BAP1(横纹肌样和乳头状亚型)、KLF4/TRAF7(分泌型亚型)突变、TERT 启动子突变和/或 CDKN2A/B 纯合子缺 失 (CNS WHO3 级)、H3K27Me3 核表达缺失(其预后可能更差)和甲基化分析(预后分型)。
7. 间叶性非脑膜上皮性来源的肿瘤
WHO CNS5尽量使间叶性非脑膜上皮来源的肿瘤的术语与 WHO 骨和软组织肿瘤蓝皮书中术语保持一致。WHO CNS5目前只包括仅发生在中枢神经系统的肿瘤,或与对应软组织肿瘤相似但经常发生在中枢神经系统的肿瘤;一些常见的软组织肿瘤(如平滑肌瘤)可极罕见的发生于中枢神经系统,但由于其诊断指标与对应软组织肿瘤相同,因此不再归入此类。新增类型有颅内间质性肿瘤,FET-CREB 融合阳性(暂定);伴CIC重排的肉瘤;颅内原发性肉瘤,DICER1-突变型(图7)。在2016年 CNS分类中使用的混合术语“孤立性纤维性肿瘤/血管外皮细胞瘤”现在去除“血管外皮细胞瘤”,修订为“孤立性纤维性肿瘤”,与软组织病理诊断术语保持一致,但新修订的三级 CNS分级方案在不同部位有区别。
8. 神经肿瘤
神经肿瘤的分类发生了一些变化。因为副神经节瘤涉及交感和副交感神经系统的特化神经内分泌细胞,现在被归在神经肿瘤中。由于免疫组化和 DNA甲基化的差异以及缺乏家族关联性,马尾/终丝区副神经节瘤现被认为是一种不同于其它部位常见副神经节瘤的肿瘤类型。此外,现在认为先前分类的“黑色素型神经鞘瘤”是一种有独特遗传基础、高度特异且常伴有侵袭性的肿瘤类型,不同于包括神经鞘瘤在内的其它所有神经鞘肿瘤;根据软组织分类,现将其更名为恶性黑色素性神经鞘瘤。神经纤维瘤中也增加了一个新的亚型:具有未知生物潜能的非典型神经纤维瘤(ANNUBP),这种 NF1相关肿瘤具有令人担忧的恶性转化特征,但仍不足以将其明确诊断为恶性外周神经鞘瘤(MPNST)。
9. 淋巴瘤及组织细胞性肿瘤
WHO CNS5只纳入了CNS中出现相对较多或具有特殊组织学特征或分子特征的淋巴瘤或组织细胞性肿瘤实体。该类疾病的完整谱系另有相应的造血及淋巴系统肿瘤分类来记录。
10. 鞍区肿瘤
在过去的版本里,造釉细胞型颅咽管瘤及乳头型颅咽管瘤被认为是颅咽管瘤的亚型(或变种),但鉴于它们迥异的流行病学、影像学、组织病理学、遗传学特征及甲基化状态,现在它们被分成了截然不同的肿瘤类型。另一方面,垂体细胞瘤、颗粒细胞瘤、梭形细胞嗜酸细胞瘤被划在了同一章节,虽然它们可能只是同一种肿瘤的不同形态,但是流行病学及临床转归的不同让它们仍然被分开归类。
对于垂体腺瘤,WHO CNS5沿用了第四版的分类,按照细胞谱系对其进行划分。此外 WHO CNS5纳入了WHO内分泌组提出的“垂体神经内分泌肿瘤(PitNET)”这一新术语,此概念将在第五版 WHO 内分泌肿瘤分类中被进一步讨论。最后,垂体母细胞瘤(图8),这种罕见的婴儿期胚胎性肿瘤也被纳入 WHO CNS5。
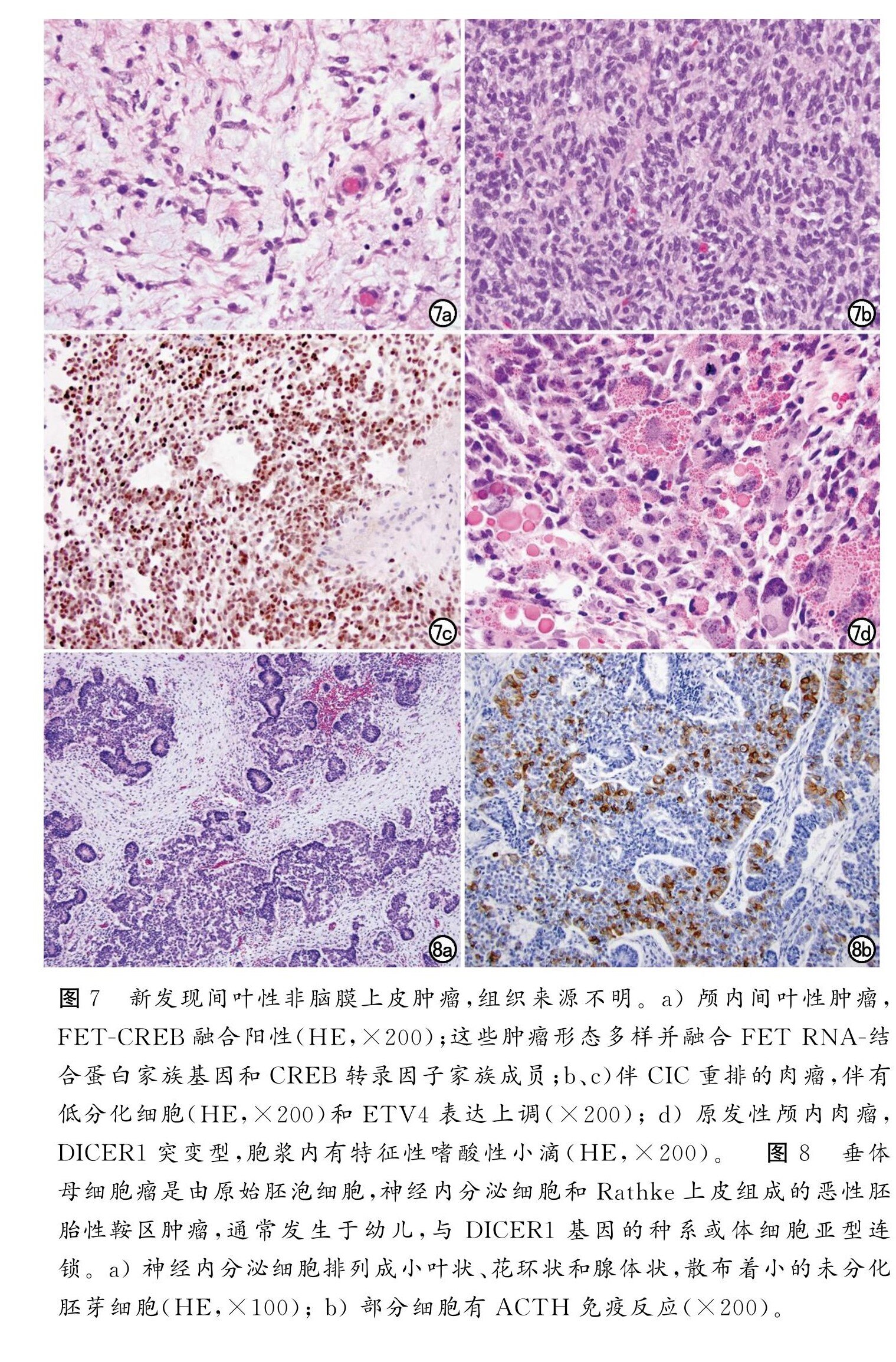
图7、图8
11. 转移瘤
这一章节将转移瘤分为更倾向于侵犯脑或脊髓组织的肿瘤及更倾向于侵犯脑膜或脊膜的肿瘤。鉴于一些全身性肿瘤治疗方案的进展,关注点被更多的集中在了具有诊疗意义的免疫组化及分子标志物上。
12. 遗传肿瘤综合征
虽然遗传肿瘤综合征并不是 WHO CNS5官方分类的一部分,但是第五版 CNS蓝皮书包括了以神经系统肿瘤为特征的肿瘤综合征。此节内容经拓展,进一步包括了蓝皮书中未纳入的8种疾病。
结 论
所有的分类都并非完美无缺,它们只是反映了某一阶段、某一领域中部分专家们的见解。所以,同以往的版本一样,WHO CNS5是我们对中枢神经系统肿瘤不断理解的产物,是这一仍在进行的过程的阶段性成果。WHO CNS5尽可能的谨慎并渐进地将新的知识引入分类系统,包括纳入新识别的肿瘤实体、淘汰概念过时的肿瘤类型以及调整分类结构。希望新版本的改动可以为从事病理及神经系统肿瘤方面的工作者提供具有实际意义的指导,并造福中枢神经系统肿瘤患者。
原文载于:
[1]申楠茜,张佳璇,甘桐嘉,et al.2021年WHO中枢神经系统肿瘤分类概述[J].放射学实践, 2021, 36(7):14.DOI:10.13609/j.cnki.1000-0313.2021.07.001.
Neuro Oncol,2021 Jun 29:noab106.DOI:10.1093/neuonc/noab106.

本文是曾辉版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论