
胃癌9个新靶点和新靶向药物
本文对胃癌的潜力靶点和靶向药物进行了全面梳理,这里面包括了近两年全球范围内首次进入临床试验的“First in class”靶点,和近两年中国开始追逐海外脚步展开临床探索的“Fast follow”靶点。并结合最新临床试验进展进修梳理。
一、Claudin18.2靶点机制
紧密连接蛋白(Claudins)最早由日本京都大学的 Mikio Furuse和 Tsukita Shoichiro于 1998 年首先发现并命名,Claudins 来源于拉丁文 claudere(关闭),表明这些蛋白质具有屏障作用。Claudins 是一种小分子(20~24/27kDa)四次跨膜蛋白,广泛存在于从线虫到人类的许多生物中。它们都具有非常相似的结构,n 末端和 c 末端均位于细胞质中,由一排排蛋白质颗粒组成紧密连接,这些蛋白颗粒形成连续的纤维,将相邻细胞间的空隙封闭上,只允许水分子和离子从衔接处的小孔透过,而使大分子物质难以穿过,Claudins 参与机体细胞旁通透性和电导的调节。CLDN18 是 Claudin(CLDN)蛋白家族的成员,其有 CLDN18.1 和 CLDN18.2 两种异构体。CLDN18.2 蛋白的表达具有组织特异性,在正常生理状态下,CLDN18.2 仅在胃黏膜上已分化的上皮细胞中表达,在其他的健康组织中均无表达;但在胃癌、胰腺癌高表达,乳腺癌、结肠癌、肝癌等原发性恶性肿瘤中表达也较高。同时,Claudin18.2 基因也会出现异常激活,高度选择性、稳定地表达于特定肿瘤组织,参与肿瘤细胞的增殖分化和迁移,这使其成为潜在的抗肿瘤药物有效分子靶点。目前,全球针对 Claudin18.2 为靶点的产品类型包括单克隆抗体、双特异性抗体、CAR-T 细胞疗法和 ADC。
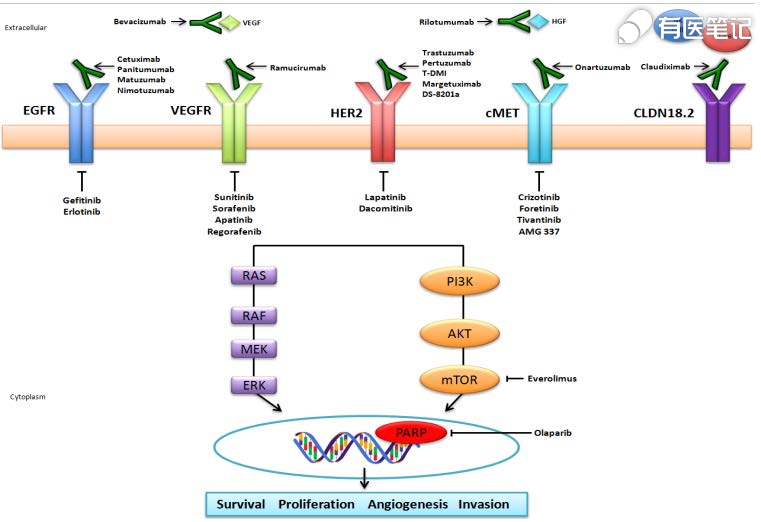
二、HER2靶点机制
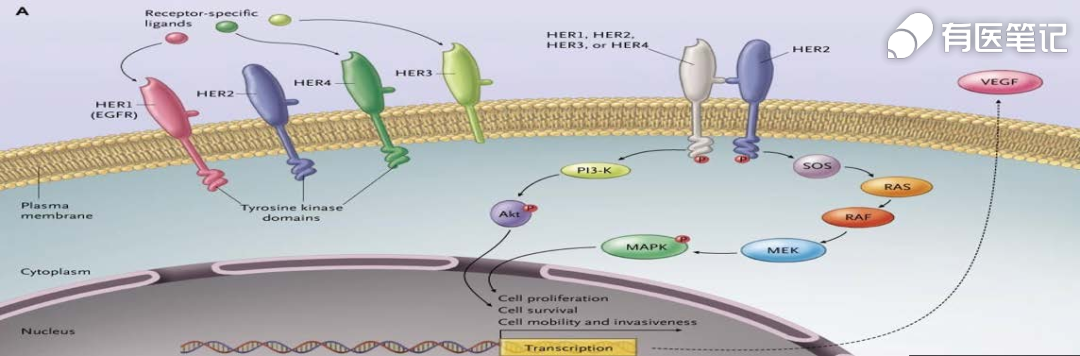
原癌基因人表皮生长因子受体 2(HER2),即 C-erbB-2 基因,定位于染色体 17q12-21.32 上,编码相对分子质量为 185kD 的跨膜受体样蛋白。HER2 同其他 ERBB 家族成员均为具有酪氨酸蛋白激酶活性的跨膜蛋白,由胞外配体结合区、单链跨膜区及胞内蛋白酪氨酸激酶区三部分组成。HER2 蛋白主要通过与家族中其他成员,包括 HER1(EGFR)、HER3 和 HER4 形成异二聚体而与各自的配体结合。HER2 蛋白常为异二聚体首选伴侣,且活性常强于其他异二聚体。当 HER2 与配体结合后,主要通过引起受体二聚化及胞质内酪氨酸激酶区的自68身磷酸化,激活酪氨酸激酶的活性。HER2 蛋白介导的信号转导途径主要有 RAS/RAF/分裂素活化蛋白激酶(MAPK)途径、磷脂酰肌醇 3 羟基激酶(PI3K)/AKT 途径、信号转导及转录激活(STAT)途径和磷酸酯酶 C(phospholipase C,PLC)通路等。HER2 的变异形式包括过表达、突变及扩增。HER2 过表达的发生率在乳腺癌中比例最高,在胃癌、结肠癌中阳性率依次降低。目前,获得国内外药监部门批准的针对 HER2 的靶向药主要有 3 大类:第一类是小分子酪氨酸激酶抑制剂,包括来那替尼(Neratinib)、吡咯替尼(Pyrotinib)、拉帕替尼(Lapatinib)和图卡替尼(Tucatinib);第二类是大分子单克隆抗体,包括曲妥珠单抗、帕妥珠单抗和伊尼妥单抗;第三类是抗体药物偶联物,如恩美曲妥珠单抗(T-DM1)、Trastuzumab Deruxtecan (DS-8201)和维迪西妥单抗。这些靶向药的主要适应证为 HER2 阳性的乳腺癌和胃癌。抗 HER2 突变的其他药物及适应证的临床研究也在进行之中。
三、抗血管生成药物靶点机制
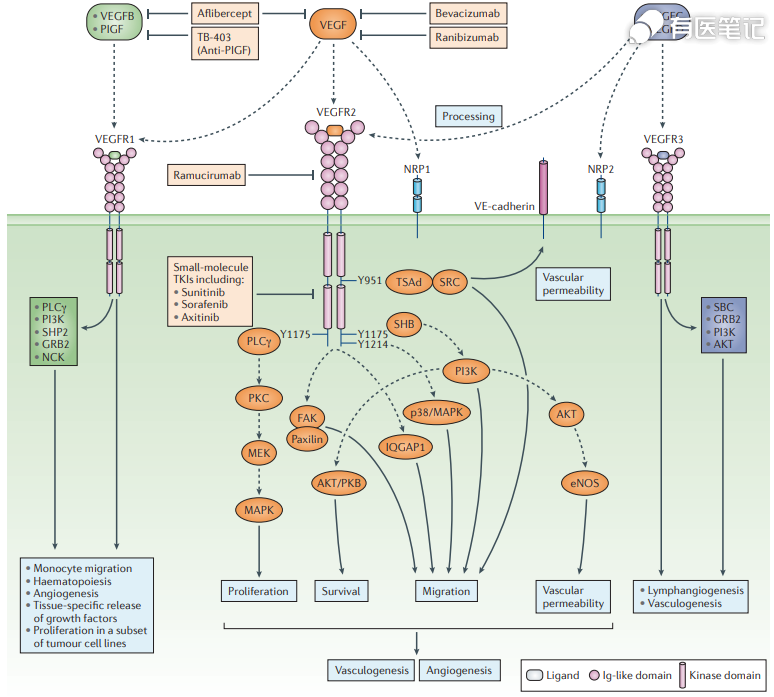
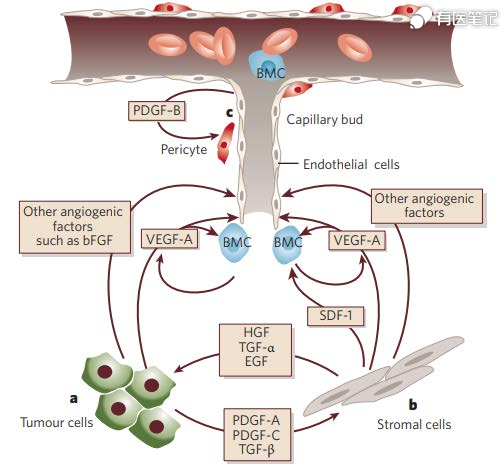
众多研究发现,肿瘤血管生成具有 3 个重要的调节因子及其受体:血管内皮生长因子及其受体(VEGF-VEGFR)、成纤维细胞生长因子及其受体(FGF-FGFR)及血小板衍生生长因子及其受体(PDGF-PDGFR)。2011 年 Cell 杂志归纳的十大肿瘤发生发展机制中,持续的血管生成被认为是肿瘤生长的关键机制之一。抗血管生成药物作用机制的探索和研究随临床实践而不断发展,主要的作用机制有以下几点:抗血管生成药物可以通过“饿死肿瘤”发挥作用;抗血管生成药物使血管“正常化”;抗血管生成药物抑制上皮-间质转化(EMT)和肿瘤干细胞和祖细胞的增殖;抗血管生成药物抑制致癌基因途径的促血管生成作用。近年来,抗血管生成联合治疗方案在多领域中不断被探索和证实。抗血管生成药物和免疫治疗药物联合使用,可以产生协同抗肿瘤作用,可在一定时间内重塑肿瘤生长的微环境,使其变成免疫治疗友好型环境。VEGF 除促进肿瘤血管生成外,还直接参与肿瘤的免疫逃逸机制,抑制免疫细胞通过外渗进入肿瘤组织,以及通过抑制树突状细胞成熟来降低肿瘤抗原的呈现。抗血管生成药物和免疫治疗药物联合使用,通过改变肿瘤微环境以遏制肿瘤免疫逃逸,释放免疫检查点的免疫抑制以压制肿瘤血管生成,从而达到抗肿瘤的协同效应。多项临床研究显示,在一些 PD-1 抗体单药治疗效果不是很理想的瘤种(如肝癌、胃癌和微卫星稳定的结直肠癌等),PD-1 抗体和抗血管生成药物联用都取得了令人鼓舞的进展。PD-1 和 VEGF 在肿瘤微环境同时富集,相对于联合用药,更有利于双特异抗体药物药效和安全性。
四、MET靶点机制
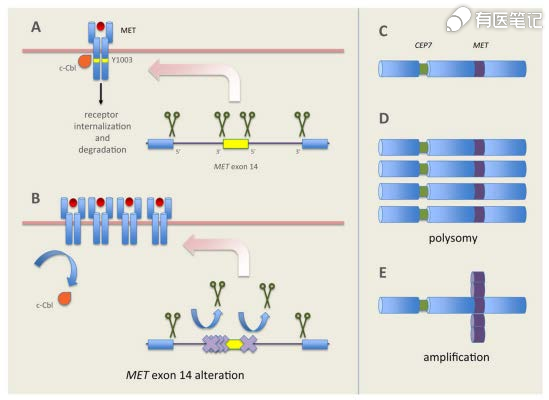
间质上皮转化因子(MET)编码合成的蛋白 c-MET,是一种可以与肝细胞生长因子(HGF)结合的受体酪氨酸激酶。c-MET 通路正常表达时可促进组织的分化与修复,当表达或调节异常时则可促进肿瘤细胞的增殖与转移。MET 通路异常激活存在于诸多实体瘤中,包括脑瘤、乳腺癌、结直肠癌、胃癌、头颈癌、肺癌、肝癌、皮肤癌、前列腺癌及软组织肉瘤等。MET通路的异常激活可以通过非 HGF 依赖性机制发生,主要包括 MET 14 外显子跳跃突变、MET 扩增、重排和 MET 蛋白过表达等。目前认为,MET 高水平扩增和 14外显子跳跃突变是 2 种可治疗的变异,在非小细胞肺癌患者中发生率约 5%。临床上的 MET 抑制剂分为 2 大类:小分子激酶抑制剂和单克隆抗体。小分子酪氨酸激酶抑制剂包括卡博替尼、克唑替尼和赛沃替尼等,以及部分多靶点激酶抑制剂。高度选择性的 MET 激酶抑制剂已经上市的有美国 FDA 批准默克公司的特泊替尼(Tepotinib)和诺华公司的卡马替尼(Capmatinib),用于治疗 MET 14 外显子跳跃突变的非小细胞肺癌。另外,强生旗下杨森公司开发针对 c-MET/HGFR 和 EGFR的双特异性抗体 Amivantamab,被证实在 MET 扩增亚组患者中比 TKI 耐药 EGFR 突变的非小细胞肺癌患者中活性更强;除用于治疗 MET 扩增,Amivantamab 也用于治疗 EGFR 20 外显子插入突变的非小细胞肺癌。
五、CDC7靶点机制
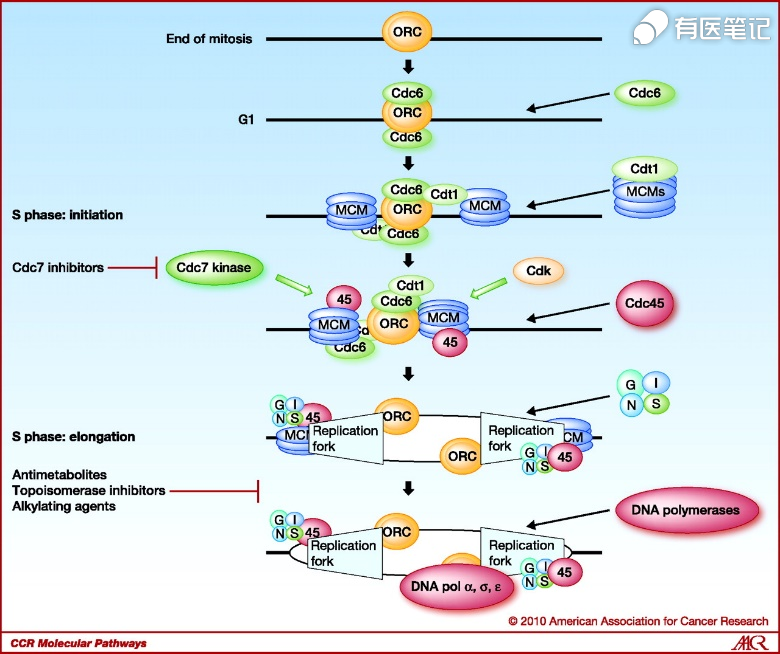
细胞分裂周期 7(CDC7)相关蛋白激酶是一种从酵母到人类的丝氨酸/苏氨酸激酶,通过与活化亚单位 Dbf4/S 期激酶激活剂(ASK)结合而激活,在每个复制起点的起始调节中起关键作用。越来越多的证据表明,CDC7 在肿瘤细胞中起着重要作用,可诱导细胞增殖,并可能与多种恶性肿瘤的预后有关。研究发现,CDC7 在胶质母细胞瘤(GBM)中高表达,与 GBM 患者的不良预后相关。此外,CDC7 诱导 GBM 细胞产生放射抵抗,CDC7 敲除与放射治疗结合时增加细胞凋亡。CDC7 通过调节 RAD54L 启动子活性来调节 DNA 修复/重组蛋白 54L(RAD54L)的表达。在治疗上,CDC7 抑制剂在体外和体内都能抑制肿瘤细胞生长。总之,CDC7促进 GBM 的增殖,诱导放射抵抗,并可能成为 GBM 的潜在治疗靶点。
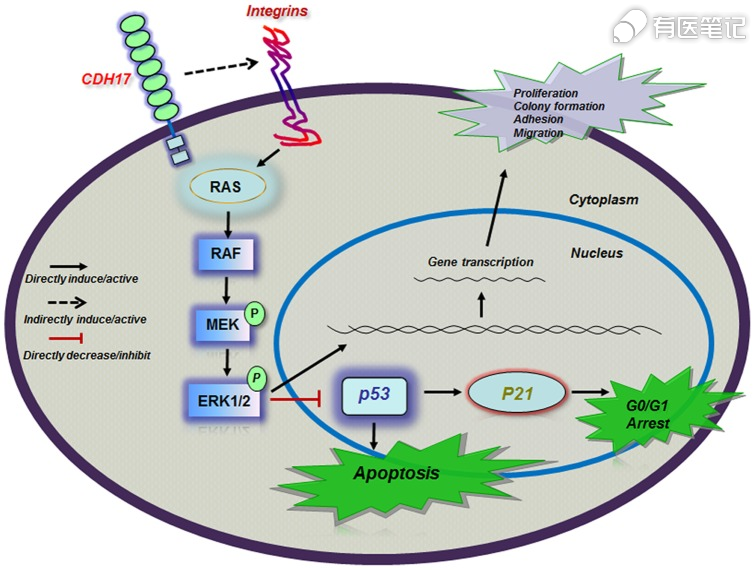
六、CDH17靶点机制
钙黏连蛋白 17(CDH17)是一种表达于肝和小肠的钙黏连蛋白家族新成员,又称肝肠钙黏连蛋白,是钙依赖性的细胞黏附分子。钙黏连蛋白与配体结合后介导钙依赖性的细胞间连接,而细胞间黏附及运动能力失调是肿瘤发生发展和侵袭转移的重要机制之一。钙黏连蛋白的配体称为钙连环蛋白,包括 α-链蛋白、β-链蛋白、γ-链蛋白及 P120 蛋白等,钙黏连蛋白通过钙连环蛋白与细胞内骨架相互作用,从而调控细胞间的黏附功能,但 CDH17 直接与细胞支架相连进行细胞黏附作用。CDH17 表达是预测患者生存期较差的独立预后因素,与胃癌临床分期、浸润深度、淋巴结转移、远处转移相关,与术后总生存期及无病生存期负相关。
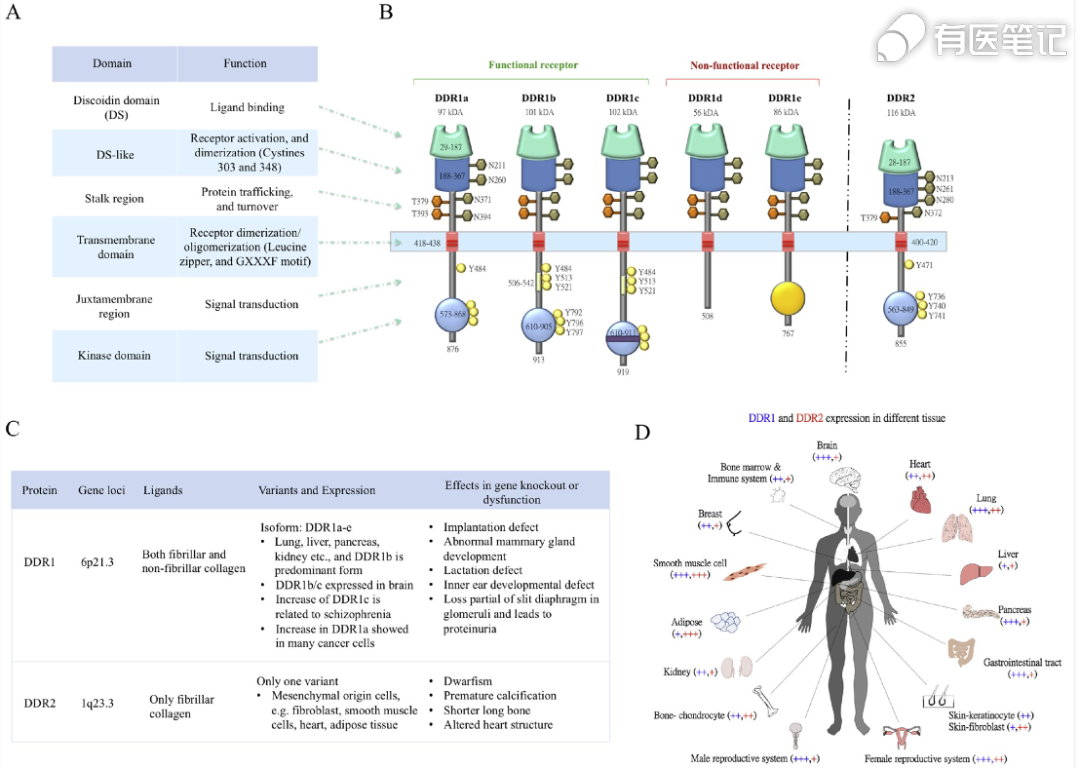
七、DDR1靶点机制
盘状结构域受体(DDR)是一种胶原激活的受体酪氨酸激酶,在调节细胞的形态发生、分化、增殖、黏附、迁移、侵袭和基质重塑等重要过程中发挥重要作用,主要在人体多种组织的表皮细胞中表达。DDR1 和 DDR2 的高表达或者突变与多种恶性肿瘤有关,而且 DDR 过表达与肿瘤淋巴结转移显著相关。DDR1 是阻止免疫细胞靠近肿瘤的关键蛋白;抑制 DDR1 的表达可以降低肿瘤微环境(TME)中的免疫抑制作用,有望成为肿瘤免疫治疗的新靶标。研究发现,在肿瘤发展过程中,DDR1 可以使细胞外基质(ECM)变为高度有序的状态,就像在肿瘤周围包裹上一层“铁丝网”,阻碍免疫细胞浸润及其杀伤肿瘤细胞的作用。在 TNBC 小鼠模型中敲除 DDR1,可以促进肿瘤内 T 细胞的浸润,并能抑制肿瘤的生长。因此,敲除 DDR1 基因或通过抑制 DDR1,有可能阻断肿瘤的抗免疫监控的能力,让免疫细胞成功进入肿瘤杀伤肿瘤细胞。临床前研究提示,DDR1 抑制剂在肝癌、乳腺癌、结肠直肠癌、胃癌、食管癌和NSCLC 患者来源的肿瘤移植小鼠模型(PDX)中表现出广泛且很强的抗肿瘤活性。
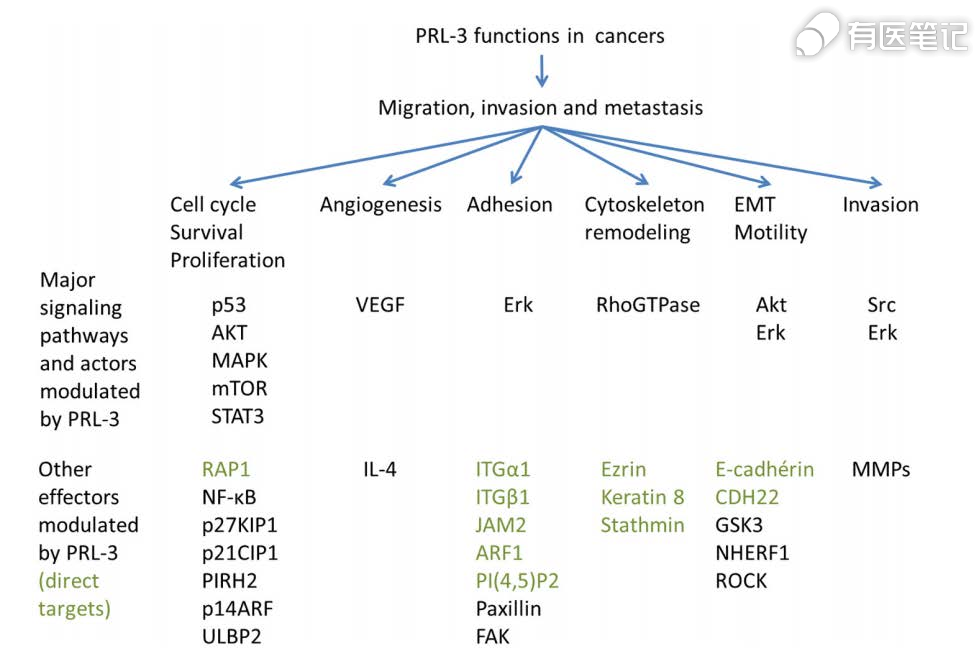
八、PRL3靶点机制
肝再生磷酸酶(PRLs)属非跨膜型酪氨酸磷酸酶家族,其成员包括 PRL-1、PRL-2、PRL-3。研究发现,PRL-3 在肿瘤中表达比 PRL-1 和 PRL-2 高,PRL-3 的异常表达通过对多种信号通路的正/负调节,在肿瘤中发挥促进细胞增殖、迁移、侵袭的作用。如在 AML 中,PRL-3 通过上调 FLT3-STAT5 信号通路,下调 p21、CDK1/2 及 AKT 的活性,促进肿瘤细胞周期进程,提高 AML 细胞对细胞毒性药物的抗凋亡能力;在胃癌细胞中,PRL-3 激活 NF-κB 信号通路,调控 p65 磷酸化促进 HIF-1α 的表达,诱导肿瘤的迁移和侵袭。
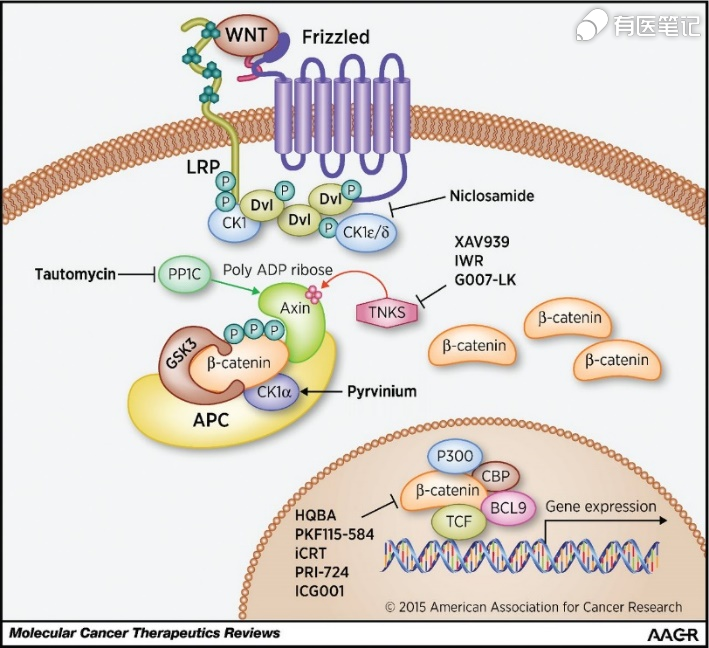
九、RSPO靶点机制
特异性顶部盘状底板反应蛋白(roof plate-specific spondin, RSPO)是一组新型分泌型蛋白,该家族由 4 种典型的人类分泌型蛋白组成,参与激活体内外经典的 Wnt-β-连锁蛋白(β-catenin)信号通路。Wnt 信号通路是一种古老的、进化保守的通路和复杂的蛋白质作用网络,Wnt 途径突变往往与人类胚胎发育、癌症及其他疾病有关。Wnt 与细胞膜上 Frizzled(FZD)受体结合后使下游基因开始转录,产物包括 c-MYC、c-Jun、Fra-1(fos-like antigen 1)、cycD、WISP1 等,与细胞周期相关。多个环节可调节 Wnt 信号通路,如 RSPO 蛋白家族的成员通过稳定膜上 FZD 受体来增强细胞对Wnt 配体的反应能力,这一机制依赖于富含亮氨酸、包含重复的 G 蛋白偶联受体,如脂蛋白受体相关蛋白(lipoprotein receptor-related protein-1,LRP)-5/6 受体。RSPO基因融合或过表达可见于肺癌、结肠癌、头颈癌、卵巢癌和食管癌中。
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论