 三甲
三甲
肝癌BCLC(2022)最新分期(中文翻译全文)
肝癌的临床分期对于预后评估,治疗方案选择至关重要,目前国内外有较多分期方案,应用较多的有BCLC、TNM、JSH、APASL 以及我们国内的CNLC等。巴塞罗那临床肝癌(BCLC)预后和治疗策略2022年更新版本自2021年11月19日网上更新以来,引起国内业界的广泛关注,不同的专业(肿瘤内科、肝外科、介入科等)进行了各自的解读。我们必须对这次更新须有基本的认识,通过阅读原文对此进行了基础的翻译(包括图表),并借鉴他人资料,形成一个翻译版,可能翻译有不恰当之处,仅供本人及关注和欲了解肝细胞癌治疗进展的人士参考!以下为翻译正文:
BCLC预后预测和治疗建议策略:2022年更新
引言
自2018版巴塞罗那临床肝癌(BCLC)预后和治疗策略发布以来,肝细胞癌(HCC)的治疗取得了重大进展。鉴于各个学科都有进步,导致我们的治疗策略需要做出相应改变。也有些临床数据确实非常令人鼓舞,但我们认为并不是非常成熟,还需要进一步研究。总之,基于这些研究,BCLC小组首次邀请了部分组外专家共同制定了该版本HCC指南。
预后预测和患者特征
预后预测应根据肿瘤负荷和肿瘤相关症状进行分层。在上一版BCLC指南中,我们放弃使用Child-Pugh评分来评估肝功能,此次进行了更新。肝脏失代偿(黄疸、腹水、脑病)时,无论Child-Pugh或MELD(终末期肝病模型)评分如何,都说明肝储备功能很差;而代偿性肝功能则可通过增加白蛋白-胆红素(ALBI)评分及AFP水平进行分层。尽管这些指标可能影响预后,但如果肝功能水平不超出既往制定的标准,患者仍可能会治疗获益,此次我们将这些都纳入到2022年BCLC模型中(图1)。
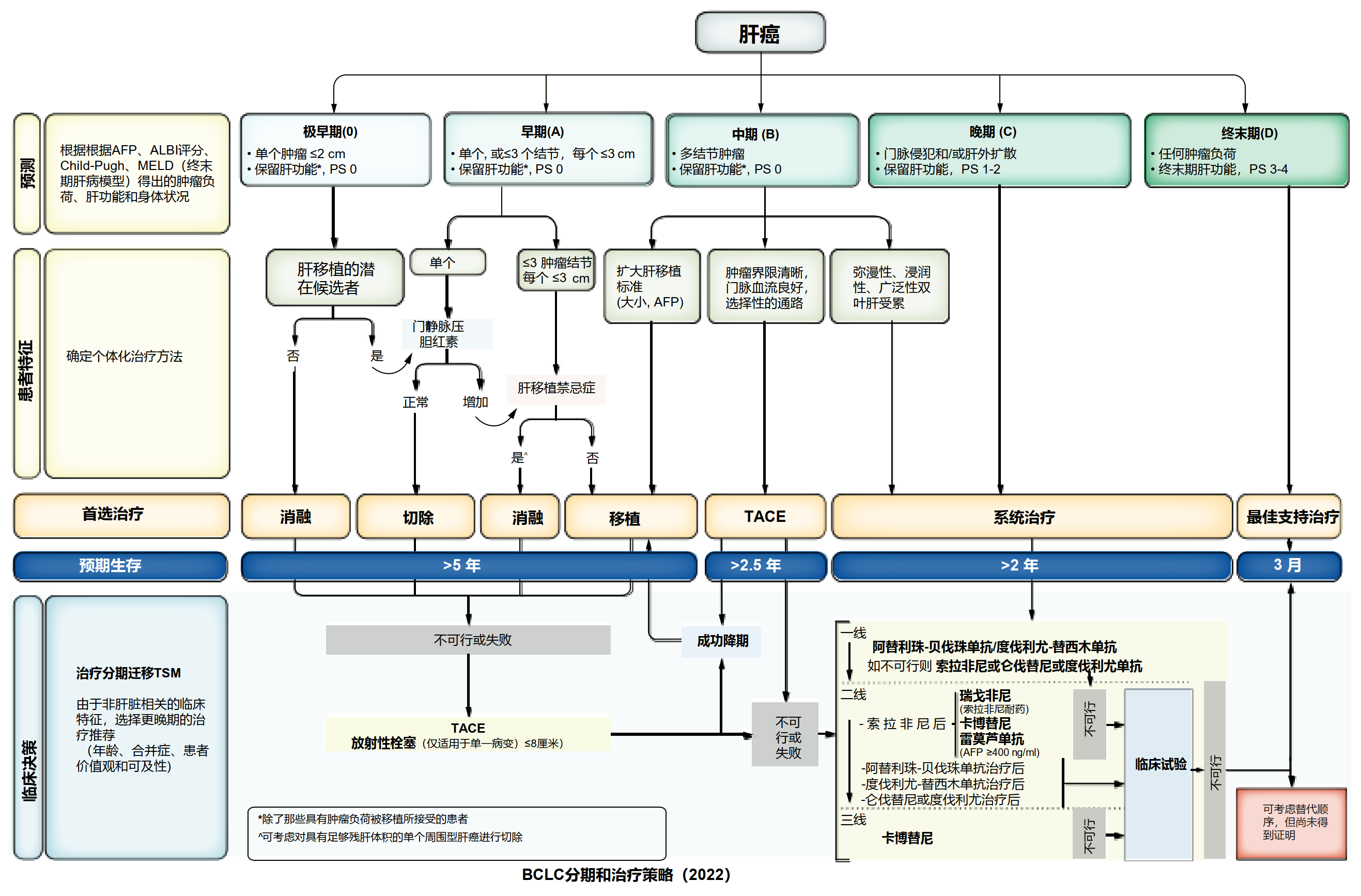
图1
既往有静脉曲张破裂出血病史也是门静脉高压症患者肝功能更差的标志之一,我们选择治疗方式时需要考虑,但不纳入预后预测模型。腹水的程度和对治疗的反应也会影响预后,少量影像学腹水或低钠饮食即可控制的液体潴留,与大量腹水对预后的影响不同。对于体力状态(PS)评估,我们需要强调,PS评分是指肿瘤相关症状,而不是肿瘤诊断之前、与基础疾病相关的症状。但有时候体力状态下降是由肝功能造成的,而肝功能可能与肿瘤负荷有关,也可能与肿瘤负荷无关,这时候确实很难进行PS评分。
临床试验中除了纳入BCLC分期外,同时会制定其他的纳入及排除标准,以确定患者的情况。而在临床实践中,我们除了使用BCLC分期,主治医师及MDT团队也要根据自身经验对患者进行准确地个体化评估。我们需要考虑到肿瘤范围及负荷、营养状况、合并症、年龄,社会关系、价值观及信仰等。分子层面,目前还没有指标可以预测患者预后,或者预测手术或消融后复发,或者根据分子标记物选择最佳治疗方案。
我们知道,临床指南包括BCLC模型都是根据当前的知识水平和科学证据来制定的,最终的决定应由主诊医生和MDT团队做出,需要尽可能考虑到所有因素,为患者制定个体化治疗方式。从最初诊断到确定肿瘤分期、制定最佳初始治疗及序贯治疗,MDT都是关键。个体化管理非常重要,临床决策和治疗建议不能仅基于一些简化的数字,而是一个相当复杂的过程,需要肝癌领域的所有专家,包括放射科、介入科、放疗科、病理科、护士、临床医生、外科医生以及姑息治疗专家和社会工作者需要为此共同努力。
治疗
以下我们将介绍每个BCLC分期的治疗方案。特别强调的是,每个分期都给定了首选的治疗选项,但综合患者的全部临床信息及社会文化因素之后,可能会发生变化,此处我们提出两个重要概念:治疗分期迁移(TSM)和无法治疗进展(UTP)。当综合患者的某些指标之后,我们认为应该建议其优先选择更高一级分期的治疗方式时,即为TSM。而UTP是为接受经动脉化疗栓塞(TACE)治疗的患者开发的,但适用于所有BCLC分期。意思是说当患者出现治疗失败或进展时,其分期可能并没有改变,仍处于初始所在的BCLC分期,但这时应该考虑更晚分期相对应的治疗方案。2022版BCLC治疗指南(图1)设计了一个特定章节,即根据2021年9月15日前的可用数据,如何进行个性化临床决策。我们鼓励对任何分期的患者进行临床试验,以改善当前的治疗获益。
再次强调,虽然BCLC决策图中对每个分期给定了初始治疗选项,但每个患者的具体情况可能会导致其转移到更高级分期的治疗选项(TSM)。甚至某些情况下,治疗可能会从最初建议的早期转移到晚期,甚至不进行治疗。
BCLC 0期
定义为单发肿瘤≤2cm,无血管侵犯或肝外转移,肝储备功能良好且无肿瘤相关症状。BCLC-0期的治疗需根据是否能选择肝移植来确定,并需要考虑临床决策部分所描述的一些特殊因素。是否移植主要考虑了复发风险的问题,上一版BCLC指南中已经描述。如果既可以移植,又符合手术标准,手术切除是第一选择。选择肝移植主要是考虑到如果显微镜下血管侵犯或卫星灶会导致术后复发风险增加。但是不同地区的移植名单准入法规和优先政策可能会阻碍BCLC-0期患者的移植。如果肝移植不可行,首选方法是消融,它与手术切除的存活率相似。出现严重肝功能不全/失代偿的小肝癌患者如果符合标准可考虑进行肝移植。但如果由于非HCC因素不符合肝移植的条件,患者应被归类为BCLC-D期,这部分患者的预期生存率很低。事实上,患者可能因终末期肝病而获得移植优先权,而极早期肝癌的存在不是优先分配的原因。
BCLC A期
定义为单发肿瘤,不考虑大小,或最多3个结节(均≤3 cm)的多灶性HCC,无大血管侵犯、肝外转移或肿瘤相关症状(PS-0)。肝储备功能需要良好且未达到肝移植标准,如果达到肝移植标准则预后不佳,应被归类为BCLC D期。如上所述,肝功能达到肝移植标准的患者应纳入终末期肝病的框架内。这种情况下,如果超出移植登记标准,合并HCC可能成为肝移植的排除标准。如果存在非HCC因素的肝移植禁忌,则没有有效的治疗选择。因此,应将患者分为BCLC D期。BCLC A期患者的治疗方法需依据肿瘤数量和肝功能程度。
单发肿瘤:这些患者的治疗选择需要参考多个指标。首先应根据门脉高压的程度对肝功能进行分层,存在临床意义的门脉高压(CSPH)(clinically significant portal hypertension,定义为肝静脉压力梯度(HVPG)>10 mmHg)的患者术后并发症的发生率较高,长期存活率较低。需要注意,NAFLD(非酒精性脂肪肝)患者HVPG测量的准确性存在争议。没有CSPH的患者,肿瘤负荷和位置允许的情况下建议手术切除,如果术后病理提示高复发风险应考虑移植。高复发风险主要是指微血管侵犯和卫星灶。如果病理检查不存在这些因素,对于≤3 cm的肿瘤,消融治疗与肝切除术的生存率相似,而且由于创伤小及成本较低,可优先考虑消融。但对于>3 cm的肿瘤和特殊部位(例如,靠近胆囊)的肿瘤建议手术切除(见临床决策部分)。—如果患者存在CSPH,手术切除风险较大,肝移植的中长期生存率更高。但有些患者可能不适合肝移植,而且消融对直径大的HCC的疗效也有限。因此,对于存在轻度CSPH的患者,如果HCC位置适合的话,腹腔镜肝切除是一种选择。但到底门脉压力cut off值为多少,目前没有答案,因此我们无法提出可靠的建议。
符合米兰标准的多灶性肝癌(最多3个病灶,均≤ 3cm):肝移植是最佳选择,消融和手术均有高复发风险。如果无法移植,那么手术或消融的治疗效果是否比TACE更好是有争议的。应该进行前瞻性临床研究来证明这部分患者是否应该接受手术或消融治疗,而不是TACE。
BCLC B期
定义为多灶性肝癌(超过BCLC-A期标准),肝储备功能良好,无肿瘤相关症状(PS 0分),无血管浸润或肝外转移。这一分期的肿瘤负荷异质性很强,即使都属于Child-Pugh A级,如果AFP水平不同、肝功能不同,预后也不同。但是,尚无公认的cut off值。患者到底接受肝移植、TACE还是全身治疗应该由每个患者的具体情况决定。2022版BCLC指南根据肿瘤负荷和肝功能情况将BCLC-B期患者分为3组。
第一个亚组是指界限清楚的HCC。这些患者如果符合“肝移植扩展标准”,可以选择肝移植。近年来,有学者提议扩大肝移植的标准,比如扩展肿瘤大小的限制或数量的限制,也可获得类似的生存率,但有人认为这会增加复发率,从而有损长期生存。同样,有报道认为允许患者出现米兰标准(MC)之外有限的无症状进展,与MC内的患者相比,生存率也是类似的,但同样,可能会有稍高的复发率和较低的长期生存。因此,能否接受扩展标准取决于该移植标准扩展以后对生存结果的影响是否最小。AFP水平升高预示肝癌复发的风险更高,生存率降低。多个研究小组确定了自己的AFP限值,超过该限值时,不考虑肝移植。普遍接受的标准为1000ng/ml,超过该数值不建议移植。降期治疗可能导致AFP降低,但AFP降低的幅度和/或持续时间尚无可靠数据。
第二个亚组是无法进行肝移植的患者,但门脉血流良好,肿瘤界限清晰,选择性进入肿瘤供血动脉有可行性。这部分患者建议进行TACE。如果患者既不符合“肝移植扩展标准”,也不符合TACE标准,则应考虑进行系统治疗。
第三个亚组是指弥漫性肝癌,肝脏广泛受累。这些患者的定义没有严格cut off,他们不能从TACE中获益,推荐首选系统治疗。
BCLC C期
这一分期包括合并血管侵犯或肝外扩散的HCC患者,PS≤2分且肝储备功能良好。C期患者应进行全身治疗。如果患者符合临床试验的纳入标准,无论一线、二线还是后线治疗,都是有效选项。
阿替利珠单抗(atezolizumab)与贝伐单抗的联合(Atezo Bev)治疗是目前首选的一线治疗,因为与索拉非尼相比,阿替利珠单抗具有更高的生存效益,但是未与伦伐替尼(lenvatinib)做头对头的比较。从贝伐单抗中获益的患者一般要求肝储备功能良好(肝硬化代偿期,Child-Pugh A级),并且内镜检查中没有高风险出血点,存在食管静脉曲张者应接受适当的诊治,并且没有静脉曲张出血史,以便将出血风险降至最低。其他要求包括不存在血管病变、高血压、严重的自身免疫疾病及准备移植者。来自III期HIMALAYA试验的数据显示,替西木单抗(tremelimumab )联合度伐利尤单抗(durvalumab)与索拉非尼和度伐利尤单抗相比,具有统计学上显著的生存获益因此,这些研究数据可能会影响我们的临床决策。11月20日,COSMIC 132试验的报告显示,卡博替尼(cabozantinib)和阿替利珠联合应用对PFS(无进展生存率)有显著获益处(HR为0.63),但在等待最终生存分析时,与索拉非尼相比,中期数据并未显示出显著的生存获益。
疾病进展或毒副反应(导致治疗中断)后的治疗情况变得越来越复杂。在2020年之前,索拉非尼是唯一有效的一线选择,我们可以根据循证医学进行治疗排序。索拉非尼耐药者二线可选用瑞戈非尼(regorafenib),无论对索拉非尼是否耐药,二线都可以选择卡博替尼;如果AFP>400 ng/dl,无论是否对索拉非尼耐药,还可以选择雷莫芦单抗(ramucirumab)。卡博替尼作为三线治疗也有效。而二线使用帕博丽珠单抗(pembrolizumab ,Keytruda)对比安慰剂的研究中,西方试验没有达到主要终点OS,但在类似人群中进行的亚洲试验中则发现能显著改善生存。
BCLC D期
存在明显的肿瘤相关症状(PS>2),和/或肿瘤负荷大导致肝功能差、或非肿瘤因素导致肝功能差而无法选择肝移植的患者,短期生存率低,属于BCLC D期。晚期肝病患者发生HCC时,如果肿瘤负荷不超过移植标准也可以考虑肝移植。当HCC的治疗不会改变慢性肝病患者的预期生存,这类患者进行肿瘤治疗并不获益。这种情况下主要应该进行对症姑息治疗。
根据BCLC建议,对于BCLC 0/A、B、C和D期HCC患者的预期中位生存期应分别超过5年、2.5年、2年和3个月。
临床治疗决策的制定
2022年BCLC策略包含一个专家临床决策模块(图1)。它强调了医师和多学科肿瘤委员会应将不同的概念和参数整合到个性化的肝癌治疗方法中。
BCLC 0期患者
根据图中的因素,可能需要根据患者特征提出不同的建议。射频(RF)或微波(MW)消融是首选技术,而出于技术或安全考虑时,经皮乙醇注射(PEI)仍然适用于部分的患者。如果由于位置或可用性等原因,消融(经皮或腹腔镜)不可行时,可考虑手术切除,可行性和安全性评估详见BCLC-A部分。无法手术时,TACE是首选选项。经动脉放射性栓塞(TARE)同样有效。立体定向放疗具有抗肿瘤活性,但仍需要进一步的前瞻性研究。虽然RF和MW的安全性和有效性数据均比较充分,但TARE仅用于单个结节≤8厘米的患者。这建议基于Legacy研究的结果,该研究入组单发结节小于8厘米、ChildPugh A和ECOG-PS评分0/1的患者。需要重点强调的是此研究中的中位肿瘤大小为2.6cm(0.9-8.1)。如果患者不适合接受这些局部治疗,则应考虑系统治疗,但患者应该符合相应系统治疗药物的纳入和排除标准。
BCLC A期患者
切除和射频消融对≤2cm的肝癌患者的预期生存率相同。肿瘤>2cm时,完全消融率低,局部复发率高,消融疗效不如切除。微波消融比射频消融的肿瘤坏死区更大,可用于≤4 cm的HCC患者。较大的肿瘤手术切除更加获益,只要影像学检查未发现血管侵犯并且能保留足够的残余肝体积,任何肿瘤大小都不是手术禁忌。通过TARE进行放射性肝叶切除可能会增加残余肝体积,在某些患者中可以考虑应用。肝硬化患者进行大范围肝切除是有风险的,特殊部位的肿瘤手术可能不适合切除,这些患者可以考虑肝移植(肝移植)。但肝移植需要考虑肿瘤大小,此时可考虑是否符合肝移植扩展标准。另外,大肿瘤经常伴有肿瘤相关症状(例如疼痛),这些患者即使切除后也可能预后不佳。
如果肝移植预期等待时间超过6个月,可以考虑进行某些治疗控制肿瘤,以防止肿瘤进展而无法移植。消融、化疗栓塞和TARE是最广泛使用的方法。
腹腔镜/机器人切除术也能做到足够的切缘,而且创伤更小,术后并发症低,即使存在临床显著性门静脉高压(CSPH)的情况下对肝功能的影响也较小。因此,对于某些肿瘤大小可以选择消融的患者,如果肿瘤位于肝脏的外周部位,没有正常肝组织保护,可能会造成孔道种植,或者临近器官损伤,应该考虑手术切除。实际上,存在门静脉高压的情形下,即使非肝脏手术,术后死亡率也会增加,一年生存率也会降低,所以CSPH到底升高多少可以手术尚无定论,手术是可以考虑的。
同BCLC 0期的建议一样,如果患者不适合上述任何一种方法,则可应用治疗分期迁移(TSM)概念,考虑进行TACE治疗,或者符合Legacy入组标准的患者可以考虑TARE。由于这是一项回顾性队列研究,肿瘤的中位大小<3cm,因此,该结论迫切需要其他研究进行验证。如果TARE也不可行,应考虑对患者进行全身治疗。
2022年版的BCLC分期系统不建议符合米兰标准的多结节性肝癌进行手术。虽然手术切除的队列研究报告了令人鼓舞的生存结果,但手术与局部治疗的疗效比较需要前瞻性数据来验证。因此,如果一线治疗方案不可行,TACE是首选方案。但是超过8-10 cm的肿瘤进行TACE的预后较差,可能与肿瘤侵袭或压迫导致的门静脉血流异常有关,而不是与主要肿瘤坏死有关。此外,大肿瘤很少没有症状。如果存在肿瘤相关症状,则应将患者归类为BCLC C期。事实上,有症状的患者(PS1)接受TACE治疗后的存活率明显低于无症状患者。
BCLC B期患者
拟行TACE治疗的患者,要求肝储备功能良好。胆红素升高超过2mg/dL或存在需要利尿治疗的腹水患者,TACE治疗的副反应增加,生存率下降。我们很难通过循证医学来严格定义何时应该TSM(有利于系统治疗),此时专家评估至关重要。目前正在进行的针对BCLC B期比较TACE和全身治疗的临床试验,有详细的纳入和排除标准,可能会得出非常有用的信息,指导临床实践。
TACE可使用碘油乳化化疗,然后用明胶海绵或其他材料栓塞(常规TACE),也可使用药物洗脱微球(DEB-TACE)。第一种会在循环中产生化疗药物峰值,增加毒性和术后疼痛,而DEB-TACE具有良好的药代动力学特征。两种方法的反应率和生存率并没有差异。每个团队都可以有自己的偏好。现有的比较空白栓塞和TACE的临床试验中,入组人群与我们建议接受TACE治疗的人群不匹配,因此无法提供有效信息。而且多数研究入组患者的异质性较大,导致荟萃分析也很难进行。
因任何原因不适合TACE的BCLC-B期患者,建议进行系统治疗。如果无法进行系统治疗,则应考虑参加临床试验。
尽管米兰标准(MC)仍然是肝癌患者选择肝移植最广泛的应用标准,但越来越多的研究表明,超越MC的部分BCLC B期患者,进行肝移植也能获得可接受的结果。很多中心修订了标准旨在扩展MC。但关于肝细胞癌肝移植扩大标准尚未达成共识。目前倾向于采用包括肿瘤生物学行为(研究最多的是AFP)和对新辅助治疗的反应等综合标准,来取代取代传统的形态学标准。普遍接受AFP>1000 ng/mL应视为肝移植的禁忌症。AFP>1000 ng/mL的患者如果对局部治疗有反应(至少降低到500 ng/mL以下),其接受肝移植后与符合MC的患者预后相当。降期治疗已成为选择肝移植患者的可靠方法。降期治疗的目标是降低肿瘤负荷,以便残余肿瘤负荷达到肝移植标准,米兰标准是降期的最常见终点。不同地区纳入降期治疗的肿瘤上限各不相同,这就使得很难定义基线、治疗后分期以及疗效评估等的影像学标准。因此需要开展进一步的研究,来确定如何最好地应用降期治疗。另外,由于供体短缺,仔细确定需要接受移植的患者名单非常重要。也就是说要将有限的捐助实现群体利益最大化,而不是仅仅考虑个体利益。活体捐赠可以解决捐赠短缺的问题,但到底是应该采用与尸体捐赠者相同的移植标准,还是适度将标准扩展仍有争议。同样,不同标准的存活率可能是相当的,但在不同的文化背景下,捐赠者的风险和患者利益之间的平衡并不一致。
BCLC C期患者
与索拉非尼相比,阿替利珠单抗-贝伐单抗可提高生存率,部分患者表现为完全缓解。真实世界数据将揭示因合并症或门脉高压相关出血风险而被排除在IMbrave150临床试验之外的患者比例。替西木单抗联合度伐利尤单抗的数据也优于索拉非尼,因此,一线治疗又增加了一种选择。但仍然有一部分晚期HCC患者不适合这两种方案,仍可考虑使用TKI(索拉非尼或仑伐替尼),这方面我们需要仔细分析患者的临床、放射学和生化指标,选择合适的治疗使得安全性和有效性得到保障。真实世界中可能会拓宽治疗适应症,但我们仍应关注临床试验中定义的临床和生化标准。真实世界的数据可以提供一些信息,但永远不能取代随机试验作为生存获益证据优势。特定人群中可以明确这些应用的安全性,但在没有随机试验的情况下,生存获益只能是推测性的。
阿替利珠-贝伐单抗是首选的一线治疗,而关于替西木单抗联合度伐利尤单抗研究结果将影响一线治疗方案的选择。如果这些方案因任何原因都不可行,则必须考虑到仑伐替尼和单药度伐利尤单抗均不劣于索拉非尼,现在我们需要评估的是现有的二线方案对于一线接受这两种治疗的患者中是否仍然有效。此外,还需要评估索拉非尼、仑伐替尼或度伐利尤单抗是否应被视为“事实上”的二线选择,或者说在阿替利珠-贝伐单抗治疗后是否仍然有效。这方面没有可靠的数据,因此无法进行基于证据的推荐。目前正在进行的几项试验可能会解答一些目前的疑问,也可能会增加一线治疗方案和/或改变现有的治疗顺序。随着新方法有效率的提高,降低肿瘤负荷方面的增强,有些初始因肿瘤负荷过大而放弃的患者可能会因降期而获得潜在根治治疗机会。
肿瘤仅累及肝脏的患者中TARE可能与索拉非尼疗效相似。但在比较TARE、TARE联合及单药索拉非尼的III期试验中,TARE并未体现出优效性,该研究也不是非劣效设计。因此,在获得阳性试验之前,无法提出基于证据的建议。
疾病进展的临床治疗决策制定
传统肿瘤学认为发生肿瘤进展是治疗失败的反映,需要换用二线治疗。实际上,经手术切除、消融或TACE治疗的患者在成功治疗第一个肿瘤后,进展可能仅表现为出现新的肝内病灶。这种情况下,其实这些治疗是可重复的,肿瘤可再次得到控制,并有可能完全缓解。事实上,进展有不同的模式,其预后和治疗也截然不同。这一概念是多年前为接受TACE治疗的患者提出的。初次治疗可能很成功,但在随访期间会出现新的肿瘤。如果只是肝内,患者的肝功能和体力状态没有改变的情况下,可能进行新一轮的TACE。相反,如果进展表现为门静脉侵犯或肝外转移或出现肿瘤相关症状或肝功能明显受损,则不建议继续TACE治疗。这种情况即为出现无法治疗的进展(UTP),可考虑进行全身治疗。因此,这些特定的进展情景意味着不同的预后和不同的治疗建议,与我们常说的“进展”的临床含义不同。面对这些进展的异质性和进展后患者的个体差异,需要MDT讨论来制定最佳治疗方案。
接受系统治疗的患者也需要对进展模式进行分层。前瞻性研究表明,表现为原病灶增大或新发肝内病灶的进展方式预后明显优于表现为新发肝外转移或血管侵犯的进展方式。因此,我们提出了BCLC进展预测模型,如图2所示。患者可以在BCLC B期或BCLC C期开始系统治疗。如果BCLC B期的患者进展后仍在B期的范围内,我们称为为BCLCp-B。BCLC C期的患者如果是原病灶增大或出现新发肝内病灶,称为BCLCp-C1,如果出现新的血管浸润或肝外转移,称为BCLCp-C2。
这种根据进展模式对患者进行分类来预测预后的方法已得到多次验证。虽然进展模式不能预测治疗疗效,但在临床试验的设计和分析中可以应用,因为临床试验中我们需要进行合理的生存假设,从而评估新药对生存的影响。
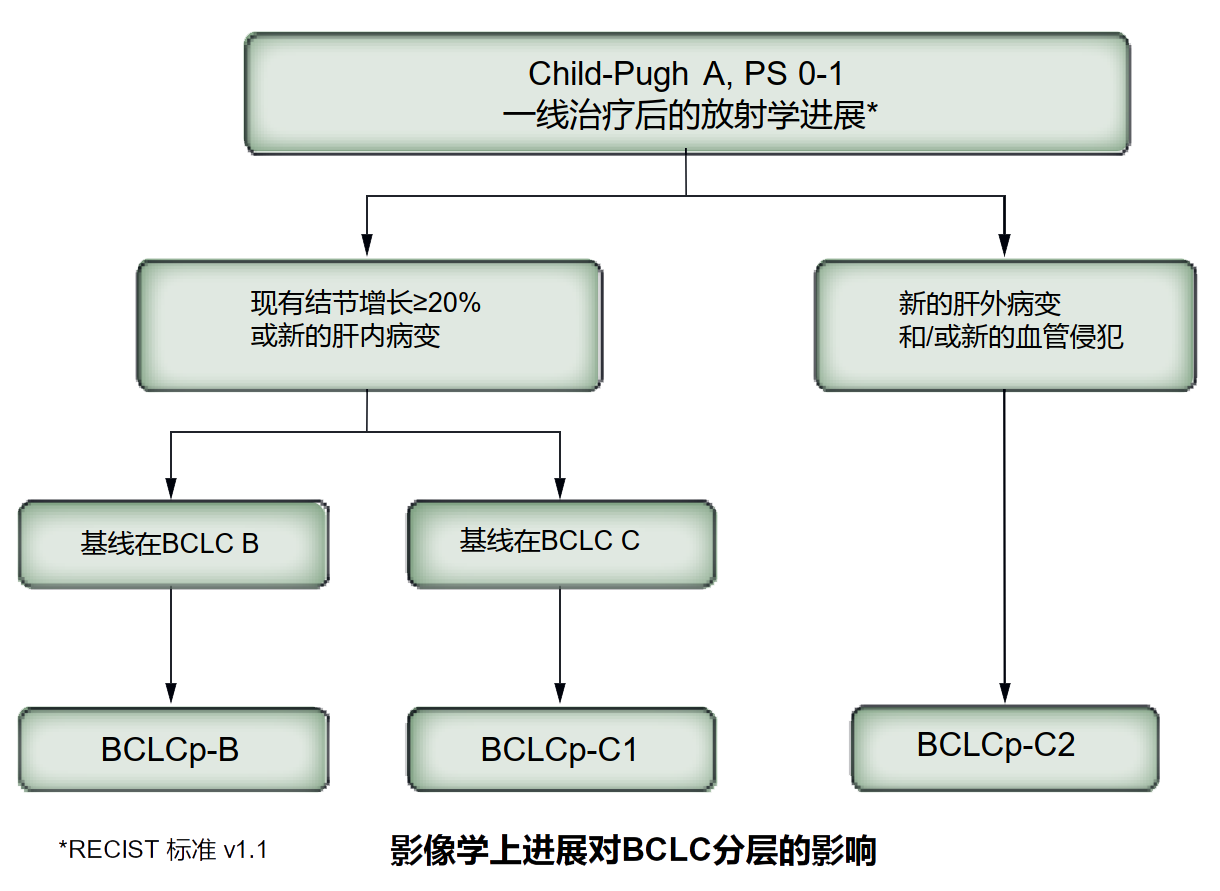
图2
总之,我们更新了BCLC预后和治疗策略。它结合了最新的HCC临床数据,描述了HCC诊断后的三个步骤。第一步是确定初始分期,结合患者的状态对患者进行分层。并与第一次治疗建议相关联。第二步是确定首选治疗方案,应综合考虑患者的各项指标,根据目前的科学数据,提供可达到最佳生存的方案。第三步是“制定临床决策”,与第二步不同,此时需充分考虑到个体层面的复杂性,结合治疗分期迁移和无法治疗进展的概念进行个性化决策。当然,没有哪个指南能为每位患者提供精确指导。我们应对每位患者进行多方面评估,组建MDT并积极参与。为了能帮助MDT提出有效的个体化方案,建立一部明确的初始治疗方案非常关键,其BCLC的定期更新目的也正是如此。
附件:历史各个版本的BCLC分期
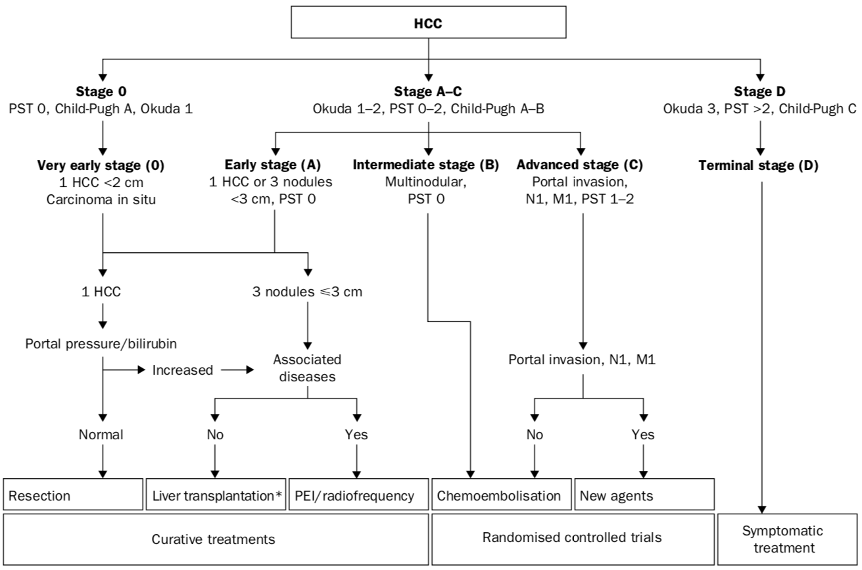
2003版BCLC
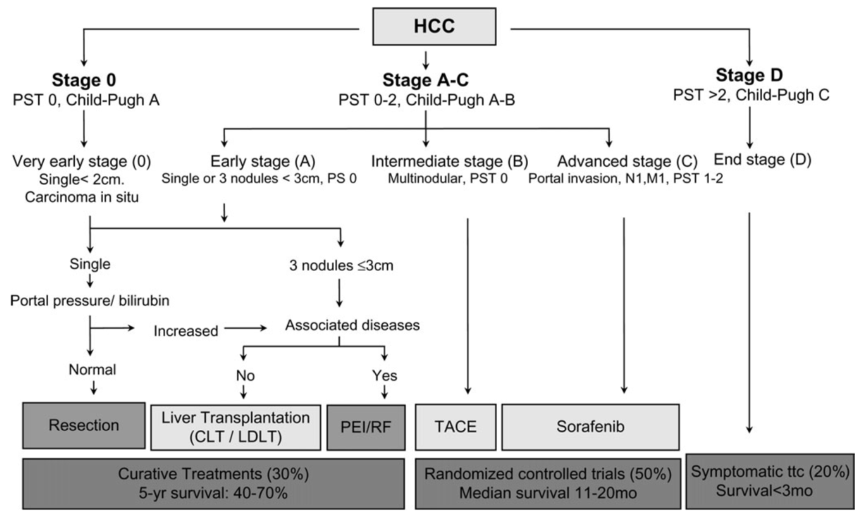
2008版BCLC
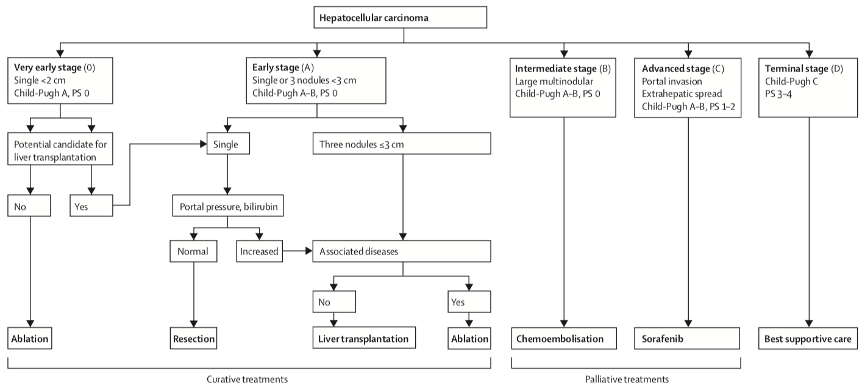
2012版BCLC
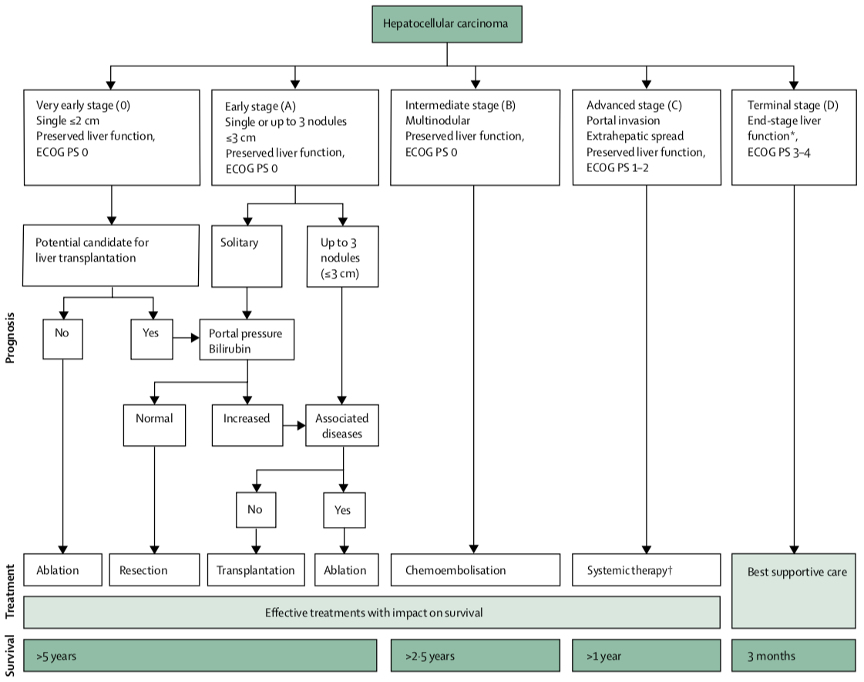
2018版BCLC
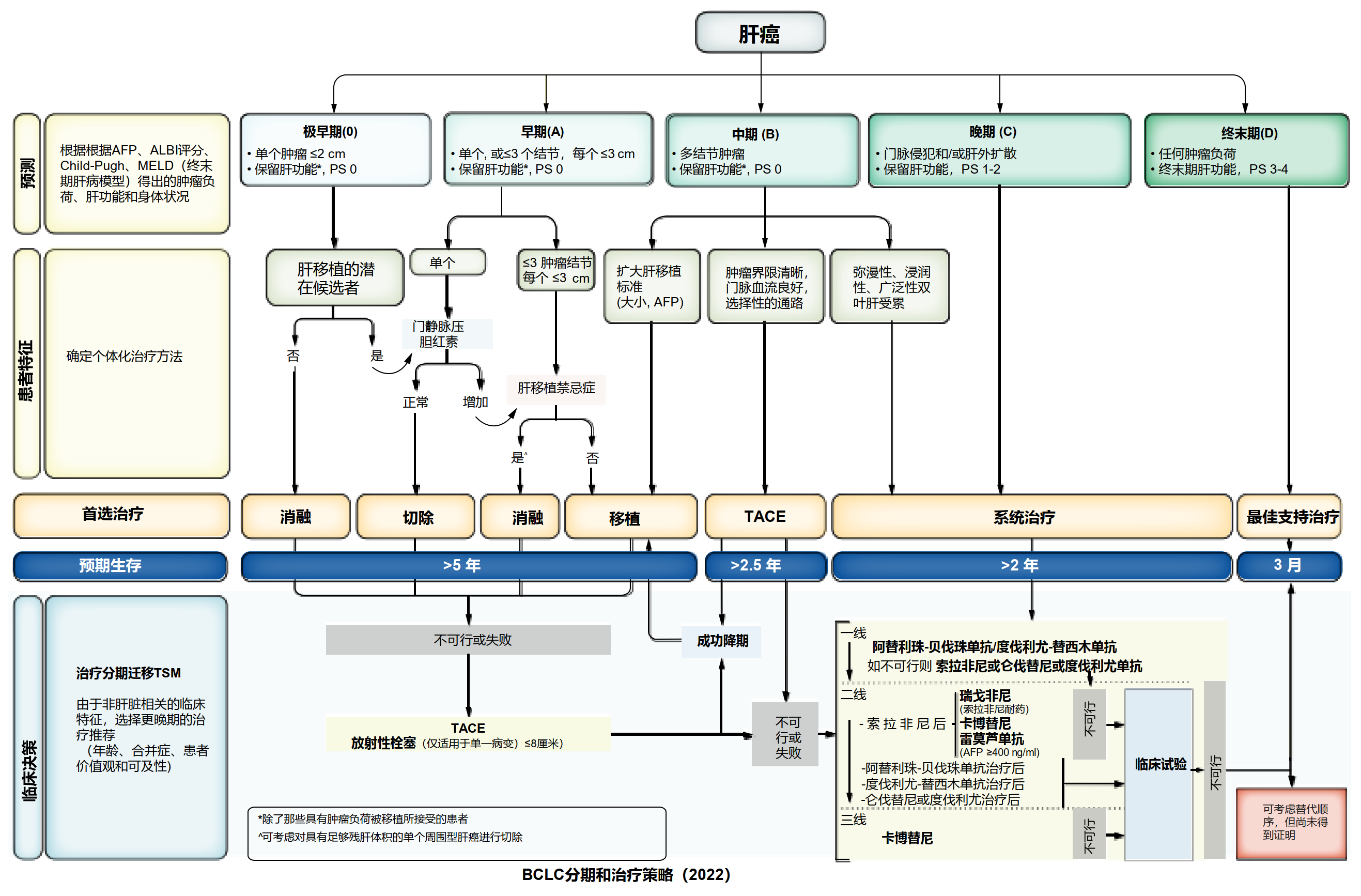
2022BCLC
如为患者需要咨询肝癌相关问题可微信扫描下方我在好大夫网站工作室的二维码:

原文连接:
https://pubmed.ncbi.nlm.nih.gov/34801630/
BCLC strategy for prognosis prediction and treatment recommendation: The 2022 update J Hepatol. 2022 Mar;76(3):681-693.doi: 10.1016/j.jhep.2021.11.018. Epub 2021 Nov 19.
注:部分资料图片来源于网络“原发性肝癌BCLC分期:2022更新”北大肿瘤肝胆外一科刘铭副主任医师的网文 ,特此感谢!
本文是蔡健华版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论