 三甲
三甲
亚肺叶那些事儿(四)——实性肺结节切除范围的共识与争议
文章摘要:本文介绍了两项国际试验证据支持下,对于实性肺结节的早癌人群,能否改变肺叶切除为标准的外科实践,能否以亚肺叶替代标准的肺叶切除。
CT影像表现为周围型实性肺结节的肺癌,若最大径 ≤ 2cm,各项检查排除了转移,临床分期属于T1N0M0,IA期,可以看作实性肺结节分期最早的一组人群,病理往往是浸润癌,手术方式选择标准的肺叶切除还是缩小范围的亚肺叶(肺段或楔形)一直存在争议,目前两项重磅研究结果出炉,试验得出的新证据均支持对这类肺结节采用亚肺叶切除。本期内容将试图回答:在两项国际试验证据的支持下,对于实性肺结节的早癌人群,能否改变肺叶切除为标准的外科实践?能否以亚肺叶替代标准的肺叶切除?
一、两项研究纵览:两项研究的目的相同,都是比较肺叶和亚肺叶切除治疗早期外周型实性肺癌的手术疗效,上期科普中我们简要复习了JCOG0802研究(以下简称日本研究),研究公布后,学术界对其颠覆性的结论更多保持了理性思考;无独有偶,2022年另一项国际研究落地,研究结果发表在国际一流期刊《新英格兰医学杂志》上,这就是欧美共83个医疗机构参与的多中心随机对照试验——CALGB 140503(简称美国研究)。
两项研究均采用了严谨的试验设计,术后有足够长的随访期,80%以上的患者采用微创胸腔镜技术,符合目前的主流外科实践规范;试验数据均显示对周围型小肺癌(≤2cm),亚肺叶的手术相关不良事件可控,生存率方面,亚肺叶切除并不劣于肺叶切除。
二、两项试验的不同之处:
1:入组人群和病灶特征不同:日本研究入组患者绝大部分为腺癌,45%的磨玻璃癌(含磨玻璃成份比例<50%)。美国研究中腺癌以外的病理达40%,包括鳞癌(14.1%)和其他非小细胞癌(大细胞、神经内分泌等,一般预后很差),同时患者绝大多数为实性癌。因此,两项研究也反应了东西方人群特征和肺癌疾病谱的差异。
2:入排程序和淋巴结处理方式不同:美国研究规定必须通过术前微创技术的纵隔分期或术中冰冻病理证实纵隔、肺门淋巴结阴性(可采样),方可随机化入组,这也是美国研究的亮点所在,通过强化淋巴结分期质控,尽可能保证入组的患者属于真正的病理IA期;日本研究更强调术式为解剖性肺段切除,但淋巴结清扫在方案执行中,各中心所持标准不同,超过一半的患者采用了选择性淋巴结清扫,可能与入组了较多磨玻璃肺癌有关。同时,日本研究中术后病理出现了较高比例的分期上移(upstage),比如从IA期跃迁为II期甚至III期(见图1),术后约10%的患者需要接受辅助治疗(化疗)。
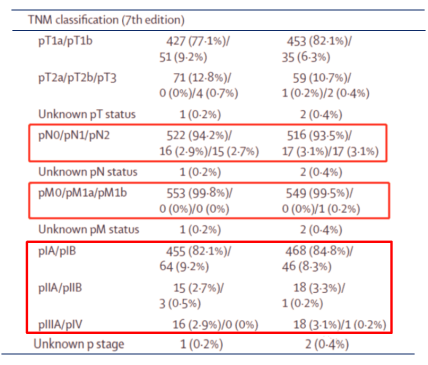
图1,日本研究中存在较高比例的分期上移
3:针对原发灶的手术方式:美国研究并不强调肺段技术,实际执行中楔形切除占比甚至高达60%左右,不过美国研究对应的生存结果出乎意料,即便是病理高侵袭性的腺癌,鳞癌和较少比例的其他病理型,亚肺叶切除术后患者局部复发率与对照组肺叶相比,并没有增高!反而是强调解剖性肺段技术的日本研究,肺段组的局部复发率几乎是肺叶组的一倍(10.5% vs 5.4%)!
两项研究复发率差异的原因可能来自术前对切缘的规划,以及术中对切缘的控制。美国研究告诉我们,如果控制好切缘和淋巴结,楔形也能打!
4:患者的生存与转归不同:除了复发率,两项研究中各自对应的患者总体生存率也不同,其中日本研究总体患者的5年生存率超过90%,远处转移的发生率仅约5%。而美国研究中5年生存率徘徊在80%左右,局部区域复发和远处脏器转移分别是13.8%和16.0%,明显差于日本研究!但实质上,美国研究的生存和复发结果却与当前国内外早期肺癌的外科治疗大数据相吻合! 必须强调,两项研究术后疗效的差异并不是源于技术水平的高低,而是前文提到的东西方入组人群的差异和肿瘤恶性程度的不同。美国研究纳入的纯实性癌其恶性程度高于磨玻璃肺癌。
那么,日本研究肺段组高复发的劣势为什么没有影响最后的生存结果?舍弃前几期科普采用的RFS和OS等晦涩的术语,我们用常见的竞技比赛规则去理解,日本的“肺段队”经历了一负(复发率败给“肺叶队”)、一胜(“肺叶队”出现了高比例的非肿瘤原因的死亡,比如死于心脑血管病和其他的原发癌),两轮角逐之后,最终比赛结果:肺段:肺叶,1:1踢平,甚至“肺段队”还有轻微的优势,因为局部复发可以通过二次手术等方式补救,使患者再次获得根治机会。美国研究则不同,亚肺叶和肺叶两队均发挥稳定,复发率和术后转归均以平局收场,最终双方0:0握手言和,肺叶和亚肺叶任何一方都没有优势可言。
尽管两项试验设计存在上述诸多不同,但并没有出现“针尖对麦芒”的对立,反而是相互补充,进一步印证和支持以下结论:对于早期实性肺癌(IA期,≤2cm)患者,解剖性肺段或楔形切除是值得推荐的。
三、研究细节探索:临床实践中,两项研究结果和试验中的诸多细节仍值得进一步探索:
1.早期实性肺癌不能放松淋巴结清扫,美国研究通过术中淋巴结冰冻质控是值得学习的,结合相关文献,至少淋巴结术中冰冻应包含多站点,在实际临床价值上,增加淋巴结采样或切除的站数可能大于个数。
2.高危病理亚型,或腺癌以外的类型,比如鳞癌和其他类型癌,亚肺叶是否可行?虽然美国研究中腺癌以外亚型的亚组分析结果并没有发现亚肺叶的劣势,但在日本研究中我们看到,Noguchi F型一旦经术中快速病理报告证实,需要升级肺叶切除。两项研究启动时间均在10年以前,当时WHO国际肺腺癌新分类标准没有出炉,并未涉及高危病理亚型的概念。当然,如果能根据新病理分型标准对两项研究的数据重新提取分析,也许能够回答这个问题。
3.对于直径1.0~2.0cm的亚组,亚肺叶疗效如何也无法通过两项试验回答,至少在美国研究中,随着直径增大,1.5cm-2.0cm亚组选择亚肺叶切除的复发和死亡风险有所增加(HR=1.24,90%CI 0.92-1.67)。这也可以解释为什么第八版TNM分期(国际肺癌研究学会)会区分出T1a(<1cm)和T1b(1-2cm),两者对应的IA1和IA2期生存率是不同的,由此推测,直径1cm以下的实性癌选择亚肺叶更安全,直径1.5cm以上的实性癌还是应该推荐肺叶切除。
4.亚肺叶的切缘问题不容忽视,两项研究均强调病理验证的切缘阴性,对切缘最基本的评估流程,术中肉眼-术中冰冻-术后病理,依次递进和验证,不能以手术肉眼或触摸的判断代替病理验证,我们强调在术前做好规划,就像盖房子之前选块好地,画好图纸才能动工,术前CT三维重建有助于病灶切除范围的规划与结节定位(强调充足切缘),术中切缘的精确切割,加上术中淋巴结清扫的质控,有助于亚肺叶术后局部复发的控制。
基于上述四点分析,同时结合个人体会,外周型小肺癌的手术方式,选择亚肺叶切除还需要避开以下情形:高危病理分型、位置靠近肺门,直径大于1.5cm,切缘不能保证,还有一些其他试验未涉及或未能回答的细节比如合并基因突变或高表达的PD-L1(属于肿瘤发病的分子特征,多数是通过手术标本检测判断,也就是在手术后才能得到的信息),具备这些特征的患者肺叶切除是更合理的选择。
文章最后,我们回答本系列之初的问题,“亚肺叶是新瓶装旧酒,还是时代新潮流?”,对于经过筛选的早期实性肺癌,通过术前规划、术中冰冻病理以及淋巴结清扫的质控,亚肺叶切除是安全可行的新术式标准,将可能成为未来周围型小肺癌的主流术式。亚肺叶切除不仅为发病率越来越高的多原发肺结节的外科治疗提供余地,同时也为高龄、合并基础病等特殊群体提供更广泛的治疗空间,这在当下疫情常态化的背景下更值得推荐。
本文是郭洪波版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论