
2022年糖尿病分型诊断中国专家共识
糖尿病作为整体并非单一病因的疾病,是一组由遗传、环境、行为等多因素复杂作用所致,包含多种病因和病理的、高度异质性的临床综合征群体。
目前糖尿病患病率持续增高,患者人数巨大,但能被明确病因分型的仅占少数。
基于此,中国医师协会内分泌代谢科医师分会、国家代谢性疾病临床医学研究中心(长沙)组织专家多次讨论,基于我国的临床实践,结合国内外最新指南和专家意见,形成了《糖尿病分型诊断中国专家共识》,旨在探索及规范糖尿病分型诊断流程,早期识别病因明确的糖尿病个体,推进实现精准治疗。
糖尿病有哪几型?
根据病因,糖尿病分为6种类型:
1型糖尿病(T1DM)
单基因糖尿病
继发性糖尿病
妊娠期糖尿病(GDM)
未定型糖尿病
2型糖尿病(T2DM)
糖尿病的分型诊断依据有哪些?
一、详细的病史采集以及体格检查
收集患者的起病年龄、起病特点、特殊用药史、既往史、家族史以及合并其他器官系统的症状与体征等信息。
体征主要包括患者面容、体型、皮肤表现、脂肪分布、性腺发育及视力、听力等。
(上述内容对糖尿病的分型诊断具有重要的提示价值,临床医师应详细询问并综合分析)

二、辅助检查
(一)胰岛β细胞功能
血清 C 肽是临床评价胰岛 β 细胞功能的主要指标,为区分糖尿病类型的重要参考。在临床工作中,可用空腹C肽和随机C肽代替。
刺激后C肽<200 pmol/L 提示胰岛功能较差;
刺激后C肽<600 pmol/L 提示胰岛功能受损,应警惕T1DM或影响胰岛发育及分泌的单基因糖尿病可能;
刺激后C肽≥600 pmol/L提示胰岛功能尚可,诊断T2DM可能性大。
采用C肽评估胰岛功能需注意:
1.血糖水平对C肽有较大影响,一般应将血糖控制在5~10 mmol/L进行C肽检测;过低或过高血糖均会抑制内源性胰岛素分泌,导致C肽测值偏低而低估患者胰岛功能。
2.C肽≥600 pmol/L或<80 pmol/L时结果重复性较好,作为分型诊断的可靠性较高。
3.C肽水平可随病程进展变化,应注意随访,勿按单次C肽结果对胰岛功能下定论,必要时可重复检测。
(二)胰岛自身抗体
胰岛自身抗体是反映胰岛β细胞遭受自身免疫攻击的关键指标。常见的胰岛自身抗体包括谷氨酸脱羧酶抗体(GADA)、胰岛素自身抗体(IAA)、胰岛细胞抗原2抗体(IA-2A)和锌转运体8抗体(ZnT8A),多用于诊断自身免疫性T1DM。在已知胰岛自身抗体中,GADA敏感性最高,建议将其作为糖尿病免疫分型诊断的首选指标。
推荐有条件的医疗单位应对所有糖尿病患者筛查GADA。对于条件有限者,至少应在疑诊T1DM患者中筛查抗体。若GADA阴性,应加测IA-2A和ZnT8A;如3个常见胰岛自身抗体均阴性,而临床表型仍疑似T1DM,有条件者可行胰岛抗原特异性T细胞检测及人类白细胞抗原(HLA)易感基因检测辅助分型。
胰岛自身抗体种类及检测方法繁多,常见的胰岛自身抗体检测方法见下表。
(三)基因检测
遗传因素在糖尿病发病中起着重要作用。T1DM和T2DM均为多基因遗传糖尿病。研究发现,T1DM的遗传度(遗传因素在疾病发生中所起作用的程度)为74%,而T2DM则为44%。
迄今已鉴定出60余个T1DM易感基因位点,其中HLA-Ⅱ类基因是主效基因,对疑诊T1DM且胰岛自身抗体阴性患者,有条件的医疗机构可进行HLA易感基因分型以帮助诊断。单基因糖尿病是由单一基因突变所致胰岛β细胞功能障碍或胰岛素作用缺陷而引起,建议对疑诊单基因糖尿病者进行一代测序和二代测序的基因检测。一代测序是测序的金标准,亦称Sanger测序,二代测序技术(NGS)能对几十万到几百万条DNA分子并行序列测定,目前 NGS 已广泛应用于各种遗传病检测。
常用基因检测技术的比较见下表。

(注:基因检测结果阴性,可基本排除已知致病基因突变的可能性;但大量未知致病基因的存在及疾病的外显率不全是正确分型的挑战,建议对疑诊患者定期随访,条件允许应开展家系验证和功能试验,为诊断分型积累证据。)
(四)其他指标
1.血清胰岛素:血清胰岛素的空腹水平升高可以反映胰岛素抵抗;结合病史、症状体征及血糖水平有助于胰岛素抵抗程度的判定。
2.糖化血红蛋白(HbA1c):是评估血糖控制的金标准。对糖尿病分型的价值主要用于暴发性T1DM的识别。发病时HbA1c<8.7%是暴发性T1DM的必备诊断条件之一。值得注意的是,HbA1c检测需在采用标准化检测方法且有严格质量控制的医疗机构进行。
3.其他相关指标:血、尿淀粉酶有助于胰源性糖尿病的鉴别;低水平超敏C反应蛋白注意HNF1A-青少年发病的成人型糖尿病(MODY);乳酸检测有助于线粒体糖尿病的鉴别;抗核抗体等其他自身抗体检测有助于B型胰岛素抵抗的鉴别;眼底检查、电测听、声阻抗、肌电图检测,对Wolfram综合征、线粒体糖尿病、神经系统遗传病等继发性糖尿病有重要提示作用;需结合病史和体格检查进行相应的检测。
糖尿病分型具体诊断流程

一、明确是否为NDM、GDM、暴发性T1DM和继发性糖尿病
通过采集病史(起病年龄、用药情况、既往史、提示性临床特征等)、体格检查、基本检验(血糖、HbA1c及C肽)等,可明确糖尿病的分型。
(1)根据患者的起病年龄、妊娠情况和血糖值,基本可明确NDM和GDM。
(2)根据患者突发高血糖,起病伴酮症或酮症酸中毒,结合实验室检查(血糖、HbA1c、C肽),符合暴发性T1DM标准者可明确诊断。
(3)根据特殊用药史、已知原发基础疾病所致糖尿病或免疫综合征,伴遗传综合征等,需考虑为继发性糖尿病。
二、明确是否为自身免疫性T1DM
对于临床疑诊 T1DM,有如下表现之一者应先根据GADA检测结果判断分型:
(1)起病年龄<20岁;
(2)以酮症或酮症酸中毒起病;
(3)起病时“三多一少”症状明显;
(4)起病前体型非肥胖;
(5)病程1年内刺激后C肽<600pmol/L;
(6)需要胰岛素治疗>6个月。如GADA阳性,可诊断为自身免疫性T1DM;如GADA阴性,应加测IA-2A和ZnT8A以提高诊断率;若IA-2A和(或)ZnT8A阳性,可诊断为自身免疫性T1DM。
对于胰岛抗体阳性的自身免疫性 T1DM患者:
(1)起病后一直依赖胰岛素治疗可判定为经典性T1DM亚型;
(2)起病年龄≥18岁、起病半年内不依赖胰岛素治疗者判定为LADA亚型;
(3)<18岁起病的青少年,起病半年内不依赖胰岛素治疗者则判定为LADY亚型。
三、明确是否为特发性T1DM
对于3个胰岛自身抗体均阴性、临床上仍高度疑诊T1DM患者,可考虑特发性T1DM的诊断。
对于起病<20岁+胰岛自身抗体阴性者,或起病在20~30岁+胰岛自身抗体阴性+起病时非肥胖者,应开展基因检测,以排查单基因糖尿病。如基因检测阴性,且随访中C肽处于较低水平或C肽快速下降,则考虑诊断为特发性T1DM。
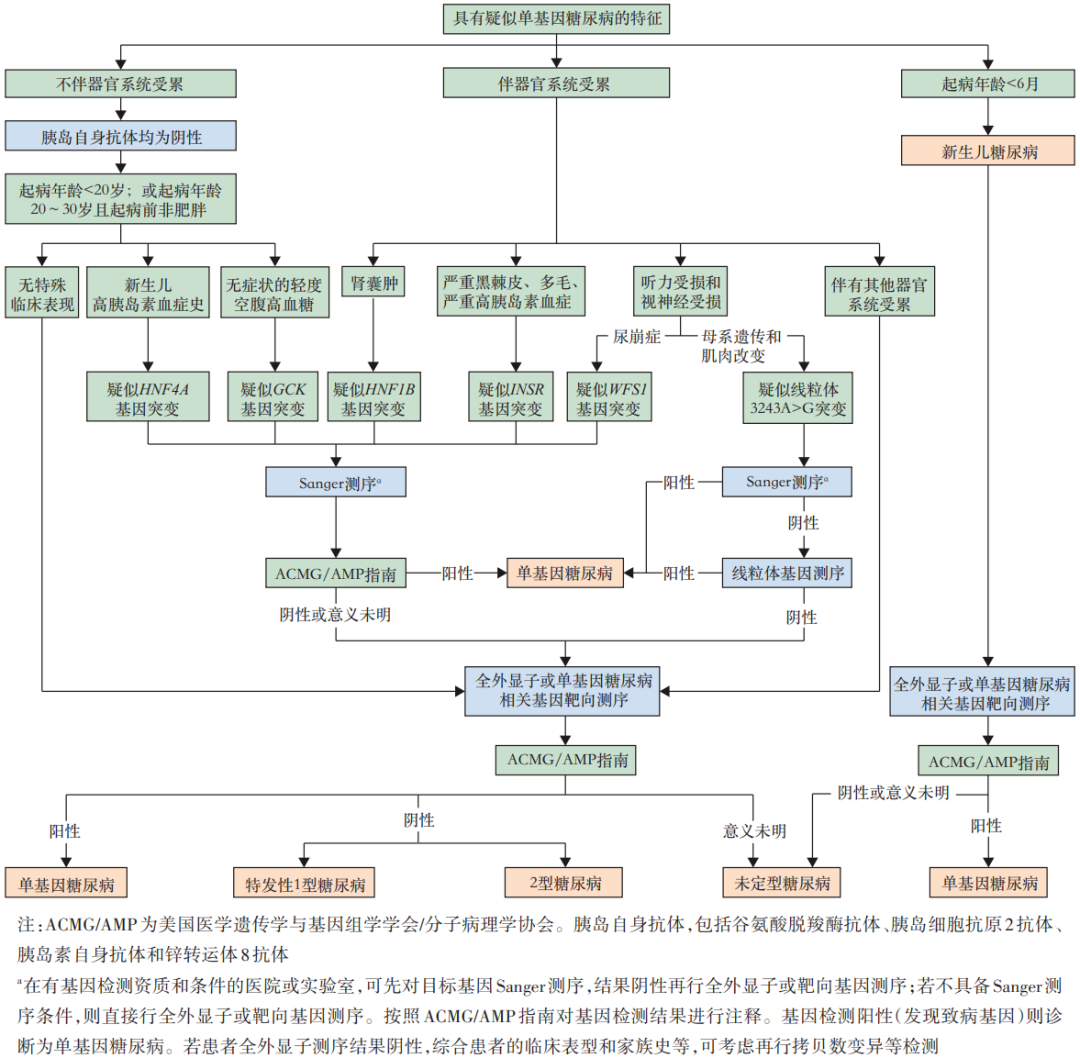
四、明确是否为单基因糖尿病
单基因糖尿病种类繁多,迄今已知70余个基因与单基因糖尿病发生有关。在临床实践中,应结合各个单基因糖尿病的临床征象和发病机制,针对性开展相关基因检测,以排查单基因糖尿病。
建议对具有以下特征之一者进行基因筛查:
(1)6月龄前发病;
(2)起病<20 岁+胰岛自身抗体阴性;
(3)起病在20~30岁+胰岛自身抗体阴性+非肥胖;
(4)持续轻度升高的空腹血糖和HbA1c;
(5)新生儿期有高胰岛素性低血糖症;
(6)母系遗传,伴听力受损、视神经萎缩或骨骼肌表现等;
(7)与肥胖程度不符合的显著黑棘皮表现,有严重胰岛素抵抗;
(8)合并先天性心脏病、胃肠道缺陷、脑畸形、视力听力异常、智力发育迟缓、生长发育障碍、严重腹泻、肾发育异常或其他自身免疫病等可疑与基因突变相关者。
基因检测明确存在突变且有致病性时,可诊断为单基因糖尿病;如果为意义不明的突变则诊断为未定型糖尿病。对于基因检测阴性者,需要持续随访胰岛自身抗体和C肽变化,根据具体情况分型:若患者C肽水平低,长期依赖胰岛素治疗,可诊断为特发性T1DM;否则诊断为T2DM。
单基因糖尿病筛查流程见下图。
糖尿病的病因分型诊断是精准治疗的前提。随着科学技术进步及临床医学水平持续提高,从病因认识角度前瞻,糖尿病的分型可预期将超越现有的分型模式,提供给临床医师更精细的分型策略、更便捷的分型诊断工具。
原文下载链接:
2022《糖尿病分型诊断中国专家共识》
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论