胶质瘤中常用的分子病理指标及意义
胶质瘤中常用的分子病理指标及意义

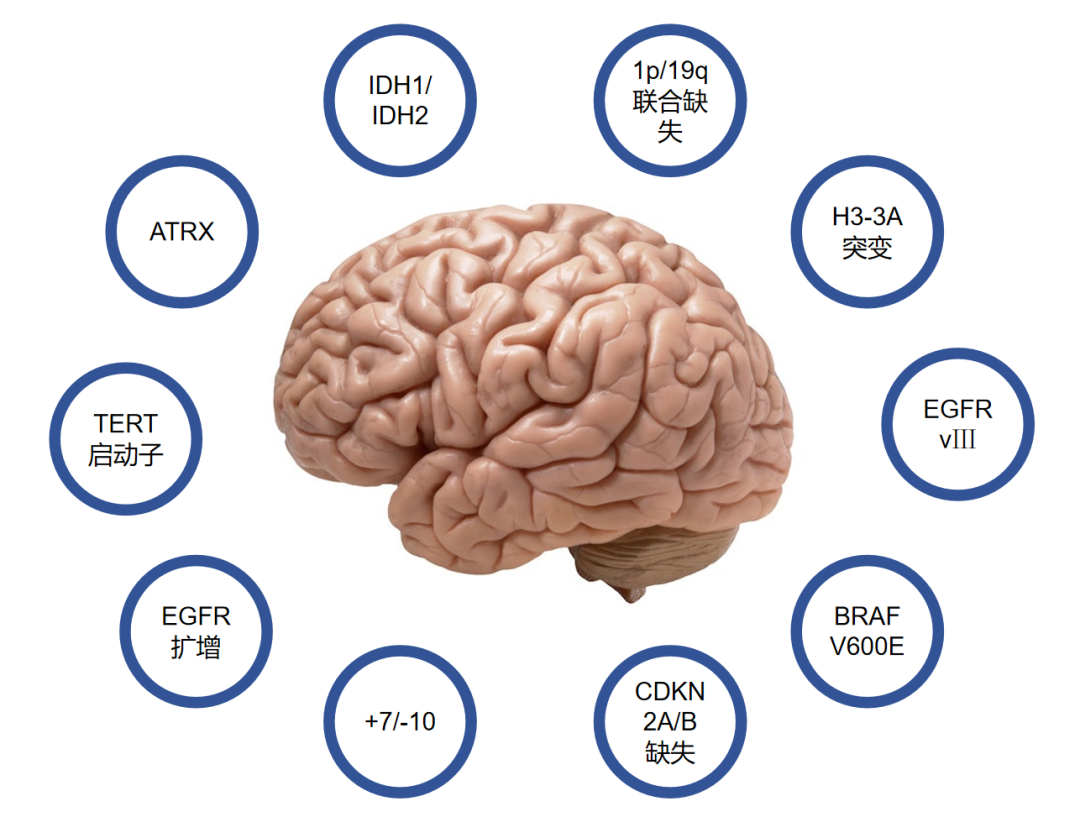
脑胶质瘤分子分型常用分子标记物

胶质母细胞瘤甲基化分型的临床及基因学特征:

胶质母细胞瘤甲基化分型的临床及基因学特征
(一)染色体杂合性缺失检测
1994年 Reifenberger 等发现染色体1p/19q杂合性缺失(loss of heterozygosity,LOH)是少枝胶质细胞肿瘤相对特异的分子遗传学改变。研究显示,超过90%少枝胶质细胞瘤发生1p/19q联合性缺失,相比较而言,间变少枝胶质细胞瘤发生1p/19q联合性缺失的几率约为50%~70%,另外,混合性少枝-星形细胞瘤发生1p/19q联合性缺失的几率约为50%,且这类肿瘤少伴有I7pLOH及TP53基因变异。伴有1p/19q联合性缺失的少枝胶质细胞肿瘤常发生于非颞叶,颞叶的少枝胶质细胞肿瘤1p/19q多是完整的。19号染色体长臂(19q)杂合性缺失,其常见缺失区位于19g13.3;1号染色体短臂(1p)杂合性缺失,其常见缺失区多数位于1036.3附近。研究表明少枝胶质细胞肿瘤在形成过程中1p上不止一个肿瘤抑制基因受累,但已确定与之相关的抑癌基因并不多,有研究提示1号染色体短臂上的TP73及CDKN2等基因的突变可能参与了少枝胶质细胞肿瘤的发生。间变型少枝胶质细胞瘤除了会有1p和19q的杂合性缺失外,还会发生9号染色体短臂和10号染色体的杂合性缺失,其中9号染色体上的CDKN2A基因缺失率达到33%~42%,10号染色体的基因缺失也有19%~25%。还有些间变少枝胶质细胞瘤会出现7号染色体的扩增,这点类似于星形细胞瘤,被认为是间变少枝胶质细胞瘤的一个亚群,预后较伴有1p和19q缺失的亚群差。1p/19q杂合性缺失在其他类型胶质瘤,特别是星形细胞瘤却不多见。在1p/19g染色体杂合性缺失的病人中,患少枝胶质细胞肿瘤的病人数量分别是患星形细胞瘤和胶质母细胞瘤病人的10倍和4倍。
1998年Caimeross等首次报道伴有1p杂合性缺失的少突胶质细胞瘤对化疗敏感,染色体19q杂合性缺失对化疗不敏感,而二者同时缺失时化疗敏感。1p/19q杂合性缺失与化疗的敏感性和患者较长的生存时间密切相关,是一项独立的具有显著意义的预后影响因子,即使在复发的胶质瘤中,发生缺失的患者也具有相对好的预后。1p/19q杂合性缺失逐渐成为间变性少枝胶质细胞瘤新的分级标准,存在1p/19g杂合性缺失的病例100%对PCV[丙卡巴肼( procarbazine),洛莫司汀(CCNU),长春新碱(vineristine)]化疗敏感,平均生存期为10年,而无此种遗传学改变的病例平均生存期仅为2年。这部分患者理论上应强调早期、足程化疗,放疗可考虑推迟到肿瘤进展时进行。仅存在1p杂合性缺失或1p、19q均无缺失的间变少枝胶质细胞肿瘤患者,在伴有其他癌基因扩增或抑癌基因突变时,需积极进行放、化疗。
(二)肿瘤细胞增殖状态的检测
肿瘤细胞增殖状态是确定肿瘤分类、分级、预后与治疗方案的重要参考指标,增殖指数(Proliferaton indicesP)可以通过核抗原的免疫组化检测确定。
1.Ki-67 Ki-67是一种细胞增殖核抗原,也是目前较为肯定的核增殖标志物,属非组蛋白,近核仁区。开始表达于细胞周期的G1期,在S期及G2期表达逐渐增加,至M期达高峰,在分裂晚期很快消失,G0期无表达。人类Ki-67基因定位于第10号染色体,半衰期,短脱离细胞周期后迅速降解。
多数文献支持Ki-67与胶质瘤的预后有密切关系。McKeever研究了50例Ⅱ级星形细胞瘤发现,发现高 MIB-1 LI提示短的生存期。Fisher认为Ki-67水平≥10%是预后差的一个有力提示。Pollack发现98例儿童高级别胶质瘤预后与MIB-1标记有强的关联,多变量回归分析模型肯定了MIB-1 LI和预后之间存在强的独立关联,不考虑病理类型,MIB-1 LI表达高于36%的患者预后均很差,MIB-1 LI能使基于组织学的预后评价更加准确。Ralte的研究结果提示MIB-1 LI与星形细胞瘤复发间期之间呈负相关。临床上可依据Ki-67增值指数决定是否应用化疗药物,并使用针对 M期敏感的化疗药物长春新碱。
2.PCNA PCNA又称为周期素(cyclin),是DNA 聚合酶的辅助蛋白,其合成水平与细胞增殖率和 DNA合成直接相关。PCNA在细胞核中的水平从G1期开始上升,先于DNA合成开始,在S期达到高峰,在G2期开始下降,在M期和静止期维持最低水平,是反映细胞增殖的有用指标。
多形性胶质母细胞瘤、间变星形细胞瘤、低级别星形细胞瘤的PCNA染色程度与组织学诊断有关。多种肿瘤研究显示Ki-67及PCNA的表达与肿瘤的分期、预后有关。PCNA的阳性程度高,提示处子S期,G1晚期及G1期的细胞多,以上三期均属放射不敏感期,但肿周期特导性药物VM-26对S期肿细胞特异性敏感。
(三)胶质源性细胞成分检测
应用免疫组化技术进行特殊染色,可特导性地标记胶质瘤细胞内的某一成分,从而明确肿瘤细胞的组织来源。这归功于敏感且特导性强的抗原提纯和抗体制备技术的进步。最值得一提的是胶质纤维酸性蛋白(CFAP)抗体,它能特异性标记星形细胞,使得星形细胞瘤的诊断和鉴别诊断得到了很大程度地提高,其中“多形性黄色星形细胞瘤”的发现就是最好的范例。20世纪70年代初,Kepes发现了一组多形性瘤细胞,混有梭形细胞,并有典型的编织样或车辐状排列,同时有胞浆泡沫样的肿瘤细胞和瘤巨细胞,肿瘤组织富含网状纤维,散在淋巴细胞。这些特点与身体其他部位的纤维组织细胞瘤很相似,Kepes将其称为“脑内纤维组织细胞瘤”。几年后,Kepes用GFAP标记了这些肿瘤,结果发现那些胞浆泡沫样的所谓“组织细胞”明确表达 GFAP,说明它们的本质是是形细胞。因此,在1993年第2版的《神经系统肿瘤组织学分类》中增加了“多形性黄色星形细胞瘤“这一新的胶质瘤组织类型。
(四)癌基因、抑癌基因检测
1.p53 p53基因全长约20kb,定位于人类17号染色体的短臂上,编码一个53kD的核内磷酸化蛋白,与细胞周期的调控、DNA修复、细胞分化及凋亡等重要生物学功能有关。野生型p53基因是抑癌基因,但当p53在高度保守区发生变异,不仅失去抑癌基因的功能,而且其蛋白产物是一种致瘤因子。在人类各种类型肿瘤中,p53变异可表现为多种形式,如等位基因丢失、点突变、插入突变、移码突变,基因重排等。p53基因变化的结果可引起人类肿瘤形成。p53基因的功能主要是保持基因组的稳定性,特别是当人类基因组受到致癌基因放射线损伤时,p53基因具有修复、稳定基因组的功能,这时p53基因激活,可以使细胞循环周期发生抑制或使细胞发生凋亡。反之,当p53基因传导路径受到抑制或干扰,细胞就可发生异常分裂增殖。
p53基因突变可发生在不同级别胶质瘤中,如从低级别的星形细胞瘤,到间变胶质细胞瘤,再到多形性胶质母细胞瘤,这一结果说明p53基因突变是胶质瘤发生、发展中的早期事件。而继发性多形性胶质母细胞瘤,是由于突变的p53基因随着癌细胞的扩增而不断累积使肿瘤细胞发生选择性生长优势的结果。p53基因突变在胶质瘤复发中也起到关键作用。这些结果说明:一个有意义的单基因突变在复杂表现型完全出现之前,常常有一个延迟的时间间隔。在此期间,复杂表现型的完全出现常常需要其他突变的积累。
胶质瘤中p53基因突变常常伴有17p染色体杂合子丢失。p53突变多发生在高度保守的密码子区,如175(7.5%),248(17.5%),273(7.5%)等不同区域。p53基因突变在星形细胞瘤中的转换型为:G-A,38%;C-T,18%;G-A,18%。目前临床上检测的p53多是突变型,多发生于18~45 岁年龄段。肿瘤标本伴有p53 突变且年龄大于45 岁的胶质瘤患者预后差,患者对放射治疗及化学治疗均有抵抗。
2.PTEN
PTEN是抑癌基因,PTEN与tensin同源,位于10q23.3。PTEN基因包括9个外显子和8个内含子,其mRNA长度为5.5kb。第5外显子是最重要的编码功能域,其编码122-123位氨基酸,这个功能域具有双重特异磷酸酶功能。除了能作用于磷酸酪氨酸和磷酸丝/苏氨酸,使其去磷酸化,并且也有磷酸肌醇-3-磷酸脂酶的活性。PTEN通过抑制1-磷酸酰肌醇-3-激酶(PI3K)的产物,磷酸酰肌醇3,4,5-三磷酸(PIP3)磷酸化,在1-磷酸酰肌醇-3激酶信号传导通路中起负性调节作用。其结果是抑制蛋白激酶B(Akt或PKB)激活引起的细胞存活和细胞增殖。PTEN还可通过直接的去磷酸化和抑制局部黏附激酶(FAK),负性调节局部因子,调节细胞的迁移和侵蚀。
PTEN变异广泛存在于各种肿瘤中,变异的主要形式有10号染色体短臂位点的纯合性缺失和杂合性缺失,基因编码区和拼接区的点突变。PTEN在肿瘤中的错义突变主要集中在与tensin 高度同源的5’端,第一个高突变区在PTP催化活性中心附近,第二个位于所共有的a-螺旋附近,α-螺旋与硫基磷酸键水解有关,可协助恢复酶活性开始第二轮催化。PTEN的无义突变主要集中在第7、8外显子,多导致C-末端的截短蛋白。
PTEN突变主要发生在高度恶性的胶质瘤中,是间变星形细胞瘤向胶质母细胞瘤转化的关键基因,674例多形性胶质母细胞瘤或间变星形细胞瘤的研究结果显示,24%的患者存在PTEN突变,而在其他类别胶质瘤中PTEN的突变率仅占2%。如果临床病理诊断为胶质母细胞瘤,野生型PTEN染色阳性,则提示患者如果进行恰当治疗会延长存活期,如PTEN染色阴性,则提示患者对放射治疗与化疗敏感性差,存活期短。间变星型细胞瘤中存在PTEN突变同样提示患者预后不好。
患者存在NF1及PTEN突变,提示可能对依维莫司治疗敏感(依维莫司 10 mg ,每日1次,口服)
(五)生长因子及生长因子受体检测
1.EGFR
表皮生长因子受体(EGFR)属酪胺酸激酶受体超家族的一员,基因定位于7号染色体短臂上,分子量170kD。EGFR配体包括EGF TGF-α双调蛋白和肝素结合EGF样生长因子。EGFR与配体结合后,经跨膜部,激活胞内一系列蛋白质分子(第二信使),将信号传递到细胞核,引起基因转录,编码细胞生长、繁殖及分化所必需的蛋白质,最终调节细胞的生长及分裂。EGFR倍增是原发胶质母细胞瘤发生的关键基因,近2/3的胶质母细胞瘤中有EGFR基因扩增。EGFR的扩增,在大多数的胶质母细胞瘤总是伴随着大量的EGFR碎片出现,而这种碎片EGFR也具有EGFR扩增的功能,同时也会伴随配体的增多,如EGF与TGF-α,受体的扩增与过表达都促进肿瘤的生长。在胶质母细胞瘤中,扩增的EGFR基因将发生重新排列,出现外显子2到7的丢失。这种新转录子的产物,将出现在N-端丢失267个氨基酸的新受体。这种新受体虽然失去了配体结合的活性,但是可以表现为不依赖配体的独立活性,其原因是由于酪氨酸的残基发生了磷酸化,可以在配体缺乏的情况下单独促进细胞生长。
在胶质瘤中表皮生长因子受体(EGFR)对于胶质瘤的生长、恶性变起重要作用,胶质母细胞瘤中 EGFR 扩增率为40%~50%左右,而间变性星形细胞瘤的发生率较低,仅为7%这种现象提示EGFR的激活可能是肿瘤细胞向胶质母细胞瘤转化的原因。胶质母细胞瘤中,EGFR基因扩增与突变的EGFR基因可以同时检测到,意味着胶质瘤恶性程度的增加。需要说明的是,胶质瘤中EGFR基因扩增与突变EGFR基因的出现,二者产生的功能是不一样的,前者是正常的EGFR 过度表达,与配体的结合,而后者是不依赖于配体,具有独立促进胶质瘤发生的能力。
原发胶质母细胞瘤和继发胶质母细胞瘤在组织学上难以区分,但可以通过肿瘤细胞的分子遗传学特征确定。原发性胶质母细胞瘤一般患病年龄较大,多伴EGFR扩增而不伴p53的突变。组织学上表现为小细胞(small cell,SC)的胶质母细胞瘤与EGFR基因扩增具有显著相关性;这种组织学类型也与肿瘤广泛坏死、高龄患病、病程长等特点相关。对于胶质母细胞瘤,尤其是小细胞胶质母细胞瘤来说,尽管EGFR扩增有助于与间变性少枝胶质细胞瘤的鉴别、但目前尚未确定其与预后和治疗的相关性。有53突变的年轻患者同时伴有EGFR高表达,预后不佳。在部分胶质母细胞瘤中,EGFR的过度表达与该肿瘤的放射抗性相关。EGFR表达越高,放射治疗反应越差;患者对化疗/放疗的副反应重,可给于放增敏剂,同给于脑保护剂。日前针对封闭细胞内与细胞外的EGFR治疗略已在体部肿瘤得到广泛用,并取得了可喜的临床效果,但对于胶质瘤的治疗效果并不显著。
2. VEGF
血管内皮生长因子(VEGF)是一种肝素亲和的外分泌二聚体糖蛋白,分子最为34-42kD,是一种高度特异的内皮细胞有丝分裂素,与血管内皮细胞表面特异性受体结合后可产生多种生物学功能。目前认为VEGF与肿在脑内的转移有关,这是因为脑肿瘤的转移必须有新生血管的参与,VEGF在血管生成中的中心作用已经令人信服的被证实。在正常脑组织中,VEGFmRNA的表达水平相对较低,在低级别胶质瘤中表达上调,在胶质母细胞瘤中高表达,可达到正常脑组织的50倍。胶质瘤细胞可以产生VEGF,VEGF 通过和高亲和力的相应受体相互作用结合于内皮细胞,几乎在所有的内皮细胞上都发现了这些VEGF的受体。在病理上,坏死灶的出现和血管结构的增殖是胶质母细胞瘤与低级别胶质瘤的特征性区别之一。脑转移灶的生长经常包含有非芽生血管生成形成的粗大血管。在动物模型上,VEGF过表达可以刺激非芽生血管生成发生黑色素瘤和肺腺癌脑转移,肿瘤内可见增粗的血管,并且降低 VEGF表达可抑制增粗血管的形成。临床上,Vredenburgh等利用贝伐单抗(VEGF单克隆抗体)及伊立替康(CPT-11)联合治疗复发恶性胶质瘤的Ⅱ期临床试验取得了令人惊喜的结果,评估中63%的患者肿瘤出现了客观的影像学改善,但患者的生存时间无进展生存时间并没有大幅提高(复发胶母的中位无进展生存时间20周,中位生存时间10月,Ⅲ级复发胶质瘤的中位无进展生存时间为30周)。因此这种客观的影像学改善是由于血管渗透性的改善,还是肿瘤真正的减小有待进一步确定。
3.IGFBP-2
胰岛素样生长因子结合蛋白2(IGFBP-2)是类胰岛素样生长因子(IGF)系统一员,基因位于2q35上。含有4个外显子,第一个外显子主要编码氨基端序列,第二个编码中央序列,第三及第四外显子编码羧基端序列。成熟的IGFBP-2含有289个氨基酸,其分子量约为31.2kD。氨基端和羧基端都具有IGF结合活性,推测两个区域可能共同形成一个IGF结合“口袋”。IGFBP-2结构中含有18个半胱氨酸(cys)组成9个链内二硫键。其中12个分布在氨基端,6个分布在羧基端,氨基与羧基端之间无二硫键形成,推测氨基与羧基端在蛋白与蛋白及蛋白与细胞外基质间起重要作用。
IGFBP-2可由多种神经组织合成,是脑脊液中含量最丰富的IGFBP。IGFBP-2在脑中的合成部位主要为脉络丛和软脑膜,与大脑发育相关。胎儿期的脉络丛、脑膜、基板、漏斗板和发育中的胶质细胞都可测到IGFBP-2mRNA。脑中IGFBP-2水平在一些急、慢性非生理状态下会升高,如外伤、缺氧、细胞再生等,而升高的IGFBP-2来源于活化星形细胞及微胶质细胞。Chesik等人采用半定量技术发现分化期和增殖期的星形细胞表达IGFBP-2mRNA无差异,而 Westem blot 显示增殖期星形细胞分泌IGFBP-2明显增加,推测活化后的星形细胞通过翻译水平分泌大量ICFBP-2
脑肿瘤患者的脑脊液中IGFBP-2浓度升高。通过cDNA微阵列及组织芯片技术,发现各级胶质瘤表达IGF、IGFBP-1及IGFBP3水平相同,而在高度恶性的胶质母细胞瘤中IGFBP-2高表达,IGFBP-2表达越高,患者预后越差。Emlinger等发现表达大量IGFBP-2的细胞常聚集于肿瘤坏死灶附近,表明IGFBP-2与GBM形成和进展密切相关。
(六)肿瘤侵袭因子检测
侵袭是肿瘤转移形成的重要环节之一。在侵袭的过程中,肿瘤必须具有水解细胞外基质的能力才能穿过细胞外基质进入新的种植区。MMP-2和MMP-9是水解胶原最重要的系。MMP-2和MMP9的酶解活性不仅与其产生量有关,还与其特异性抑制物(TMP2和TMP1)及酶活化物(MT-MMP1)的产生有关。多种MMPS协同作用可降解所有的细胞外基质成分。
体内和体外的研究证明,胶质瘤的侵装性和MMP的表达和活化有密切关系,具有侵袭能力的胶质瘤细胞分泌大量的MMP-2,其侵袭力与MMP-2有密切关系,编码MMP9及MTMMP的mRNA水平有明显升高。应用Northemblot和免疫组化技术对临床组织标本检测表明,胶质瘤细胞中的MMP-2.MMP-9及MT-MMP随胶质瘤恶性程度的增高,其转录和表达也增加,活化的MMP-2,MMP-9及MT-MMP也增加。有文献报道,MMP-2和MMP9是胶质瘤细胞侵袭性生长的最佳预测因子。
TIMPS是MMPs的特异性抑制因子,体外研究证明,TIMPS具有抑制胶质瘤细胞侵袭性的作用,这一作用正是通过抑制MMPs来实现的。TIMP-I和TIMP-2这两个天然的MMP抑制因子口服不能吸收,组织穿透性也很有限,因此人工合成的Marimastat及Prinomasta(AG3340)等新型药物已经进人临床试验阶段。Marimastat可以针对所有MMP,是一种广谱抑制 MMPs的新药,可以口服,目前正在临床试验阶段。
(七)化疗耐药相关基因、蛋白的检测
1. O6-甲基鸟嘌呤-DNA-甲基转移酶(MGMT)
MGMT是一种普遍存在的DNA修复酶可保护染色体免受烷化剂的致突变、致癌和细胞毒作用的损伤。化剂是一类自然界中普遍存在的重要诱变剂和致癌物质,主要造成DNA碱基的烷基化损伤(如甲基化或乙基化)以形成 0°-甲基鸟嘌呤(0°-mG)对细胞危害最大,造成碱基错误配对,即G:C→A:T,从而弓起致癌、细胞毒和骨髓抑制作用。MGMT是唯一能将0‘鸟嘌呤复合物从DNA上移除的蛋白,可在突变发生前中和这种损伤作用。MGMT主要通过不可逆地将烷化基团从0-mG转移到 MGMT蛋白145位的半胱氨酸残基上而保护细胞免受烷化剂的损伤。在这一过程中MGMT不需要辅助因子和其他蛋白质的参与,同一蛋白既作为甲基转移酶,又作为甲基受体蛋白。同时,MGMT蛋白反应位点被烷化基团不可逆结合而失活,故该反应又称为自杀反应。细胞对于DNA鸟嘌呤0‘位上烷化基团的修复能力取决于MGMT在细胞内的含量和合成速率。
(1)MGMT基因启动子甲基化与MGMT蛋白的表达
MGMT基因和大多数管家基因一样,启动子缺少TATA 盒和CAAT盒,但一些区域富含CC序列,特别是在其转录起始点区域含量约90%。MGMT基因5’端调节区域也富含GC序列。肿瘤抑制基因和其他一些肿瘤相关基因的启动子或5’端内高度甲基化是人类肿瘤的一个共同特点,并且常常导致基因转录终止和相关蛋白丢失。由于MGMT基因具有这些结构特点,故被认为其启动子中CpG岛的过度甲基化会降低基因的表达。
MGMT基因启动子甲基化状态与MGMT蛋白的表达关系密切,启动子甲基化是MGMT基因最常见的异常,多发生于MGMT基因启动子CpG岛,导致该基因转录停止,蛋白表达减少。Esteller 等分析了524例多种原发肿瘤、肿瘤细胞株和正常组织,发现所有正常组织和表达MGMT的细胞株均无MGMT基因甲基化,而不表达MGMT的细胞株均有过甲基化:同时,他们用免疫组织化学法(田C)检测了31例多种原发肿的MGMT表达与MGMT基因申化的关系,发现I3例MGNT基因启动子区甲基化肿瘤中I2例(92%)无MGMT表达,而例无NCN7基因甲基化的肿瘤中17例(94%)表达MGMT。这证实了MGMT基因启动子CPG岛甲基化是导致MGMT表达减少的重要机制。Puling等曾利用甲基化特异性聚合副链反应(Mehylation-speeiePCR,MSP)和HC检查239名肺腺癌病人肿瘤组织中MGMT因甲基化和MGMT蛋白表达的情况,结果发现MGMT基因启动子甲基化的发生率达51%MSP和IHC检查结果的符合率达83%,证明MGNT基因启动子甲基化是细胞内缺乏蛋白的主要原因。
(2) MGMT与胶质瘤患者临床特征间的关系
1) MGMT与病人的年龄、性别
MGMT基因表达与病人年龄呈负相关,男性肿瘤病人较(2)MGMT与胶质瘤患者临床特征间的关系
2) MGMT与胶质瘤的病理类型
在不同病理类型的胶质瘤中,MGMT对化疗效果的影响也不同。在多形性胶质母细胞瘤(CBM)中,MGMT阳性的病人对卡莫司汀(BCNU)为主的化疗明显比MGMT阴性者化疗效果差。但在间变性星形细胞瘤中,MGMT表达与化疗效果的关系不密切。在成人胶质瘤MGMT活性检测中,少枝胶质细胞瘤的MGMT活性明显低于星形细胞瘤。
3) MGMT与胶质瘤的恶性程度
MGMT基因启动子甲基化发生率越高,MGMT含量越低,肿瘤恶性程度就越高。运用甲基化特异性PCR来观察脑星形细胞瘤MGMT基因启动子甲基化情况,星形细胞瘤(WHOI级)MGMT基因启动子甲基化程度为22%,从低级星形细胞瘤恶化而来的胶质母细胞瘤(WHOW级)甲基化程度增高,达75%。但也有一些学者持相反观点,Tanaka等研究结果表明:高度恶性胶质瘤MGMT的表达要多于低度恶性胶质瘤。
(3)MGMT基因甲基化与胶质瘤病人的化疗效果及预后的关系
1) MGMT基因甲基化与恶性胶质瘤的治疗
2005年,一项大型国际性协作研究显示在放疗基础上加用TMZ可改善恶性胶质瘤病人的生存率(2年生存率达46%),从而为恶性胶质瘤提供了一种新的治疗标准。这项里程碑式的研究是恶性胶质瘤治疗领域35年来取得的最重要进展。此外,该研究还发现MGMT基因启动子甲基化病人组生存时间明显长于非甲基化组,MGMT基因沉默是胶质母细胞瘤化疗效果好的因之一,且对病人预后和生存期的预示作用较肿瘤的分级、临床、年龄等其他特征更有效。
2) MGMT基因甲基化在肿瘤组织中与在血清中的相关性
Balana等研究表明:MGMT基因启动子甲基化在肿瘤组织中与在血清中具有显著的一致性。Ramirez等用MSP法检测了28例胶质母细胞瘤和51例非小细胞型肺癌病人的肿瘤组织及相应血清中MGMT基因甲基化情况,发现肿瘤组织与血清中MGMT基因启动子的甲基化具有高度相关性(Spearman检验,均P=0.0001)。因此,检测胶质瘤病人血清中MGMT基因启动子甲基化也可用来预测病人的预后及制定个体化的化疗方案。这也便于化疗病人定期复查,预测化疗效果,进行选择性化疗。
3)MGMT基因甲基化与少枝胶质细胞瘤化疗敏感性的关系
Mollemann等研究发现:在少枝胶质细胞瘤中,MGMT基因启动子甲基化与染色体1p、19q联合LOH高度相关,即在染色体1p、19q联合LOH的少枝胶质细胞瘤中MGMT基因较多发生甲基化:相反,MGMT基因启动子在无1p、19q联合LOH的少枝胶质细胞瘤中较少发生甲基化。这也表明MGMT基因的高甲基化及蛋白的低表达可能与少枝胶质细胞瘤的化疗感性有关。Brandes等研究也发现:在少枝胶质细胞瘤中,MGMT基因启动子的甲基化与、19qLOH具有显著的一致性因此,MGMT基因甲基化可作为一种新的候选标记物来预测少枝胶质细胞瘤病人对化疗的敏感性。
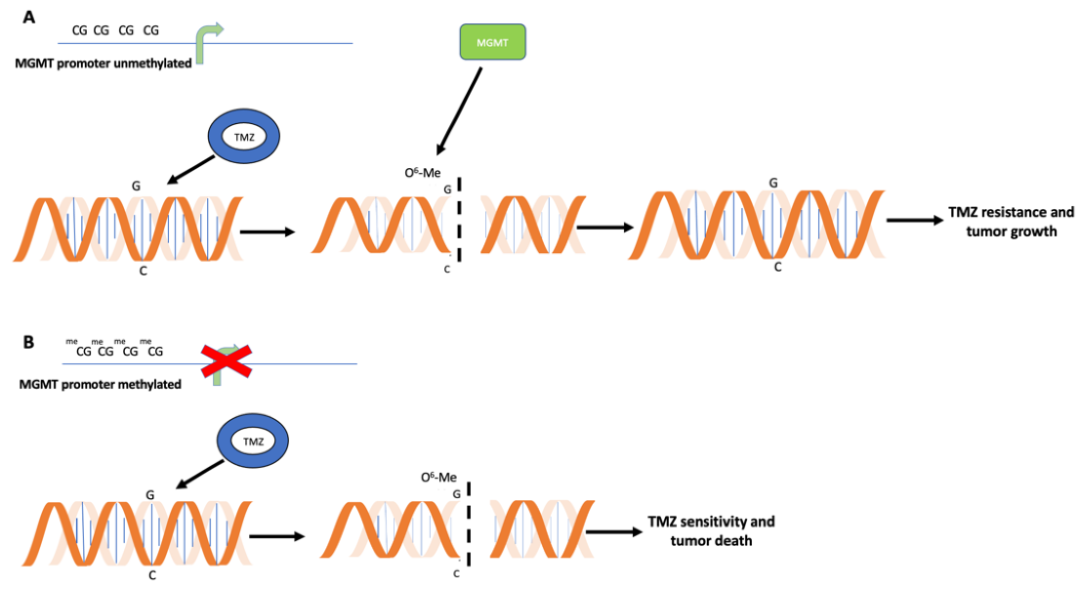
替莫唑胺(TMZ)和O6 -甲基鸟嘌呤- DNA甲基转移酶(MGMT)酶活性之间的拮抗作用 Della Monica R, Cuomo M, Buonaiuto M. et al.
2. P170(MDR-1)肿细胞耐药性以多药耐药最常见
肿瘤细胞的多药耐药性(Mmuidrug Resistsnce,MDR)是指对所应用的一种化疗药物耐药,同时对另外一些与之化学结构作用机制完全不同的化疗药物的交叉耐药。与MDR相关的基因称为MDR基因。耐药相关标志蛋白主要是指P-糖蛋白(P-glycoprolein,Pep,P170),是多药耐药基因mdr-1的产物。目前已发现多种P170耐药机制,其中P170基因的过度表达是导致肿瘤细胞对疏水性天然药物产生多药耐药的主要机制之一。P170基因位于人染色体7q21.1,因其编码的蛋白含量和细胞内药物浓度及耐药性直接相关,故称之为通透性糖蛋白。P170是一种ATP依赖性跨膜药物外排泵,对各种药物进入细胞内和从细胞内清除起重要作用,能减少细胞内药物积聚降低细胞内药物浓度,从而降低药物的杀伤肿瘤细胞的效果。
P170在胶质瘤细胞中过度表达是产生肿瘤耐药的机制之一。在临床实际工作中,检测患者P170有助于选择有效的肿瘤化疗方案,提高治疗效果。对于P170表达阳性的胶质瘤患者应避免再应用长春新碱等花碱类药物。
3.TopoⅡ
TopoⅡ是肿瘤化疗的重要靶点,主要介导 DNA的断裂反应并形成 DNA-酶复合物,但此反应是可逆的,且趋向于断裂的DNA再连接。抗癌药物可通过上述复合物的稳定性影响癌细胞的增值
TopoⅡ介导的MDR的主要特征有:D对许多天然药物呈现抗药性;2膜-活性药物不能提高抗肿瘤药物的细胞毒作用:③药物在细胞内积聚与保留没有变化;④多耐药相关蛋白(mdr1)与Pgp表达未见增加;⑤Topo Ⅱ含量及活性均有所下降。Topo Ⅱ介导的 aL-MDR 细胞发生了Topo Ⅱ量和质的改变,酶水平的降低导致DNA断裂减少和细胞毒性降低,DNA结构的改变可影响药物诱导的“断裂复合物“的稳定性。不同的耐药细胞可以从不同的环节改变Topo Ⅱ的调控。
TopoⅡ检测意义包括:
①胶质瘤中 Topo Ⅱ的表达与病人的性别,年龄及肿瘤大小无关而与肿瘤的恶性程度有关,TopoⅡ测定可作为判断胶质瘤恶性程度分级的一个辅助检查指标,并对胶质瘤的复发有预测价值;
②进行肿瘤的TopoⅡ测定,可以预测病人对化疗药物的敏感性,正确地选择以DNA Top0Ⅱ为靶点的化疗药物,为合理用药提供理论基础;
③恶性程度相同的胶质瘤中,复发者TopoⅡ的表达比初发者明显降低,说明胶质瘤在综合治疗过程中可以获得多药耐药表型,提示这种多药耐药的原因可能是由于Topo Ⅱ数量的减少或( 和)活性降低造成的。在胶质瘤化疗初期,选择正确化疗药物,实施联合大剂量突击性化疗,有利于预防和延缓临床耐药的发生。VM-26为鬼臼毒素的半合成衍生物,分子量为665.66ku.蛋白结合率低,中度脂溶性,易通过血脑屏障。作为Topo Ⅱ的抑制剂,VM-26 通过干扰肿瘤细胞的有丝分裂,破坏 DNA 结构,发挥抗肿瘤作用。
4.CST-π
CST-π属于谷胱甘肽S-转移酶(GST)亚型,谷胱甘肽S转移酶(GST)是种多功能代谢Ⅱ相酶,研究表明谷胱甘肽转移酶是肿瘤产生多药耐药(MDR)的重要因素之,谷胱甘肽S-转移酶(GST)主要是与化疗药物结合,参与生理解毒,降低化疗药物的毒性导致肿瘤细胞产生耐药性。GST-π在肿瘤组织中最为常见,催化谷胱甘肽CSH与各种亲抗肿瘤药物的电子分子和疏水性分子结合,使化合物对细胞的毒性减小,可与亲脂性药物结合,增加其水溶性,从而促使其外排,从而降低肿瘤药物的细胞毒作用,或者通过非酶结合的方式将细胞内毒性化学物质清除,从而导致细胞的耐药。GST-π在胶质瘤细胞的表达水平与其病理分化程度呈正相关,与EzerR等的研究相似,高级别(Ⅲ~Ⅳ级)胶质瘤CST-T的表达水平较低级别(I~Ⅱ级)显著增高,因而对有关的化疗药物更易耐受,化疗结果较差,肿瘤较易复发,说明 GST-π在胶质瘤中的高表达可能是胶质瘤MDR的另一重要机制。而且由于正常脑组织GST-π无表达,说明GST-π在胶质瘤细胞的表达可能与肿瘤的恶变有关可能是胶质瘤恶变过程中癌基因被激活的同时,GST-π基因受激活而使GST-π表达增强,其机制尚须进一步深入研究。临床上通过检测胶质瘤细胞中GST-π的表达水平可预测胶质瘤的相关耐药程度及肿瘤的病理分化程度。GST-π和顺铂的耐药有关,GST-高表达提示顺铂耐药。此外,谷胱甘肽过氧化酶能将有潜在毒性的过氧化物还原为毒性较低的醇化合物此酶在MDR细胞中活性增加,还与长春新碱、丝裂霉素及阿霉素耐药有关。对GST-π低水平表达者应避免使用针对CST-π的抗癌药物,同时若能降低胶质瘤细胞中GST-π表达水平,可能使部分胶质瘤MDR逆转。在初治胶质瘤的化疗药物选择时,检测GST-π的表达可预示不同的化疗敏感性及肿瘤的恶性程度,有利于指导临床上更加合理地选择化疗方案及个体化化疗,对预后的判断也有重要价值。
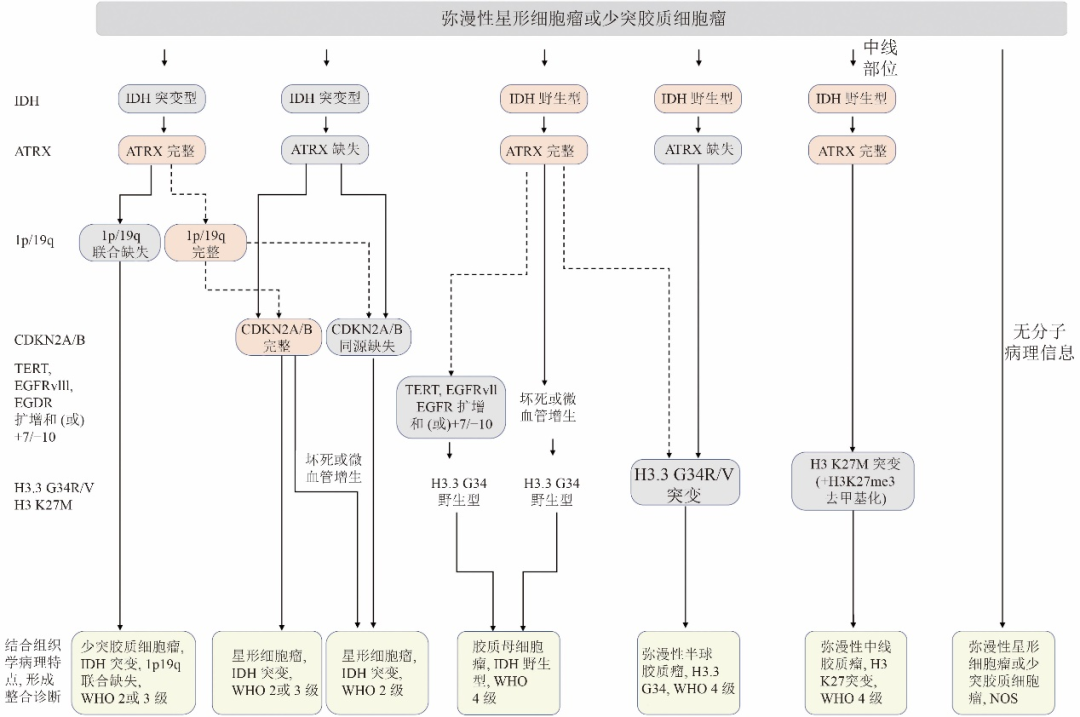
弥漫性胶质瘤整合病理诊断流程
2013年,杜克大学病理学研究团队对223例胶质瘤标本分析研究证实,端粒酶反转录酶基因(telomerase reverse t tran- scriptase gene, TERT)启动子区突变见于54%~83%的原发胶质母细胞瘤患者。TERT启动子突变与信使RNA高表达水平相关,这可能是原发胶母端粒酶功能增强的重要原因。同时, TERT启动子区突变也见于绝大多数少突胶质细胞瘤,少见于 WHOI~Ⅲ级星形细胞瘤。TERT启动子甲基化联合X连锁地中海贫血/智力低下综合征基因(alphathalassemia/mental re- tardation syndrome X-linked,ATRX)和IDH的突变(常见于星形细胞瘤和继发性胶质母细胞瘤)能够为胶质瘤基因分型进行有益的补充。
IDH野生型 、TERT突变的Ⅳ级胶质瘤生存期,后者仅为11.3个月。

本文是曾辉版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论