 三甲
三甲
颈静脉孔神经鞘瘤伽玛刀治疗进展文献综述:伽玛刀是首选治疗方法或是手术后残余、复发瘤体重要辅助治疗方法
颈静脉孔神经鞘瘤的伽玛刀治疗进展文献综述:伽玛刀或是首选治疗方法或是手术后残余、复发的颈静脉孔神经鞘瘤重要的辅助治疗方法
起源于颅神经IX、X和XI,通常伴有神经缺损。肿瘤体积的进一步增大可能会导致脑干或血管受压。颈静脉孔神经鞘瘤与脑膜瘤、颈静脉球瘤和脊索瘤的区别在于存在硬脑膜尾、骨质破坏和血管造影表现。
6.1 分型
Pellet等人将颈静脉孔神经鞘瘤分为4类: A型(主要是颅内):向颈静脉孔的最小延伸;B型(主要在骨内):有或没有颅内成分;C型(主要是颅外):仅轻微伸入颈静脉孔或后颅窝;D型(哑铃形):颅内外延伸 [17]。
6.2 手术完全切除困难且严重并发症发生率高
根据Sanna等报道的23例颈静脉孔神经鞘瘤患者的显微外科系列,其中20.5%的患者术后第IX和第X颅神经功能恶化,50%的病例记录到一条或多条后组颅神经出现新的缺损。该研究回顾性分析1988年5月至2006年4月在本中心就诊的颈静脉孔神经鞘瘤患者的病历[18]。
研究组由23名患者组成。1名后组颅神经功能正常的患者(一名73岁女性)接受了密切观察的治疗,并定期进行临床和放射学随访。3例行颞下窝A型入路(IFTA-A)。1名患者接受了经耳蜗经颈静脉入路。在22例手术治疗的患者中,12例采用经乙状窦岩枕入路(POTS)进行手术。在1名术前有无功能听力的患者中,采用了联合POTS经皮进路。2名患者通过POTS入路结合经耳入路进行手术。在另1例(67岁女性)中,计划通过经颈途径进行肿瘤次全切除,以切除颈部10cm的肿块。1名患者接受了一期联合经颈岩部次全切除术,以切除颈部巨大肿瘤;第二阶段硬膜内肿瘤切除是通过经乙状窦经颈静脉途径完成的。最后一名患者接受了一期联合经颈岩部次全切除术,以移除颈部肿瘤成分;该患者目前正在等待第二阶段硬膜内肿瘤切除术。21例肿瘤完全切除,1例颈静脉孔残留神经鞘瘤。3例接受IFTA-A手术的患者接受了永久性面神经前移位术。在1年的随访中,其中2例House-Brackmann I级,1例达到IV级。接受经耳蜗颈静脉入路的患者有永久性面神经后移位。在1年的随访中,他的面神经功能达到III级。所有采用POTS手术的患者术后面神经功能均正常(House-Brackmann I级)。12名患者使用POTS方法进行了听力保留手术。10例(83.3%)听力保持良好,其中大部分(58.3%)听力维持在术前水平。无围手术期死亡率。1例(4.5%)术后出现脑脊液漏。术后,所有患者术前麻痹的下颅神经功能均未恢复。50%的病例记录到一条或多条下颅神经出现新的缺损 [18]。
Park等人分析了275例颈静脉孔神经鞘瘤患者的手术结果,发现34.9%的患者术后出现后组颅神经麻痹 [19]。
据报道在6-34%的病例中有新的神经功能缺损,尤其是涉及面神经的 [17,20],其他报告的并发症包括脑脊液渗漏(3-7%)、吸入性肺炎(1.5-6%)、静脉窦血栓形成(3%)和脑膜炎(2%)。术后死亡率在0.5%到5%之间 [20,21,22]。
6.3 伽玛刀(GKRS)与次全切手术联合使用对颈静脉孔神经鞘瘤达到长期控制并显著降低手术导致的颅神经并发症
目前,伽玛刀(GKRS)为代表的SRS在面神经保护方面肯定优于显微手术。同样,在颈静脉孔神经鞘瘤的病例中,伽玛刀(GKRS)为代表的SRS后新出现或恶化的神经功能缺损的发生率被认为是罕见的。对于有小到中等大小颈静脉孔神经鞘瘤的患者,伽玛刀放射外科与良好的肿瘤控制相关,且产生不良辐射影响的风险最小。伽玛刀(GKRS)为代表的SRS在新发现或手术后残余、复发的颈静脉孔神经鞘瘤的应用得到广泛认可,肿瘤长期控制率高、神经功能改善和稳定率高、并发症少、基本上无放射并发症。
Sedney等证明,与根治性全脑切除术相比,近全脑切除术的保守手术技术显著减少了术后永久性第IX和第X颅神经缺损。因此,他们对颈静脉孔神经鞘瘤的手术策略从全切除改为近全切除,以保留神经功能。在比较SRS和显微手术的功能结果时,SRS有望成为颈静脉孔神经鞘瘤患者手术切除的合理选择,只要肿瘤不会严重压迫脑干 [23]。
6.4 伽玛刀(GKRS)为代表的SRS治疗对新发现的或手术后残余、复发的颈静脉孔神经鞘瘤的肿瘤长期控制率高、神经功能改善和稳定率高、基本上无放射并发症
实际上,近年来,伽玛刀一直被用来治疗新发现的或手术后残余、复发的颈静脉孔神经鞘瘤。
根据Hasegawa的经验,SRS后没有患者出现第IX或第X颅神经恶化。相反,70%以上在治疗前有吞咽障碍和/或声音嘶哑的患者在SRS后表现出改善。与其他症状性神经鞘瘤相比,以SRS作为初始治疗的颈静脉孔神经鞘瘤患者似乎更有可能改善其症状。换言之,如果在肿瘤切除时第IX或第X颅神经没有受到损伤,那么症状改善率很高。另一方面,显微手术仍然有相对较高的并发症风险,即使最近有经验的手术使用了各种颅底技术 [1]。
Martin等于2007年报道了(1990年5月至2005年12月)34例颈静脉孔神经鞘瘤患者(35个肿瘤,1例双侧肿瘤)接受了GKRS治疗后平均随访83个月的回顾性临床结果:肿瘤局部控制率94.3% (33/35)[肿瘤缩小的患者比率48.6%(17/35),肿瘤稳定的患者比率45.7%(16/35),肿瘤进展的患者比率5.7%(2/35)],精算的5年和10年无进展生存率分别为97%和94%;颅神经病变改善比率20%,稳定比率77%,病情恶化比率 2.9%(1/34);放射外科手术后,所有35条未受影响的神经都保持完好,140条运动颅神经中有138条(98%)得到整体保存或改善,在未进行过手术的患者中,23条颅神经最初受到影响,11条(47%)在放射外科术后平均16个月得到改善;该研究中,22人曾接受过显微手术切除,中位肿瘤体积为4.2 cm3,中位边缘剂量为14 Gy,中位最大剂量18 Gy [24]。
Muthukumar等于1999年报道了17例(1990年5月至 1997年)新诊断或残留/复发的颈静脉孔神经鞘瘤患者接受GKRS的平均随访3.5年(6~74个月)的临床结果:该研究中,13名患者曾接受过手术(范围1-6次切除),4例患者在显微手术切除前出现多发性颅神经缺损,12例术后出现多发性后组颅神经麻痹,4名患者接受SRS作为初始治疗;中位肿瘤紫荆22.5 mm,肿瘤边缘剂量为12-18 Gy,16例等剂量线为50%, 1例为70%;肿瘤生长控制率为94.1% (16/17) [肿瘤缩小的患者比率47.1%(8/17),肿瘤稳定的患者比率47.1%%(8/17),肿瘤进展的患者比率5.9%(1/17],神经症状好转率(6/17),稳定率(10/17),1名患者在放射外科术后6个月肿瘤增大,临床恶化,并接受了显微手术切除,没有患者出现新的颅神经或其他神经缺陷 [25]。
Zhang 等于2002年报道了27名(1993年11月至2000年12月)颈静脉孔神经鞘瘤患者接受GKRS治疗的回顾性临床资料:该研究中,12名患者曾接受过肿瘤切除术,12患者接受GKRS作为主要治疗;平均肿瘤体积为13.5 cm3(范围为4.7-35.7 cm3),平均边缘剂量为14.6 Gy(范围9.8-20 Gy),平均最大剂量为32.6 Gy(范围25.4-50 Gy),等剂量线为35%-55%;25名患者平均随访38.7个月(范围9-90个月);肿瘤生长控制率96% (24/25)[肿瘤缩小的患者比率44%(11/25),肿瘤稳定的患者比率52%(13/25),肿瘤进展4%(1/25)];神经症状好转率64%(16/25),稳定率36%(9/25);没有患者出现新的颅神经缺损[26]。
Peker等于2012年报道了17例新诊断或残留/复发的颈静脉孔神经鞘瘤患者接受GKRS的平均随访64个月的临床结果:肿瘤生长控制率100% [肿瘤缩小的患者比率76.5%(13/17),肿瘤稳定的患者比率23.5%(4/17)],仅有1名患者出现短暂性声音嘶哑;该研究中,5名患者接受SRS作为初始治疗,其他12名患者均接受了手术,平均肿瘤体积为5.9cm3,平均边缘剂量为13Gy[27]。
Pollock等于2002年报道了(1992年4月到2000年2月)23例新诊断或残留/复发的非前庭神经鞘瘤患者接受GKRS的回顾性临床资料:该研究中,受影响的颅神经包括滑车(n=1)、三叉神经(n=10)、颈静脉孔区(n=10)和舌下神经(n=2),9名患者曾接受过一次或多次肿瘤切除术,1名患者患有恶性神经鞘瘤,2例有神经纤维瘤病;中位处方等剂量体积为8.9 cm3(范围为0.2-17.6 cm3),肿瘤边缘剂量中位数为18 Gy(范围为12-20gy);中位最大剂量为36 Gy(范围为24-40 Gy);GKRS后的中位随访期为43个月(范围为12-111个月);肿瘤控制率96% (22/23)[肿瘤缩小的患者比率52.2%(12/23),肿瘤稳定的患者比率43.5%(10/23)];与放射外科相关的发病率为4例(17%)[10例三叉神经鞘瘤患者中有3例在放射外科手术后出现新的或恶化的三叉神经功能障碍,1例舌下神经鞘瘤患者在放射外科手术后出现咽鼓管功能障碍,在放射外科手术后,没有一名患有后组颅神经神经鞘瘤的患者出现听力损失、面部无力或吞咽困难[28]。
最近,2个多中心回顾性分析研究更进一步确认了伽玛刀在治疗颈静脉孔神经鞘瘤方案中的重要地位。
Hasegawa 等于2016年报道了对117名颈静脉孔神经鞘瘤患者接受SRS治疗的多中心回顾性分析的结果;61名患者有手术史,56名患者先接受了GKRS治疗,中位肿瘤体积为4.9 cm3,中位边缘剂量为12 Gy;5名患者分别接受了边缘剂量为42和21Gy的三次分次SRS治疗;中位随访时间为52个月(范围12-248);肿瘤生长控制率88.9% (104/117)[肿瘤缩小的患者比率53%(62/117),肿瘤稳定的患者比率36%(42/117),肿瘤进展11%(13/117)],精算的3年和5年无进展生存率(PFS)分别为91%和89%,多变量分析显示,GKRS前脑干水肿和哑铃状肿瘤显著影响PFS;先前存在的声音嘶哑和吞咽障碍分别在66%和63%的患者中得到改善,17%(20/117)患者出现了一定程度的症状恶化,其中12例(10%)为暂时性,8例(7%)为持续性,其中4名患者(3%)因肿瘤进展所致,另外4名患者(3%)尽管肿瘤消退,但临床症状仍在恶化,这被认为是不良辐射效应[29]。
Kano等于2018年报道的(1990-2013年)来自国际伽玛刀研究基金会九个参与中心的多中心回顾性研究资料:该研究包括92例接受SRS的患者,41名患者曾接受过显微外科次全切除术,84名患者已有颅神经(CN)症状和体征,中位肿瘤体积为4.1 cm3(范围0.8-22.6 cm3),中位边缘剂量为12.5 Gy(范围10-18 Gy),神经纤维瘤病患者被排除在本研究之外;中位随访时间为51个月(6-266个月),肿瘤控制率 87%(80/94)[肿瘤消退患者的比率50%(47/94),稳定比率35.1%(33/94),进展比率12.8%(12/94)],无进展生存率(PFS)在3年时为93%,5年时为87%,10年时为82%;在整个系列中,只有哑铃形(经颈静脉孔向颅外延伸)与PFS恶化显著相关;在未经显微手术的患者组(n=51),与PFS改善相关的因素包括肿瘤体积<6 cm3和非哑铃形肿瘤;颅神经症状改善和稳定率84.5%(78/92)[改善率29.3%(27/92),稳定率55.4%(51/92),恶化率15.2%(14/92)];症状性不良辐射反应发生率7.6%(7/92)[在SRS后平均7个月(范围5-38个月)出现][30]。
6.5 舌下神经鞘瘤的伽玛刀治疗后长期肿瘤控制率高、并发症少
Kaye等人将舌下神经鞘瘤分为A型:硬膜内肿瘤;B型:哑铃状肿瘤;C型:颅外肿瘤 [31]。
Tucker等人于2007年报告了1例舌下神经鞘瘤,患者在15个月的随访中因复发而转诊接受GKRS治疗,边缘剂量为13 Gy,处方等剂量60%,GKRS后第12个月肿瘤缩小[32]。
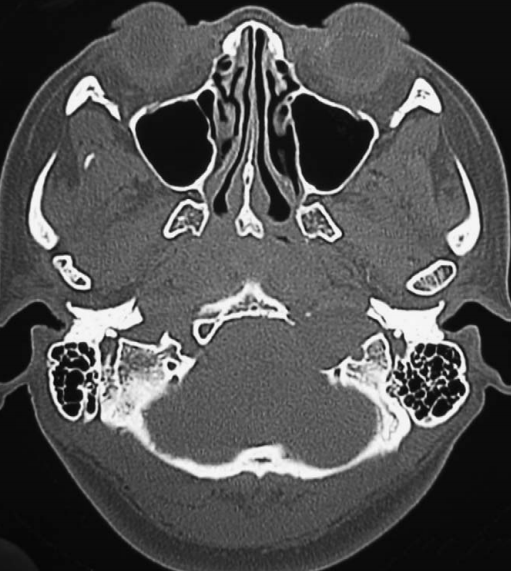
图1. 无对比增强剂的入院头部CT扫描显示左侧舌下神经管有一个巨大的侵蚀性缺损。

图2. 轴位对比增强T1加权MR图像显示一个非均匀强化肿块,起源于颅内,向舌下孔突出颅外延伸,扩大并侵蚀舌下神经管。
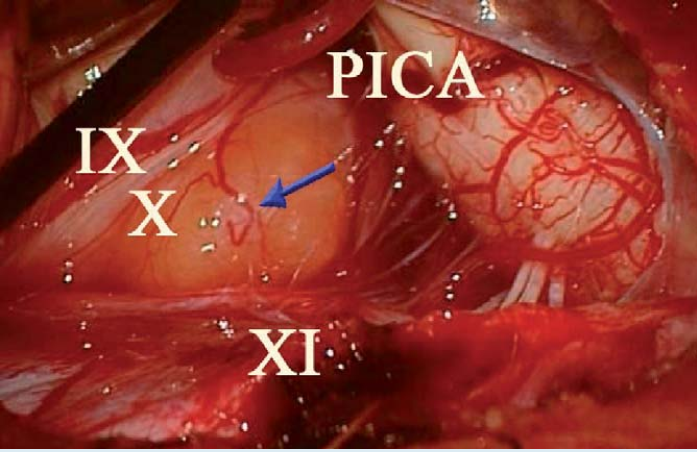
图3. 术中照片显示舌下神经鞘瘤(箭头),舌咽神经(IX)、迷走神经(X)、脊髓副神经(XI)和小脑后下动脉(PICA)在肿块表面周围伸展。肿瘤完全遮蔽了舌下神经和舌下神经管。
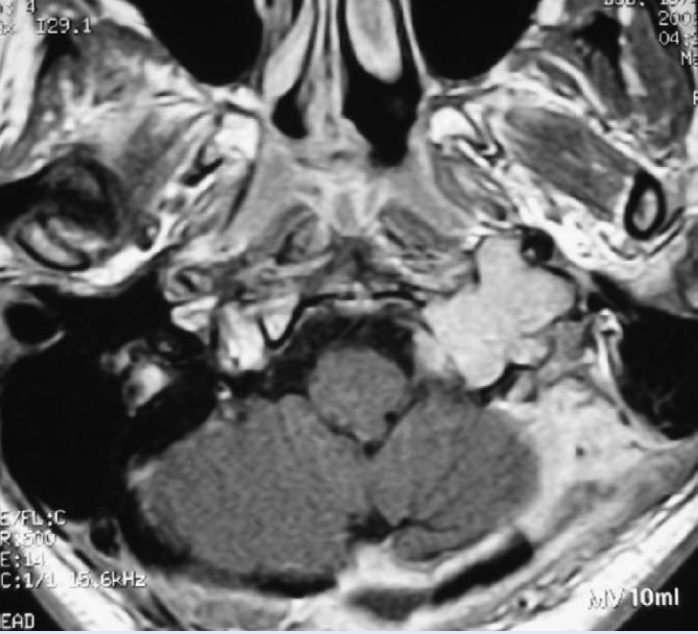
图4. 术后轴位增强T1加权MR图像显示完全切除了舌下神经管内的硬膜内肿块和残留的硬膜外肿块。

图5. 伽玛刀治疗12个月后,轴向对比增强T1加权MR图像显示GKS治疗后微弱的水肿,肿瘤大小缩小。肿瘤边缘剂量13 Gy,其等剂量线为60% [32]。
Suri 等于2014年报道了14例(2001年1月至2010年12月)舌下神经鞘瘤患者接受手术或GKRS治疗后的回顾性临床资料:该研究中,舌萎缩和吞咽困难是最常见的症状,12名患者采用多种方法进行手术,5例因肿瘤残留而接受GKRS,2名肿瘤大小<3cm的患者仅接受了GKRS;平均边缘剂量12-13Gy;GKRS组肿瘤控制率100% (7/7)(其中2名患者达到放射稳定,5名患者获得放射缓解);3名患者手术后发生永久性颅神经麻痹,3名患者术后立即出现脑脊液漏和肺炎等并发症[33]。
本文是王成伟版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论