神经母细胞瘤/神母(neuroblastoma,NB)-的小剂量节拍化疗-端午安康
以亲情服务,用爱心施术
-儿童肿瘤放疗大夫-曾辉博士
2022-06-03

2022-06-03 端午节
https://www.haodf.com/neirong/wenzhang/9384706100.html
曾辉博士在301医院参加TOMO临床培训

神经母细胞瘤/神母(neuroblastoma,NB)的-低剂量化疗/节拍化疗-研究进展
https://station.haodf.com/health/article?healthId=8618325133&articleId=9388823080
神经母细胞瘤的小剂量节拍化疗
一、小剂量节拍化疗的定义
小剂量节拍化疗是由Folkman以及Hanahan在2000年首次提出的,指的是对传统化疗药物在剂量以及摄入方案方面进行革新,这种方法具有间接诱导抗肿瘤效果,以抗肿瘤血管生成为主要作用机制。长时间、频繁(大多是每天一次或者每3天一次,没有无药间歇期)、规律地根据个体化情况对患者使用(通常是口服)化疗药物,低于最大耐受剂量(通常为常规剂量的1/10~1/3),几乎没有药物毒性的特点,而且能够显著改善患者的预后。这种临床上使用的化疗方案与大多数传统化疗方法(大剂量摄人化疗药物,伴随一个较长时间的间歇期,大约3周左右,这种间歇期对于急性骨髓抑制的恢复是非常有必要的)有着本质的不同。
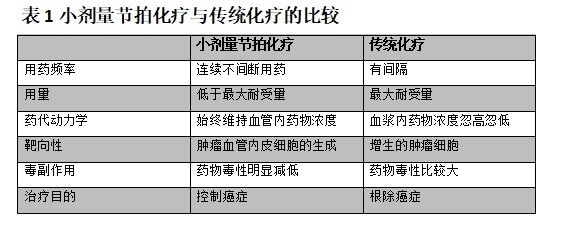
二、小剂量节拍化疗与传统最大耐受剂量化疗比较
传统化疗主要是利用最大耐受剂量细胞毒性药物来直接抑制并且快速 杀死肿瘤细胞从而达到治疗肿瘤的目的,通常会有一个骨髓恢复的间歇期。然而,随着我们对肿瘤细胞的分子基础的了解,我们也充分认识到传统化疗的局限性了。首先,大多数的实体瘤是一个多基因异常的结果,通常伴随着肿瘤细胞不同的单细胞动力学、血管生成性、侵袭性和转移特性。因此,即使是患有相同组织学类型的患者,他们对化疗药物的反应性也是不一样的。其次,经过不同时期肿瘤细胞敏感性的改变,使得肿瘤细胞对化疗药物产生耐药最终引起DNA分子的破坏以及复制的紊乱。另外,相比较转移性肿瘤来说,传统化疗对原发肿瘤更加敏感。然而,肿瘤的转移常常是癌症相关死亡的主要原因。小剂量节拍性化疗主要是利用低于耐受剂量的化疗药物,使得血液维持低浓度的化疗药物而不伴随明显的毒副作用,没有长时间的无药间隔期,因此,小剂量节拍化疗与传统化疗的不同之处主要在于用药频率药代动力学、靶向性以及对患者的毒副作用(如表1所示)。
三、小剂量节拍化疗的药效学与药代动力学原理
化疗药物的反应包括化疗药物的作用方式以及作用特点千差万别,因此,将化疗药物的药效学与药代动力学特点结合起来,总的来说,揭示化疗药物在任何剂量下的反应关系,从而为临床用药提供更加精确的指导。通常是根据观察小剂量环磷酰胺处理的大鼠体内激活状态的环磷酰胺(4-羟基-环磷酰胺)的浓度,监测肝脏以及肿瘤中参与环磷酰胺生物转化的酶的活性,从而评估药物代谢的情况。Emmenegger 等发现,连续8周小剂量给予小鼠环磷酰胺[20mg/(kg·d)]活化的环磷酰胺,通过气相色谱分析/质谱法监测发现,小鼠体内的4羟基-环磷酰胺的浓度在第1周和第8周几乎在一个水平,相比较治疗之前变化竟达到10倍以上。并且在这同一实验中,4-羟基-环磷酰胺的浓度几乎是一样的,这表示持续的小剂量摄人环磷酰胺能够一直刺激机体从 而使活化的环磷酰胺维持在一个非常 稳定的水平。另外,Klink等也发现通过口服小剂量的曲洛磷胺能够抑制人的脐部的血管内皮细胞的增殖,血中的曲洛磷胺代谢物(4-羟基-曲洛磷胺)的浓度也是维持在一个稳定的浓度。Zhou等在另外一项研究中也发现给予小鼠小剂量的化疗药,小鼠的血浆以及肿瘤中的烷化剂的水平在第1天和第28天的水平几乎是一样的。总的来说,在长时间的小剂量化疗过程中,环磷酰胺的生物学效应一直维持在一个稳定的水平。这一发现为临床上的小剂量个性化提供重要的指导意见。
四、小剂量节拍化疗抑制肿瘤的生长的机制
小剂量节拍化疗能够抑制肿瘤血管内皮细胞的生长。1971 年,Judah Folkman医师就提出肿瘤血管生成的假说“在实体瘤中,没有血管的情况下,肿瘤大小只能维持在2-3mm3,主要是氧及营养物质不能弥散到肿瘤中从而限制肿瘤大小”。肿瘤的血管再生其实是肿瘤诱导的新血管生成从而继续生长播散。 它的肿瘤介导的血管再生模型主要包括以下几个方面:首先,生长中的肿瘤需要丰富的血供来运输氧和营养物质,并且清除代谢废物;其次,肿瘤细胞在遗传上具有不稳定性,而且能够快速突变从而克服药物治疗;另外,新血管形成是肿瘤进一步生长和转移的先决条件,这一过程受到大量的促血管血管子以及抗血管生成因子的调控,因此,要想维持长时间的肿瘤抑制,我们必须抑制新生血管的形成。自从Judah Folkman医师提出该假设之后,许多血管形成的信号通路被发掘出来,从而为临床治疗提供了非常好的新的治疗方向。现在许许多多的新发明的药物都主要专注于抑制肿瘤血管的形成,如改变血管内皮细胞生长因子、改变血管形成时的微环境或者直接攻击血管形成相关的细胞。另外,加拿大多伦多大学学者Kerbel发现采用小剂量化疗其实质是抗肿瘤血管生成,也叫抗肿瘤血管生成化疗(anti-angiogenesischemotherap)。Kieran等发现口服抗血管生成的化疗药能够显著延长复发患儿以及进展期的癌症患儿的生存期。另外,Naganuma等发现,相比较单药而言,联合抗血管生成药物TNP-470和去氧氟尿苷能够显著抑制小鼠子宫肿瘤的生长。而且,小剂量的拓扑替康联合帕唑帕尼的化疗方案,能够显著增加其抗肿瘤的效果。
小剂量节拍化疗促进肿瘤血管内皮细胞的凋亡,抑制肿瘤的生长。2000年,实验室学者Browder在动物实验中首次发现常规用于肿瘤的化疗药物,在较低剂量和较高频率给药的模式下,不仅能够更加有效地促进肿瘤组织中的血管内皮细胞凋亡,而且还可以显著促进癌灶肿瘤细胞的凋亡,有着更长时间的抑制肿瘤生长的作用。即使肿瘤细胞已经对该化疗药物耐药,也可达到使肿瘤消失的目的。较长时间的使用小剂量的化疗药不仅能够快速杀死肿瘤中正在分裂的血管内皮细胞。而且能够诱导细胞的调亡(句括已经发生耐药的肿瘤细胞)
小剂量节拍化疗能够诱导肿瘤休眠。肿瘤休眠通常会发生在两个时期,首先是在癌灶形成初期,肿瘤细胞常常处于休眠,直到原始血管形成,它们会开始分裂增殖。其次就是抗肿瘤治疗完成的阶段,这些肿瘤细胞会处于休眠状态,直到再次复发。休眠期常常伴随着细胞周期的停滞或者是癌细胞的增殖与凋亡达到平衡的时候。而小剂量节拍化疗不仅能够抑制肿瘤血管生成引起癌细胞凋亡,还能够刺激免疫系统的监视,从而达到促使肿瘤休眠的作用。
小剂量节拍化疗能够调节肿瘤的微环境。肿瘤的发生和转移与肿瘤细胞所处的内外环境有着密切关系。它不仅包括肿瘤所在组织的结构、功能和代谢,而且亦与肿瘤细胞自身的(核和胞质)内在环境有关。肿瘤细胞可以通过自分泌和旁分泌,改变和维持自身生存和发展的条件,促进肿瘤的生长和发展。全身和局部组织亦可通过代谢、分泌、免疫、结构和功能的改变,限制神经母细胞瘤生长的作用。另外,小剂量伊马替尼联合多柔比星可以促进神经母细胞瘤细胞的G2/M期和S期停滞,并且能够促进细胞的凋亡,而且,在成瘤小鼠体内,小剂量伊马替尼联合多柔比星治疗,能够显著抑制小鼠体内种植的神经母细胞瘤的生长。Mandl等发现对于那些MYC-N过度表达的神经母细胞瘤的小鼠来说,长期小剂量给予拓扑替康能够导致细胞周期的停滞及原发性神经母细胞系的衰老,诱导DNA双链的断裂,抑制MYC-N的表达,延长种植瘤小鼠的生存期。Russell 等在唑来膦酸联合小剂量环磷酰胺治疗复发的神经母细胞瘤的一期临床研究中发现这种疗法有着很好的耐受与生物学反应。Gao等在一项临床研究中发现坚持小剂量长春新碱、阿糖胞苷、环磷酰胺以及足叶乙苷等联合用药持续4周,对于很好的缓解组患者:原发肿瘤缩减达到90%-99%,部分缓解的患者:原发肿瘤缩减509%-90%。并原现小剂量化疗是神母患儿的一个独立于后影响因素。完整疗程的小剂量化疗组1年及3年生存率均明显高于中途治疗组(86.9% vs 76.9%,68.9% vs40.8%)(P=0.026),完整疗程的小剂量化疗是其保护因素,可将死亡风险降低28%(RR=0.28)
六、小剂量节拍化疗的毒副作用
根据大量的成年人以及小孩的临床资料显示,小剂量节拍化疗是非常安全而且很方便的,在临床上各种治疗方案中,它是经济实用的治疗方案。高级别的毒副作用是非常罕见的,最常见的毒副作用主要是1度的恶心呕吐或者是1~2度的贫血、中性粒细胞、白细胞以及淋巴细胞的减少。然而,由于资料不足,还不能给出明确的结论,也不能排除机体的耐受。总的来说,低剂量节拍化疗能够提供最显著的临床治疗效果和最低的毒副作用,并且能够改善进展期以及复发患者的生存预后。另外,有两例长期小剂量替莫唑胺节拍化疗的患者出现了继发性的白血病。然而,它的疗效是有目共睹的,而且出现继发性的白血病这样的副作用是非常罕见的。
总而言之,无论是实验室研究还是临床研究,我们都发现小剂量节拍化疗都是一个非常有效的治疗各种癌症的新的方法思路,但是其中的一些具体机 制还不是很清楚,还需要我们更深一步的研究 ,而且小剂量化疗在治疗小儿神 经母细胞瘤的药效学以及药代动力学还需要进一步的研究,以便于为临床治疗提供更加准确的方案,改善神经母细胞瘤患者的预后。
本文是曾辉版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论