
dMMR结直肠癌免疫治疗进展
原创 点击关注→ 大道至检e课堂 2022
dMMR
结直肠癌
我国是结直肠癌高发国家,根据Global Cancer 2020年数据,全球结直肠癌新发病例约为193万,死亡病例约为93万,而我国结直肠癌发病率位居第2位,新发病例约55万人,死亡率位居第4位1。自从2020年KEYNOTE-177将免疫治疗带入dMMR晚期结直肠癌一线治疗开始,免疫治疗已成为结直肠癌诊疗中非常重要的方案,提高了患者生存获益。接下来我们就盘点一下dMMR结直肠癌的一些治疗进展。
错配修复系统及其机制
MMR(Mismatch Repair)系统是机体内DNA修复机制的一种重要形式,主要作用为防止基因突变、维持基因组稳定性和DNA复制高保真。当MMR基因出现缺陷时,引起细胞DNA错配修复功能丧失,导致自发突变频率增加,癌基因、抑癌基因及肿瘤相关基因突变积累。MMR系统既非癌基因,也非抑癌基因,是另一类肿瘤相关基因2。
MMR基因功能主要靠蛋白质来完成,每个蛋白质有同源类似物,人类的主要为MutS和MutL。MutS主要由MSH2+其他一个同源类似物(MSH6或MSH3)组成,MutL由MLH1+其他一个同源类似物(PMS2、MLH3或PMS1)组成。基因所编码的错配修复蛋白可相互作用形成一种多聚复合物,MutS异二聚体主要识别并结合到DNA链的错配区,MutL异二聚体主要在ATP作用下修复DNA错配3(图1)。
图1. MMR基因修复机制(图片来源于参考文献3)
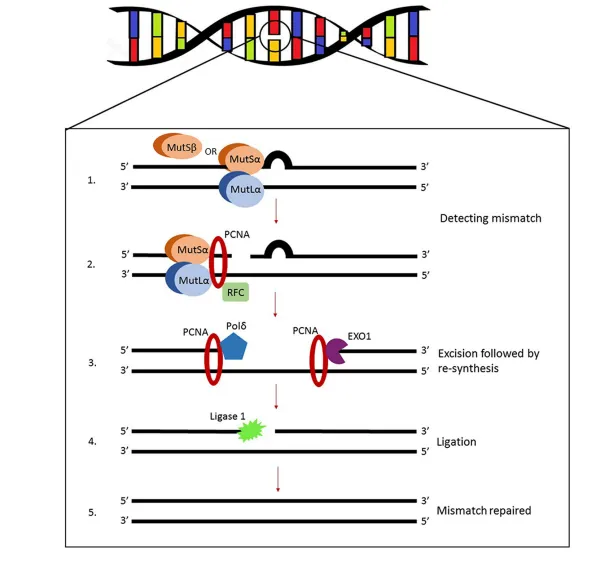
当MMR基因出现缺陷,则引起MMR功能缺陷,导致MMR蛋白表达缺失,称为dMMR(Deficient mismatch repair)。另一方面,当MMR修复功能缺失,导致DNA短重复序列的插入或缺失,称为微卫星不稳定(microsatellite instability, MSI)。dMMR与MSI均可反应MMR基因状态,两者分别使用IHC及PCR技术进行检测。
MMR与结直肠癌
MMR对于结直肠癌的临床价值主要表现在3个方面:1. Lynch综合征的筛查与诊断。2. 免疫治疗生物标志物。3. 指导治疗方案的选择:dMMR/MSI-H Ⅱ期结直肠癌患者对5 Fu产生耐药,dMMR/MSI-H Ⅱ期结直肠癌术后可不用化疗。不同分期的结直肠癌dMMR亚型占比不同,在Ⅱ期结直肠癌患者中检测到约5%~20%,Ⅲ期为11%,Ⅳ期仅为5%4、5。
dMMR晚期结直肠癌免疫
治疗进展
一线治疗
Keynote177开启了dMMR结直肠癌一线免疫治疗的新篇章,该研究是多中心、国际性、开放标签的Ⅲ期研究,在23个国家的193个研究中心进行;入组标准为:MSI-H/dMMR Ⅳ期结直肠癌;允许患者接受过针对结直肠癌的辅助化疗,但前提是完成时间距离随机分组至少6个月等。研究共计852例患者接受了筛选,307人被随机分配接受帕博利珠单抗治疗(153例患者)或标准化疗(154例患者);研究主要终点为PFS和OS,次要终点为ORR。实验结果表明:帕博利珠单抗组中位PFS为16.5个月(95%CI,5.4to32.4)vs化疗组8.2个月(95%CI,6.1to 10.2),ORR率分别为43.8%和33.1%。帕博利珠单抗较化疗组PFS2(PFS2为下一次治疗中,从随机化到疾病进展的时间)显著延长, 中位54.0个月 (95%CI 44·4–NR)vs中位24.9个月 (95%CI 16.6–32.6); HR0·61 (95%CI 0·44–0·83); p=0·0008 6。基于该研究,2021年6月15日,国家药监局(NMPA)批准帕博利珠单药用于KRAS、NRAS和BRAF基因均为野生型,不可切除或转移性MSI-H或dMMR结直肠癌患者的一线治疗,标志着国内肠癌治疗领域正式开启了免疫治疗时代。
Checkmate-142 7纳入了组织学确诊转移性结直肠癌、检测确认患者为dMMR/MSI-H型及转移性疾病,其中一线治疗组的方案为纳武利尤单抗+伊匹木单抗,结果显示与对照组相比,双免组的ORR为69% (INV评估) vs 62%(BICR评估)。
HCRN GI14-186 8是一项多中心、单臂、开放标签的Ⅱ期研究,包括一个安全试验队列,没有随机或盲法,探寻帕博利珠单抗联合化疗治疗晚期结直肠癌有效性和安全性(无论MMR状态),结果显示中位PFS为8.8个月。
二线及以后
KYNOTE-016 9是在实体瘤中探寻帕博利珠单抗单药疗效的实验,入组标准为:经治的转移性实体瘤;ECOG:0或1;所有患者需接受过至少1线及以上的治疗;其他癌肿至少接受过1种肿瘤治疗(为dMMR)。实验共分为3组,即:Cohort A: dMMR结直肠腺癌;Cohort B: pMMR 结直肠腺癌;Cohort C: dMMR其他癌肿。主要终点为:免疫相关的ORR及20周免疫相关的PFS率。结果如下:

该实验以其优秀的结果,于2015年荣登新英格兰杂志,并开启了dMMR肿瘤(包括dMMR结直肠癌)的免疫治疗之路。
KEYNOTE-164 10扩大了样本量,共纳入了124名结直肠癌患者,评估帕博利珠单抗在既往接受过治疗、不可切除、局部晚期或转移的MSI-H/dMMR结直肠癌的有效性和安全性。结果显示,≥1线及≥2线的客观缓解率均为33%,中位无进展生存期分别为:4.1个月和2.3个月。中位总生存期分别为未达到和31.4个月。KEYNOTE-164验证了帕博利珠单抗在后线dMMR结直肠癌中的疗效。
CHECKMATE-142 11后线治疗组,后线治疗组主要为纳武利尤单抗及双免联合治疗组,结果显示,纳武利尤单抗组ORR为31.1%,68.9%患者疾病控制超过12周,中位缓解持续时间未达到,34.8%持续反应时间≥12个月。双免联合的ORR为55%。115个患者人群中,78%TMB比基线降低。中位反应时间为2.8个月(1-14个月),94%的患者反应持续时间达到了cutoff,83%的患者对药物的反应持续时间≥6个月。基于该项研究,FDA批准纳武利尤单抗,用于标准化疗后进展的dMMR/MSI-H转移性结直肠癌患者。
dMMR结直肠癌免疫新辅助
治疗进展
结直肠癌新辅助免疫治疗机制
新辅助免疫治疗的目的是增强机体对于肿瘤抗原的整体免疫力,其基础是诱导肿瘤早期T细胞的增殖,并通过靶向原发肿瘤中内源性肿瘤抗原水平的升高来减少T细胞功能的损伤。因此,新辅助免疫治疗能够杀死肿瘤细胞,消除微转移,促进术前降期,提高R0切除率和病理缓解率,降低术后复发率12。
临床研究进展
NICHE13是一项探索性研究,旨在评估调查了非转移结肠癌术前短期应用伊匹木单抗/纳武利尤单抗(联合或不联合塞来昔布)的安全性、可行性、效果以及免疫学相关性。该研究主要纳入Ⅰ-Ⅲ期的结肠腺癌(无论MMR状态),用药方案为伊匹木单抗+纳武利尤单抗,(Group 1)和伊匹木单抗+纳武利尤单抗+塞来昔布(Group 2)。结果显示:所有(20/20)dMMR患者的肿瘤都有病理学反应。19(5%)名患者达到了病理学显著缓解(残留存活肿瘤≤10%),这些患者中12(60%)名患者达到了病理学完全缓解。NICHE研究揭示了免疫治疗在dMMR结直肠癌新辅助治疗中的疗效。基于此,设计了NICHE 2研究。
NICHE 2是研究者发起的非随机、多中心研究,旨在评估纳武利尤单抗联合伊匹木单抗作为新辅助治疗在dMMR局晚期结肠癌患者中的疗效和安全性。2022年ESMO公布了最新的数据,显示:主要病理缓解(定义为术后标本中残留存活肿瘤≤10%,包括原发肿瘤中pCR,但淋巴结中有残留存活肿瘤的肿瘤)率为95%,pCR(原发肿瘤和淋巴结的残留存活肿瘤均为0%)率为67%。在中位随访13.1个月后,没有患者出现疾病复发。通过NICH 1和NICH 2研究,我们看到了免疫治疗在新辅助治疗中的确定疗效,这标志着新辅助免疫治疗有可能成为dMMR结直肠癌的标准治疗方法。
NRG-GI002 14是一项前瞻性的、开放标签的、Ⅱ期随机临床试验,旨在评估全程新辅助治疗用于局部晚期直肠癌的疗效和安全性。研究主要纳入了Ⅱ/Ⅲ期局部晚期直肠癌(LARC),分为对照组和帕博利珠单抗组。结果显示:两组的pCR分别为29.4%和31.9%(P=0.75),临床完全缓解(cCR)分别为13.6%和13.9%(P=0.95)。帕博利珠单抗+放化疗新辅助治疗安全性良好,无预期之外毒性发生,但未能改善患者NAR评分。次要终点(包括PFS和OS)尚未达到。
SUMMARY
总结与展望
免疫检查点抑制剂在肿瘤中的应用非常广泛,自KEYNOTE-177将帕博利珠单抗推至dMMR晚期结直肠癌一线治疗后,免疫检查点抑制剂也开始了在晚期结直肠癌中的辉煌旅程,为更多的患者带来生存获益,同时,研究者们也在不断的向治疗前线探索,以期能在辅助、新辅助治疗中介入免疫检查点抑制剂,从根本上提升患者的生存期。
目前免疫检查点抑制剂在结直肠癌中的成功应用,大部分为dMMR肿瘤,而pMMR肿瘤获益有限,故在临床中,如何精准的区分这两个人群显得至关重要,目前的主要使用的检测方法为IHC或PCR。两者不能相互替代,各有千秋,这对于病理科检测的精准性提出了更高的要求。精准治疗,诊断先行。总之,dMMR结直肠癌的诊疗道路依旧任重道远。
参考文献
1.Zongshou Zheng, Siwei Zhang, Hongmei Zeng, Shaoming Wang, Kexin Sun, Ru Chen, Li Li, Wenqiang Wei, Jie He, Cancer incidence and mortality in China, 2016, Journal of the National Cancer Center, Volume 2, Issue 1, 2022,Pages 1-9.
2.Lahue RS, Au KG, Modrich P. DNA mismatch correction in a defined system. Science. 1989 Jul 14;245(4914):160-4. doi: 10.1126/science.2665076. PMID: 2665076.
3.Pećina-Šlaus N, Kafka A, Salamon I, Bukovac A. Mismatch Repair Pathway, Genome Stability and Cancer. Front Mol Biosci. 2020 Jun 26;7:122. doi: 10.3389/fmolb.2020.00122. PMID: 32671096; PMCID: PMC7332687.
4.Fan A, Wang B, Wang X, Nie Y, Fan D, Zhao X, Lu Y. Immunotherapy in colorectal cancer: current achievements and future perspective. Int J Biol Sci. 2021 Sep 3;17(14):3837-3849. doi: 10.7150/ijbs.64077. PMID: 34671202; PMCID: PMC8495390.
5.Zaanan A, Shi Q, Taieb J, Alberts SR, Meyers JP, Smyrk TC, Julie C, Zawadi A, Tabernero J, Mini E, Goldberg RM, Folprecht G, Van Laethem JL, Le Malicot K, Sargent DJ, Laurent-Puig P, Sinicrope FA. Role of Deficient DNA Mismatch Repair Status in Patients With Stage III Colon Cancer Treated With FOLFOX Adjuvant Chemotherapy: A Pooled Analysis From 2 Randomized Clinical Trials. JAMA Oncol. 2018 Mar 1;4(3):379-383. doi: 10.1001/jamaoncol.2017.2899. PMID: 28983557; PMCID: PMC5784452.
6.Diaz LA Jr, Shiu KK, Kim TW, Jensen BV, Jensen LH, Punt C, Smith D, Garcia-Carbonero R, Benavides M, Gibbs P, de la Fourchardiere C, Rivera F, Elez E, Le DT, Yoshino T, Zhong WY, Fogelman D, Marinello P, Andre T; KEYNOTE-177 Investigators. Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer (KEYNOTE-177): final analysis of a randomised, open-label, phase 3 study. Lancet Oncol. 2022 May;23(5):659-670. doi: 10.1016/S1470-2045(22)00197-8. Epub 2022 Apr 12. PMID: 35427471; PMCID: PMC9533375.
7.Lenz HJ, Van Cutsem E, Luisa Limon M, Wong KYM, Hendlisz A, Aglietta M, García-Alfonso P, Neyns B, Luppi G, Cardin DB, Dragovich T, Shah U, Abdullaev S, Gricar J, Ledeine JM, Overman MJ, Lonardi S. First-Line Nivolumab Plus Low-Dose Ipilimumab for Microsatellite Instability-High/Mismatch Repair-Deficient Metastatic Colorectal Cancer: The Phase II CheckMate 142 Study. J Clin Oncol. 2022 Jan 10;40(2):161-170. doi: 10.1200/JCO.21.01015. Epub 2021 Oct 12. PMID: 34637336.
8.https://clinicaltrials.gov/ct2/show/results/NCT02375672?term=NCT02375672&draw=2&rank=1
9.Le DT, Uram JN, Wang H, Bartlett BR, Kemberling H, Eyring AD, Skora AD, Luber BS, Azad NS, Laheru D, Biedrzycki B, Donehower RC, Zaheer A, Fisher GA, Crocenzi TS, Lee JJ, Duffy SM, Goldberg RM, de la Chapelle A, Koshiji M, Bhaijee F, Huebner T, Hruban RH, Wood LD, Cuka N, Pardoll DM, Papadopoulos N, Kinzler KW, Zhou S, Cornish TC, Taube JM, Anders RA, Eshleman JR, Vogelstein B, Diaz LA Jr. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med. 2015 Jun 25;372(26):2509-20. doi: 10.1056/NEJMoa1500596. Epub 2015 May 30. PMID: 26028255; PMCID: PMC4481136.
10.Le DT, Kim TW, Van Cutsem E, Geva R, Jäger D, Hara H, Burge M, O‘Neil B, Kavan P, Yoshino T, Guimbaud R, Taniguchi H, Elez E, Al-Batran SE, Boland PM, Crocenzi T, Atreya CE, Cui Y, Dai T, Marinello P, Diaz LA Jr, André T. Phase II Open-Label Study of Pembrolizumab in Treatment-Refractory, Microsatellite Instability-High/Mismatch Repair-Deficient Metastatic Colorectal Cancer: KEYNOTE-164. J Clin Oncol. 2020 Jan 1;38(1):11-19. doi: 10.1200/JCO.19.02107. Epub 2019 Nov 14. PMID: 31725351; PMCID: PMC7031958.
11.Overman MJ, Lonardi S, Wong KYM, Lenz HJ, Gelsomino F, Aglietta M, Morse MA, Van Cutsem E, McDermott R, Hill A, Sawyer MB, Hendlisz A, Neyns B, Svrcek M, Moss RA, Ledeine JM, Cao ZA, Kamble S, Kopetz S, André T. Durable Clinical Benefit With Nivolumab Plus Ipilimumab in DNA Mismatch Repair-Deficient/Microsatellite Instability-High Metastatic Colorectal Cancer. J Clin Oncol. 2018 Mar 10;36(8):773-779. doi: 10.1200/JCO.2017.76.9901. Epub 2018 Jan 20. PMID: 29355075.
12.Zhang X, Wu T, Cai X, Dong J, Xia C, Zhou Y, Ding R, Yang R, Tan J, Zhang L, Zhang Y, Wang Y, Dong C, Li Y. Neoadjuvant Immunotherapy for MSI-H/dMMR Locally Advanced Colorectal Cancer: New Strategies and Unveiled Opportunities. Front Immunol. 2022 Mar 17;13:795972. doi: 10.3389/fimmu.2022.795972. PMID: 35371084; PMCID: PMC8968082.
13.Chalabi M, Fanchi LF, Dijkstra KK, Van den Berg JG, Aalbers AG, Sikorska K, Lopez-Yurda M, Grootscholten C, Beets GL, Snaebjornsson P, Maas M, Mertz M, Veninga V, Bounova G, Broeks A, Beets-Tan RG, de Wijkerslooth TR, van Lent AU, Marsman HA, Nuijten E, Kok NF, Kuiper M, Verbeek WH, Kok M, Van Leerdam ME, Schumacher TN, Voest EE, Haanen JB. Neoadjuvant immunotherapy leads to pathological responses in MMR-proficient and MMR-deficient early-stage colon cancers. Nat Med. 2020 Apr;26(4):566-576. doi: 10.1038/s41591-020-0805-8. Epub 2020 Apr 6. PMID: 32251400.
14.Rahma OE, Yothers G, Hong TS, Russell MM, You YN, Parker W, Jacobs SA, Colangelo LH, Lucas PC, Gollub MJ, Hall WA, Kachnic LA, Vijayvergia N, O‘Rourke MA, Faller BA, Valicenti RK, Schefter TE, George S, Kainthla R, Stella PJ, Sigurdson E, Wolmark N, George TJ. Use of Total Neoadjuvant Therapy for Locally Advanced Rectal Cancer: Initial Results From the Pembrolizumab Arm of a Phase 2 Randomized Clinical Trial. JAMA Oncol. 2021 Aug 1;7(8):1225-1230. doi: 10.1001/jamaoncol.2021.1683. Erratum in: JAMA Oncol. 2022 Jul 1;8(7):1073. PMID: 34196693; PMCID: PMC8251652.
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论