 三甲
三甲
肿瘤NTRK融合基因的致病机制以及药物(2023年7月更新)
NTRK(神经营养性酪氨酸激酶)基因融合是目前在全球首个被发现的不区分癌种的可用药基因靶点,NTRK基因也因其融合的罕见和治疗的有效被称为“钻石基因”。本文将介绍NTRK靶点的发现历程、作用机制以及相关药物。深入了解NTRK将有助于我们更好地认识该靶点在疾病治疗中的重要性。
一、NTRK靶点的发现和生理
NTRK是一种神经营养因子受体基因,最初在1982年由Mariano Barbacid团队发现。NTRK基因包括NTRK1、NTRK2和NTRK3三种,分别编码三种TRK蛋白(原肌球蛋白相关激酶)——TRKA、TRKB和TRKC,这三种蛋白较多分布于神经组织中,通过与神经营养因子结合来调节神经元的生长和存活。
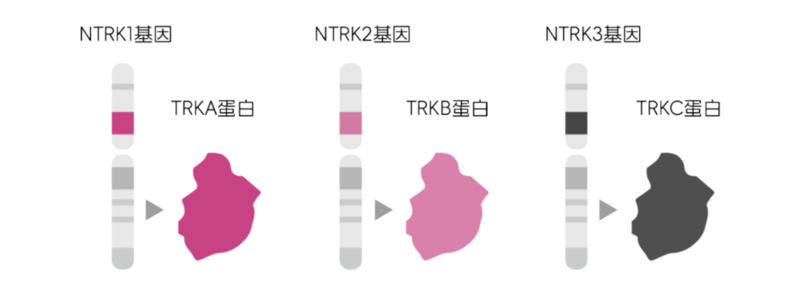
NTRK基因的种类
神经生长因子(NGF)选择性结合TRKA,脑源性生长因子(BDGF)及神经营养因子-4(NT4)选择性结合TRKB,神经营养因子-3(NT3)与三种受体均可结合,但与TRKC的亲和力最高。当TRK受体蛋白与相应配体结合,可通过激活下游信号途径如Ras/MAPK通路、PI3K通路、PLC-γ通路等实现不同生理功能。
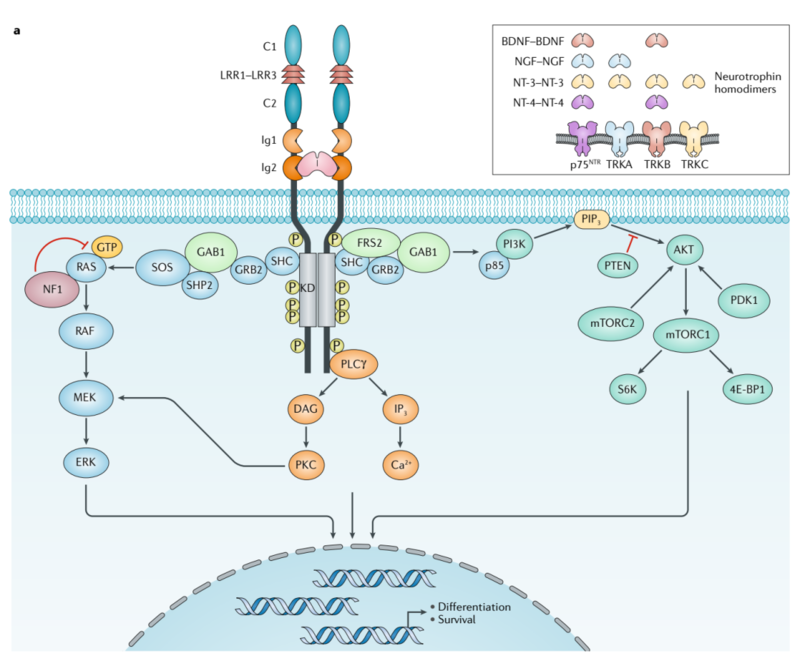
TRKA激活后细胞内部的信号通路
TRKA主要存在于三叉神经、交感神经、背根神经节、前脑和中脑皮层的胆碱能神经元,参与人体痛觉的产生和维持;TRKB在整个中枢神经和周围神经系统中都存在较多,参与情绪和食欲的调节;TRKC主要存在于哺乳动物的神经中枢组织,参与维持本体感觉神经的功能。此外,三种TRK在人体非神经组织中也广泛分布,但表达相较于神经组织存在明显差异。
二、NTRK基因融合的促肿瘤机制
随着对NTRK研究的深入,人们逐渐发现NTRK在多种肿瘤的发展中起着重要的作用。NTRK基因激活的机制包括突变,过表达及基因融合,并涉及NTRK家族的多个成员,其中NTRK基因融合是致癌TRK激活的最常见机制。
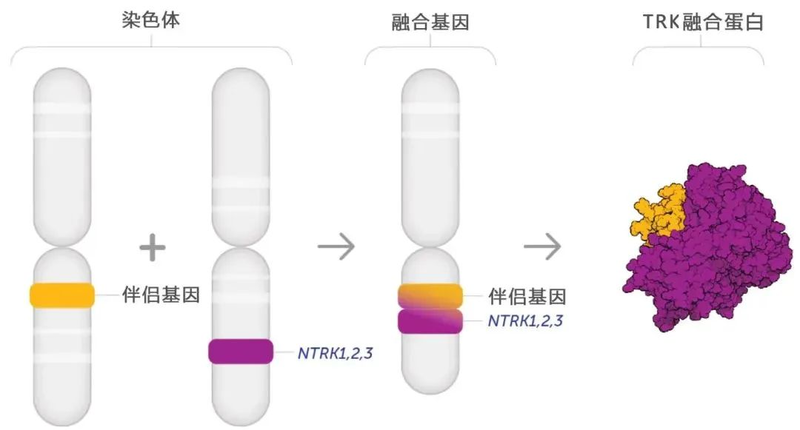
基因融合的具体过程如下图所示(以NTRK1基因与TPM3基因融合为例)
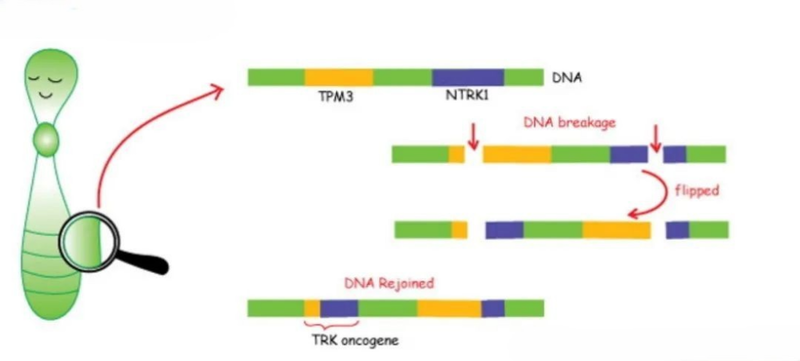
基因断裂和融合的模式图
NTRK融合突变通常为密码子阅读框内突变,基因融合、TRK 激酶结构域的易位、TRK 配体结合位点的突变、NTRK 的扩增等均可导致组成型激活的嵌合TRK融合蛋白,突变后的融合蛋白保留了原始的激酶区域,但是受体结合区域发生改变,异常的TRK蛋白可在无配体存在的情况下持续激活下游的多条信号通路如RAS/MAPK、PI3K/AKT、JAK/STAT等,从而促进肿瘤细胞的增殖和转移。
三、NTRK基因融合的分布
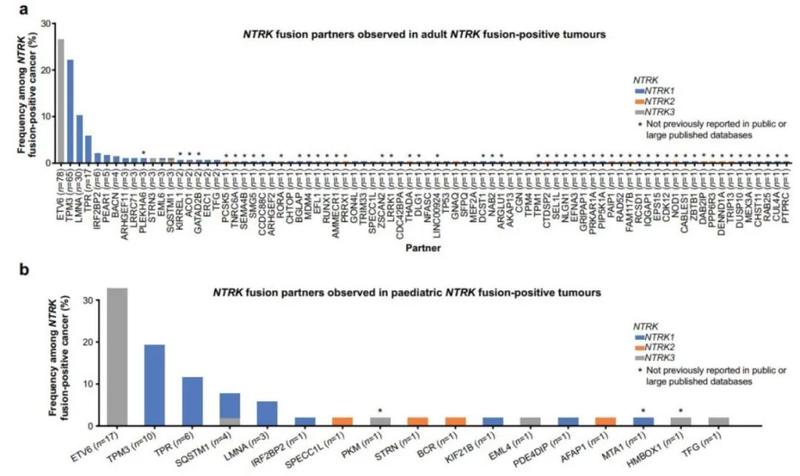
NTRK基因融合有癌种偏好性,多体现在NTRK1、NTRK3融合,少见NTRK2融合。NTRK的伙伴基因众多,其中最常见的类型为ETV6-NTRK3和TPM3-NTRK1。具体的多种融合伙伴如下图,NTRK融合基因的结构代表NTRK基因(灰色)和上游伙伴基因(蓝色的)序列。NTRK1、NTRK2和NTRK3的配对基因分别用蓝色、红色和黄色表示。跨膜结构域的掺入可能会影响融合蛋白的细胞定位。

NTRK常见的融合的5‘上游基因
NTRK融合高度富集的癌症类型,如ETV6-NTRK3融合被认为是分泌性乳腺癌、涎腺分泌性癌、细胞性或混合性先天性中胚层肾瘤和婴儿纤维肉瘤的病因,在特定的患者中其发生率>90%, 因而ETV6-NTRK3也是NTRK最广为人知的融合形式。2021年7月20日《NPJ Precis Oncology》在线发表了超过295,000例癌症病例的NTRK融合阳性癌症的患病率,发现NTRK基因融合阳性患病率为0.30%(n=899);在成人和儿童患者中,最经常观察到的NTRK 融合伙伴均为ETV6。
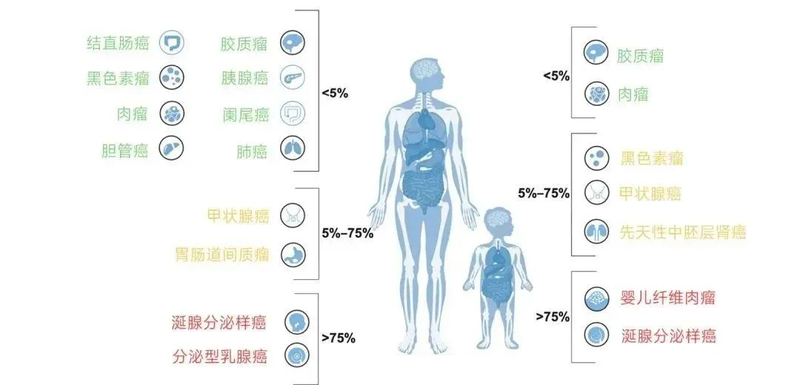
NTRK 融合突变频率低的癌症类型(融合突变频率在5-25%或<5%)包括一些常见肿瘤的罕见亚型(如乳腺癌、肺癌、结直肠癌和黑色素瘤)
NTRK基因融合在所有恶性肿瘤及常见癌症中的发生率较低,但在某些罕见癌症中发生率极高的现象可形象称为“大肿瘤小突变,小肿瘤大突变”。各类指南建议在成人分泌型乳腺癌和涎腺分泌样癌及婴儿纤维肉瘤这几类患者检测NTRK基因。
不同肿瘤中NTRK的融合突变概率
四、NTRK基因融合靶点的药物
NTRK基因融合因为其“广谱性”已成为近年来热门的肿瘤治疗靶点。迄今为止,已上市的药物有拉罗替尼和恩曲替尼两种。
拉罗替尼是第一种获准用于治疗NTRK基因融合实体瘤的口服酪氨酸激酶抑制剂,它适用于所有类型实体瘤,无论其原发位置。拉罗替尼是一种口服的TRK 抑制剂,具有抗肿瘤活性。给药后,拉罗替尼与TRK结合,从而阻止神经营养因子-TRK相互作用和TRK激活,从而诱导肿瘤细胞凋亡和抑制TRK过表达的肿瘤细胞生长。

拉罗替尼抑制图中P点
拉罗替尼的不良反应有疲劳、恶心、呕吐、头晕、咳嗽、便秘、腹痛及天冬氨酸转移酶(AST)和丙氨酸转移酶(ALT)升高,少量患者可能出现发热、腹泻、脓血症和脱水等严重不良反应。此外,拉罗替尼对胎儿可能有致命副作用,建议患者避免在怀孕或哺乳期服用。临床试验表明拉罗替尼对分泌性乳腺癌、唾液腺分泌癌和婴儿纤维肉瘤疗效较好。
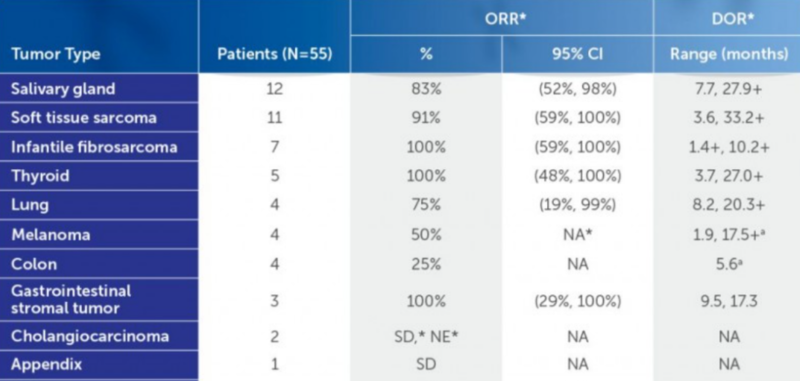
拉罗替尼的临床研究ORR数据
恩曲替尼是靶向ALK(间变性淋巴瘤激酶)、ROS1和NTRK基因融合的激酶抑制剂,通过与ATP竞争结合位点实现抑制激酶催化活性,从而达到抑制肿瘤的治疗作用,对ALK,ROS1和NTRK基因融合的晚期或转移性肿瘤具有强大的抗癌潜力。相较于拉罗替尼,恩曲替尼可作用于更多靶点,且可透过血脑屏障,没有不良的脱靶活性。恩曲替尼的主要适应症包括乳腺癌、胆管癌、结直肠癌、妇科癌、神经内分泌肿瘤、NSCLC、唾液腺癌、胰腺癌、肉瘤和甲状腺癌等实体肿瘤。恩曲替尼的不良反应有疲劳、便秘、味觉障碍、水肿、头晕、腹泻、恶心、感觉迟钝、呼吸困难、疼痛、贫血、认知障碍、体重增加、呕吐、咳嗽、血肌酐增加、关节痛、发热和肌痛。相关临床试验表明恩曲替尼对颅内病灶的缓解率高达100%,针对ALK阳性的肺癌患者有效率达到57%。
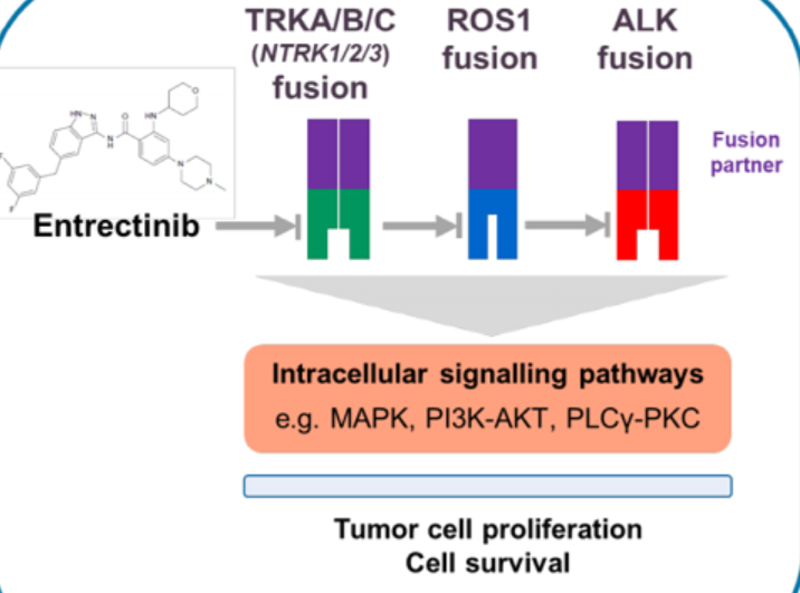
恩曲替尼具有多个靶点
拉罗替尼和恩曲替尼均为我国2022年上市的药物,以其广谱和有效为罕见的NTRK基因融合赋予“钻石基因”的称号,也标志着我国肿瘤精准医学治疗由基于肿瘤组织学分子特征转为靶向生物标志物的驱动。此外,该靶点尚未上市的在研药物包括瑞波替尼和他雷替尼均已在临床试验阶段取得卓越的数据。我们有理由相信这一靶点将会涌现越来越多的抗癌“猛将”,未来可期!
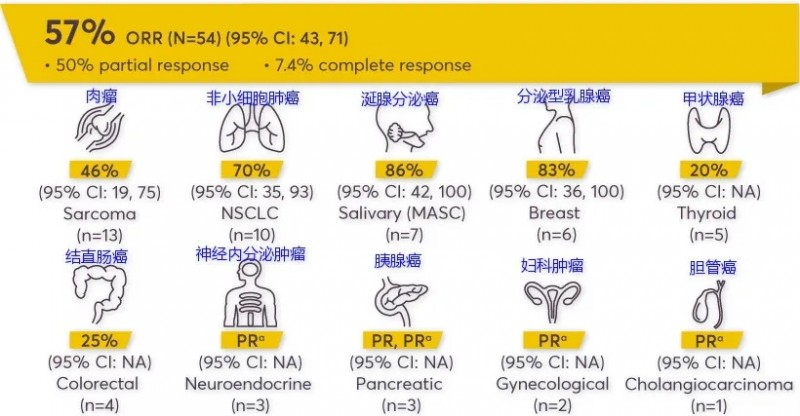
恩曲替尼在各类实体瘤中的有效率
最后,特别感谢八年制师弟:余越洋,帮助整理资料。
本文是沈露俊版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论