
一例RAS野生、dMMR左半结肠癌患者的诊治经过分享
原创 医悦汇
在临床真实世界对医师最有启发意义的就是病例分享,面对千变万化的病人如果能够抓住临床诊治的核心,那么万变不离其宗,病人是否获得良好的长期生存,往往就在医师的一个关键选择,因此作为肿瘤临床医师不断学习最新知识,不断总结临床经验,用心细致分析病情变化极为重要。我们消化肿瘤团队病床数达到200张,每年收治消化肿瘤1500人次,为我省消化肿瘤病人解除病痛努力拚博,获得广泛好评。本期病例分享,青年医师不约而同选择了自己行医历程中印象深刻的,给病人带来较好疗效的成功病例,我们看到从掌握基础知识出发,推理临床实践和应用,在多线治疗病情仍然进展危害病人生命时,尽可能根据精准医学指导,选择最新的免疫治疗或靶向治疗,使病人峰回路转柳暗花明重获新生。
正文如下
摘要
免疫检查点抑制剂的出现为晚期结直肠癌患者的治疗带来了新的希望。在转移性结直肠癌患者中,高度微卫星不稳定(high microsatellite instability,MSI-H)/DNA错配修复缺陷(mismatch repair defect,dMMR)人群占有5%,MSI-H/dMMR患者是免疫治疗的“敏感人群”。国内外权威指南推荐PD-1单抗单药可有效用于MSI-H/dMMR转移性结直肠癌患者的治疗,但如何进一步提高MSI-H/dMMR患者的疗效和预后仍值得进一步探讨。本文介绍1例RAS野生、dMMR的左半结肠癌患者,经过多线化疗及靶向治疗进展后,四线治疗给予信迪利单抗联合贝伐珠单抗取得了令人惊喜的肿瘤退缩效果,病灶完全消失,持续CR(完全缓解)中,PFS(疾病无进展时间)已经超过17个月,且不良反应轻。本例报道提示,在晚期结直肠癌的治疗中,应结合二代测序基因检测和多学科讨论,为患者争取最合适的治疗,以取得较长的疾病控制时间和长期的生存获益。
前言
结直肠癌在全球范围带来沉重的疾病负担,据估算,2018 年全球有近185万例患者新发结直肠癌,有88万例患者因结直肠癌导致死亡。中国新发结直肠癌病例数超过52万,结直肠癌严重危害我国居民健康[1]。超过半数结直肠癌患者在诊断时已为晚期(Ⅲ~Ⅳ期)[2,3],预后不佳,存在远处转移的患者5年总生存率(overall survival,OS)<15%[4]。近年来免疫检查点抑制剂(immune checkpoint inhibitors,ICI)在多种恶性肿瘤的治疗中取得了突破性的进展,包括晚期结直肠癌。免疫治疗成为继传统放化疗、靶向治疗之后能为肿瘤患者带来生存新希望的重要治疗手段。目前已有3种免疫检查点抑制剂(PD-1抑制剂纳武利尤单抗和帕博利珠单抗、CTLA-4抑制剂ipilimumab)在美国食品和药品监督管理局(FDA)获批用于MSI-H/dMMR转移性结直肠癌的治疗。如何采用免疫联合治疗方案进一步提高MSI-H/dMMR的晚期结直肠癌患者的疗效是未来的研究重点和方向。
病例介绍
初步诊断
患者男性,61岁,身高167cm,体重 63kg,美国东部肿瘤协作组(Eastern Cooperative oncology Group,ECOG)体能状况评分(performance score,PS)0分。因腹胀腹痛1月余至南昌大学第一附属医院就诊,无其他不适。吸烟史1包/天,20多年,既往体健,无糖尿病及高血压等慢性疾病,否认家族肿瘤病史。完善术前影像学等检查示降结肠占位,累及浆膜层伴周围淋巴结转移。于2019年11月行机器人辅助下根治性左半结肠癌切除术,术后病理示:(左半结肠)粘液腺癌,侵及全层,溃疡型,肠旁淋巴结21枚,其中2枚可见癌转移(2/21)。免疫组化示:CerbB2(30% 2+),MLH1(70% 2+),MSH2(-),MSH6(-),PMS2(90% 2+)。初诊诊断为:(左半结肠)腺癌,T4N1M0,IIIB期,dMMR。
第一次手术后复发
2019年8月至12月期间行6周期XELOX方案化疗。辅助化疗接近结束之前,患者出现腹痛腹胀及呕吐等肠梗阻症状,复查影像学CT示肿瘤复发(图1)。为缓解患者梗阻情况,经过多学科讨论外科评估后于2020年1月再次行局部手术切除(腹腔镜下空肠肿瘤切除术+膈肌修补术),术后病理示:(空肠)低分化腺癌,部分为粘液腺癌,肿瘤由浆膜层侵及粘膜层,结合病史考虑结肠来源。(两切断)未见癌累及。手术后,患者的梗阻缓解,腹痛症状较前好转。
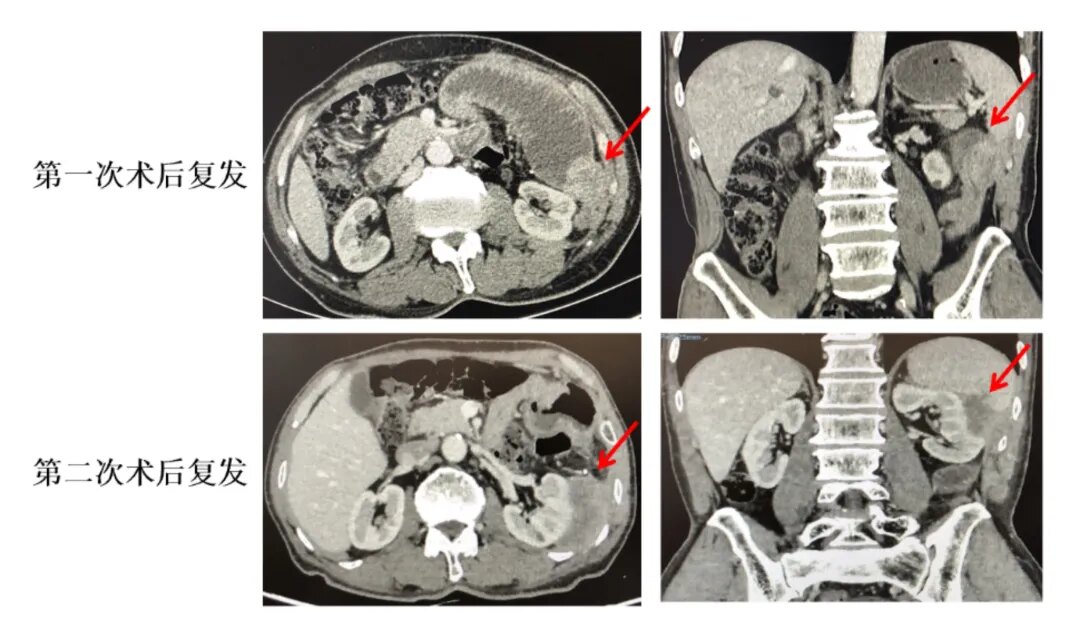
图1:患者第一次术后复发和第二次术后复查(影像学资料)
第二次手术后复发
鉴于患者第一次术后辅助治疗期间出现疾病进展,因此第二次术后更改为FOLFIRI方案。1周期化疗后,患者手术区疼痛明显加重,复查影像提示肿瘤再次复发,肿瘤与周围组织无间隙(图1)。复发转移灶NGS检测基因特征:KRAS/NRAS野生、BRAF野生、HER2突变、dMMR、NTRK1突变(图2)。三线治疗予以伊立替康、雷替曲塞联合西妥昔单抗治疗,2周期后复查CT示SD(病灶较前稍增大,图3),但患者疼痛未见缓解,明显加重。
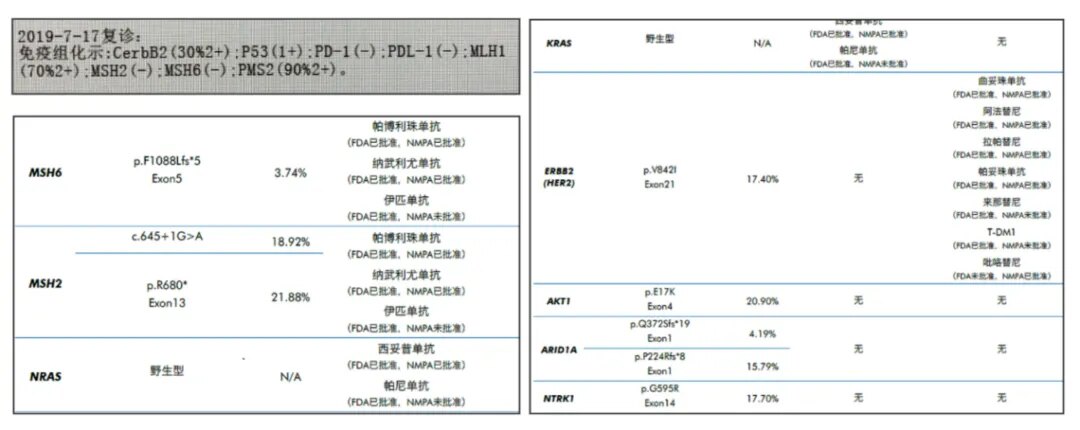
图2:复发转移灶NGS基因检测结果
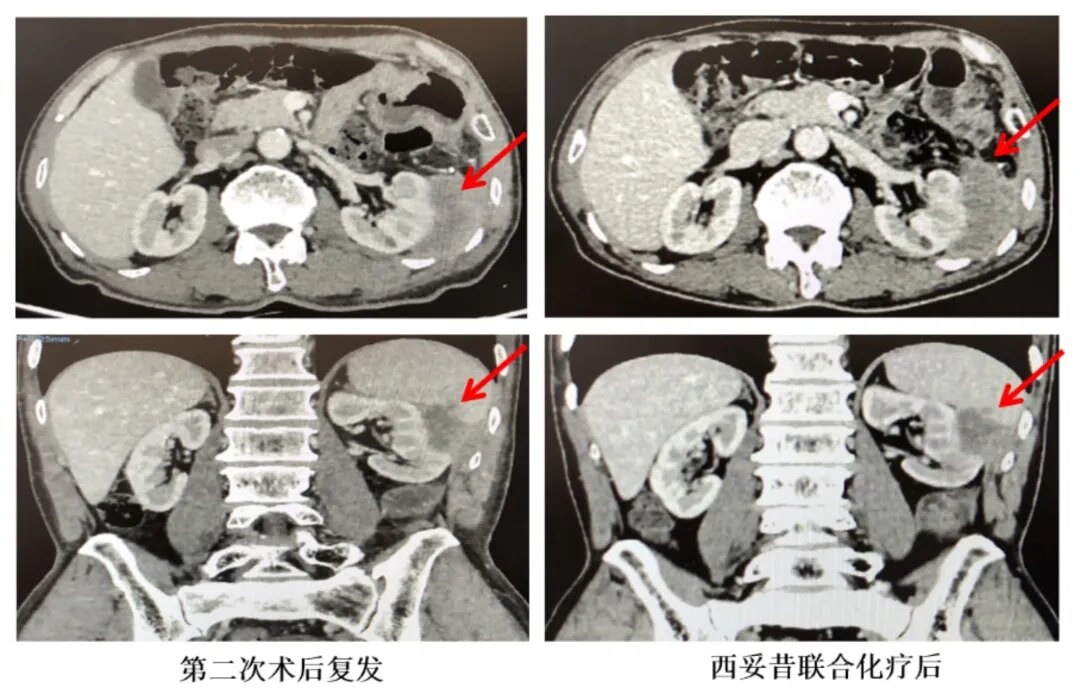
图3:患者第二次术后复发和西妥昔单抗联合化疗治疗后(影像学资料)
后线治疗
再次回顾患者的基因检测结果示该结肠癌患者为dMMR,根据国内外权威指南推荐,并与患者充分沟通后,2020年4月给予患者的四线治疗方案为:信迪利单抗(200mg)联合贝伐珠单抗(400mg)。2周期后,患者诉疼痛明显缓解,影像复查为PR(部分缓解)。截止2021年9月,患者已接受信迪利单抗联合贝伐珠单抗治疗21周期,病灶完全消失,持续CR中(完全缓解,详见图4)。这位RAS野生、dMMR晚期左半结肠癌患者采用免疫治疗联合抗血管靶向取得了非常好的肿瘤退缩效果,肿瘤持续得到缓解,疼痛症状消失,生活质量好。用药期间的不良反应主要为:轻度皮疹、鼻出血等,对症治疗后减轻可耐受。
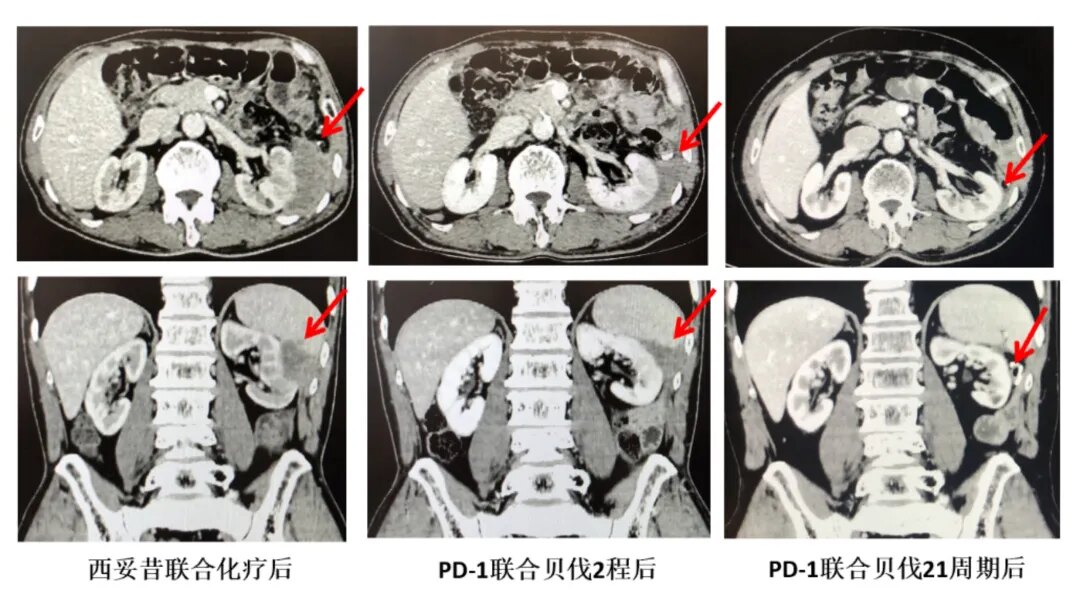
图4:患者接受免疫联合贝伐珠单抗治疗2周期及21周期后复查(影像学资料)
讨论
既往MOSAIC研究中结肠癌术后辅助化疗的五年DFS率是58.9%-66.4%[5]。很遗憾,这位患者在术后1年内出现瘤床复发并出现梗阻,MDT会诊讨论后考虑该患者为寡病灶复发,于2020年1月再次局部手术切除,同时行复发病灶的NGS测序结果示:KRAS/NRAS/BRAF全野生型、HER2突变、dMMR、NTRK1突变。因该患者在术后1年内出现肿瘤迅速进展复发,术后辅助化疗XELOX方案则作为一线治疗。二线治疗更改为FORFIRI方案后疾病再次进展。患者既往未使用过西妥昔单抗,三线治疗选择伊立替康、雷替曲塞联合西妥昔单抗,2周期后肿瘤仍有增大。这位dMMR的晚期结直肠癌患者,既往多次化疗及靶向治疗都快速进展,疗效差,后线治疗应如何选择呢?
近年来,免疫治疗的快速发展为晚期结直肠癌(metastatic colorectal cancer,mCRC)的治疗取得了突破性的进展。基于Keynote-164[6]和Keynote-158[7]研究,帕博利珠单抗能给经治的MSI-H/dMMR晚期结直肠癌患者带来33%的客观缓解率(ORR),并且有长期生存获益的趋势。此外,Checkmate 142研究[8]发现,多线治疗失败后的MSI-H/dMMR晚期结直肠癌患者接受纳武利尤单抗治疗后,达到客观缓解的患者有34.8%,持续缓解时间超过12个月。从2017年起,NCCN指南中推荐帕博利珠单抗和纳武利尤单抗为MSI-H/dMMR晚期结直肠癌患者的后线标准治疗。2020年6月的ASCO会议上公布的Keynote-177研究结果,改写了MSI-H/dMMR晚期结直肠癌的一线标准治疗。该研究评估了帕博利珠单抗对比标准治疗一线治疗MSI-H/dMMR晚期结直肠癌的疗效和安全性[9]。结果显示:免疫单药组患者的中位PFS较标准化疗组明显延长(16.5个月 vs 8.2个月,p=0.0002),获得了3年OS率达61%的喜人结果。因此,国内外权威指南一致推荐PD-1抑制剂成为不可切除或转移性MSI-H/dMMR结直肠癌的一线治疗新标准。
目前,MSI-H/dMMR晚期结直肠癌的免疫治疗已经进入了后MSI-H时代,研究者们都在竭力探索如果进一步提高MSI-H人群免疫治疗的疗效,例如选择联合抗血管靶向治疗及局部放疗等。在目前已有的抗血管靶向治疗联合免疫治疗的REGONIVO、REGOTORY、或是肝细胞癌中IMbrave 150、ORIENT-32等[10,11]研究中,“免疫”+“抗血管”联合治疗产生了“1+1>2”的抗肿瘤效果。以上研究结果为我们的临床工作带来了重要启迪。结合该患者的病情,DNA错配修复基因状态为缺失型(dMMR),既往分别在2次手术后短时间内复发进展,患者肿瘤生物学行为较差,因此我们采用了联合治疗的方案,即信迪利单抗(200mg)联合贝伐珠单抗(400mg)。2周期治疗后,患者诉疼痛明显缓解,影像复查为PR。4周期后疼痛症状消失,肿瘤完全缓解(CR),患者目前已接受信迪利单抗联合贝伐珠单抗治疗21周期,病灶完全消失,仍持续CR中,PFS超过17个月。
本例晚期结肠癌患者得益于MDT讨论及精准医学的临床实践,多学科强强联手,造福我们的肠癌患者,两次手术后复发,多次进展,在后线治疗中采用免疫治疗联合抗血管靶向治疗,肿瘤获得完全缓解,且不良反应轻,生活质量好,为患者和临床医生提供了一个优化的治疗选择。针对MSI-H/dMMR的晚期结直肠癌患者,免疫治疗已是金标准,但仍然需要更多的数据,去进一步提高疗效、扩大适应症,进而提高患者的生存期和生活质量。
项晓军、熊建萍点评
该病例有如下特点:1、患者对常规化疗属于原发耐药。患者在两次根治术后,分别采用XELOX方案6周期后、及FOLFIRI方案1周期后即出现复发。2、该患者病变位于左半结肠、且KRAS/NRAS/BRAF野生,但是对于含西妥昔单抗的方案也不敏感。3、本例dMMR型患者接受PD-1单抗联合贝伐单抗作为多线后的治疗方案,获得CR,且17个月后仍持续緩解中。研究表明,合并HER-2过表达的RAS野生型的大肠癌患者易对EGFR单抗产生耐药,但HER-2仅是突变、无HER-2过表达不影响EGFR单抗的疗效。本例患者合并HER-2突变,但未发现扩增、且免疫组化的HER-2表达为2+,西妥昔耐药是否与之相关值得商榷。MSI-H/dMMR可以预测PD-1单抗治疗疗效的优势患者。然而在该人群中,如何识别出其中对PD-1单抗无效的患者,或将PD-1单抗联合其他治疗进一步提高疗效(如在MMS型患者中,将PD-1单抗联合化疗,或抗血管药物、或放疗、或其他免疫药物等),该患者选择免疫联合抗血管治疗模式获得较好疗效值得在更多患者中尝试,也丞待更多研究提供出循证依据。
参考文献
1.Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A: Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018, 68(6):394-424.
2. Li X, Zhou Y, Luo Z, Gu Y, Chen Y, Yang C, Wang J, Xiao S, Sun Q, Qian M, Zhao G: The impact of screening on the survival of colorectal cancer in Shanghai, China: a population based study. BMC Public Health 2019, 19(1):1016.
3. Lee YH, Kung PT, Wang YH, Kuo WY, Kao SL, Tsai WC: Effect of length of time from diagnosis to treatment on colorectal cancer survival: A population-based study. PLoS One 2019, 14(1):e0210465.
4. Asaoka Y, Ijichi H, Koike K: PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med 2015, 373(20):1979.
5. Tournigand C, Andre T, Bonnetain F, Chibaudel B, Lledo G, Hickish T, Tabernero J, Boni C, Bachet JB, Teixeira L, de Gramont A: Adjuvant therapy with fluorouracil and oxaliplatin in stage II and elderly patients (between ages 70 and 75 years) with colon cancer: subgroup analyses of the Multicenter International Study of Oxaliplatin, Fluorouracil, and Leucovorin in the Adjuvant Treatment of Colon Cancer trial. J Clin Oncol 2012, 30(27):3353-3360.
6. Le DT, Kim TW, Van Cutsem E, Geva R, Jager D, Hara H, Burge M, O‘Neil B, Kavan P, Yoshino T, Guimbaud R, Taniguchi H, Elez E, Al-Batran SE, Boland PM, Crocenzi T, Atreya CE, Cui Y, Dai T, Marinello P, Diaz LA, Jr., Andre T: Phase II Open-Label Study of Pembrolizumab in Treatment-Refractory, Microsatellite Instability-High/Mismatch Repair-Deficient Metastatic Colorectal Cancer: KEYNOTE-164. J Clin Oncol 2020, 38(1):11-19.
7. Yap TA, Nakagawa K, Fujimoto N, Kuribayashi K, Guren TK, Calabro L, Shapira-Frommer R, Gao B, Kao S, Matos I, Planchard D, Chatterjee A, Jin F, Norwood K, Kindler HL: Efficacy and safety of pembrolizumab in patients with advanced mesothelioma in the open-label, single-arm, phase 2 KEYNOTE-158 study. Lancet Respir Med 2021, 9(6):613-621.
8. Overman MJ, McDermott R, Leach JL, Lonardi S, Lenz HJ, Morse MA, Desai J, Hill A, Axelson M, Moss RA, Goldberg MV, Cao ZA, Ledeine JM, Maglinte GA, Kopetz S, Andre T: Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study. Lancet Oncol 2017, 18(9):1182-1191.
9. Andre T, Amonkar M, Norquist JM, Shiu KK, Kim TW, Jensen BV, Jensen LH, Punt CJA, Smith D, Garcia-Carbonero R, Sevilla I, De La Fouchardiere C, Rivera F, Elez E, Diaz LA, Jr., Yoshino T, Van Cutsem E, Yang P, Farooqui M, Le DT: Health-related quality of life in patients with microsatellite instability-high or mismatch repair deficient metastatic colorectal cancer treated with first-line pembrolizumab versus chemotherapy (KEYNOTE-177): an open-label, randomised, phase 3 trial. Lancet Oncol 2021, 22(5):665-677.
10. Fukuoka S, Hara H, Takahashi N, Kojima T, Kawazoe A, Asayama M, Yoshii T, Kotani D, Tamura H, Mikamoto Y, Hirano N, Wakabayashi M, Nomura S, Sato A, Kuwata T, Togashi Y, Nishikawa H, Shitara K: Regorafenib Plus Nivolumab in Patients With Advanced Gastric or Colorectal Cancer: An Open-Label, Dose-Escalation, and Dose-Expansion Phase Ib Trial (REGONIVO, EPOC1603). J Clin Oncol 2020, 38(18):2053-2061.
11. Ren Z, Xu J, Bai Y, Xu A, Cang S, Du C, Li Q, Lu Y, Chen Y, Guo Y, Chen Z, Liu B, Jia W, Wu J, Wang J, Shao G, Zhang B, Shan Y, Meng Z, Wu J, Gu S, Yang W, Liu C, Shi X, Gao Z, Yin T, Cui J, Huang M, Xing B, Mao Y, Teng G, Qin Y, Wang J, Xia F, Yin G, Yang Y, Chen M, Wang Y, Zhou H, Fan J, group O-s: Sintilimab plus a bevacizumab biosimilar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT-32): a randomised, open-label, phase 2-3 study. Lancet Oncol 2021, 22(7):977-990.
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论