
高危非肌层浸润性膀胱癌(NMIBC)治疗的破局之道
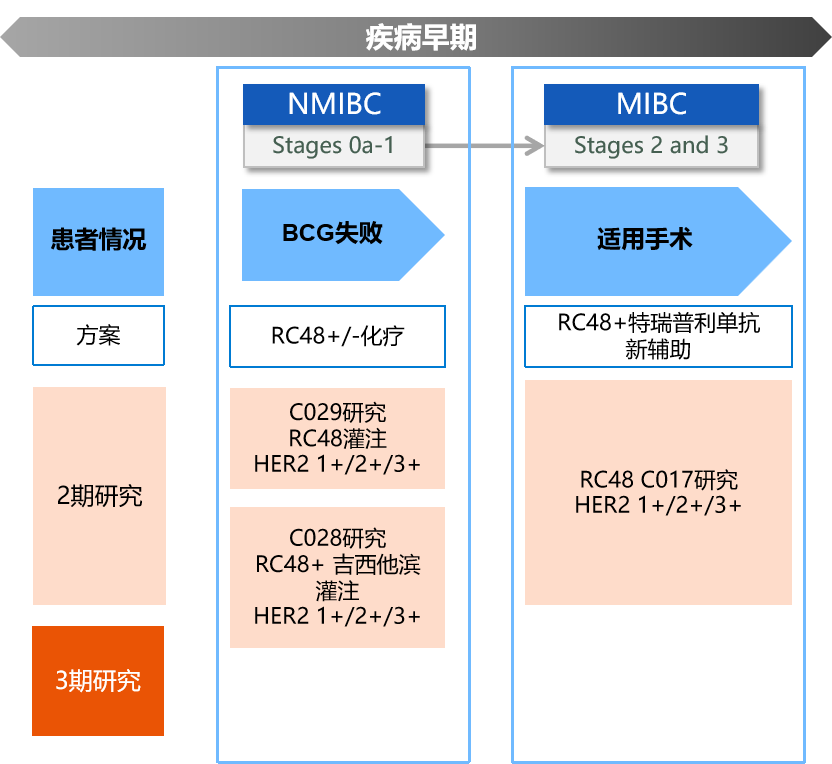
膀胱癌,全球第十大常见恶性肿瘤,其在中国的发病率为5.8/10万[1]。非肌层浸润性膀胱癌(NMIBC)是膀胱癌的一个亚型,它局限于膀胱黏膜层(CIS/CIS、Ta)及固有层(T1),未侵入肌层。初诊患者中,大约75%为NMIBC,其中Ta、T1和CIS分别占70%、20%和10%。虽然Ta和T1都属于NMIBC,但两者的生物学特性显著不同,由于固有层内血管及淋巴管较丰富,T1期更易发生扩散。同时,CIS也易于侵入肌层(见图1)。NMIBC的总体预后相对乐观,高危患者的10年肿瘤特异性生存率也可达70%到85%[2],然而,其5年复发率高达31%至78%[3],对患者和社会造成了重大经济负担。
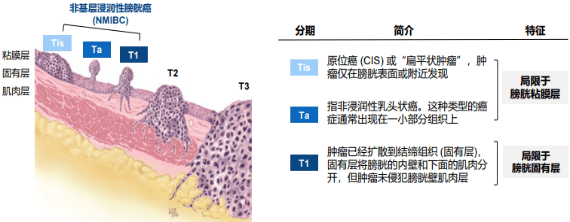
NMIBC的常规治疗方法为经尿道膀胱肿瘤切除术(TURBT),即通过尿道插入一个带有电切环和摄像头的器械,以切除并送检膀胱内肿瘤。TURBT不仅是诊断手段,也是治疗方法。然而,由于NMIBC容易复发和进展,仅依靠TURBT的治疗效果有限,故术后需辅以药物治疗。目前,最有效的辅助药物治疗是卡介苗(BCG)膀胱灌注,即将一种弱化的结核杆菌制剂注入膀胱,以刺激免疫系统对抗肿瘤细胞。BCG灌注能显著降低NMIBC的复发率和进展率,并提高生存率。然而,BCG灌注也存在一定局限性,主要包括:
✔ BCG灌注通常需要多次进行,包括6次诱导治疗和1至3年的维持治疗,这对患者的耐受性和依从性提出了要求。
✔ BCG灌注可能导致不良反应,包括尿频、尿急、尿痛、血尿、发热、寒战等。在严重情况下,可能引起全身感染或结核性关节炎。
✔ 此外,BCG灌注有时可能失效或无反应,即使患者接受了足够剂量和时间的治疗,肿瘤仍可能复发或进展。

如何应对BCG无反应的NMIBC?
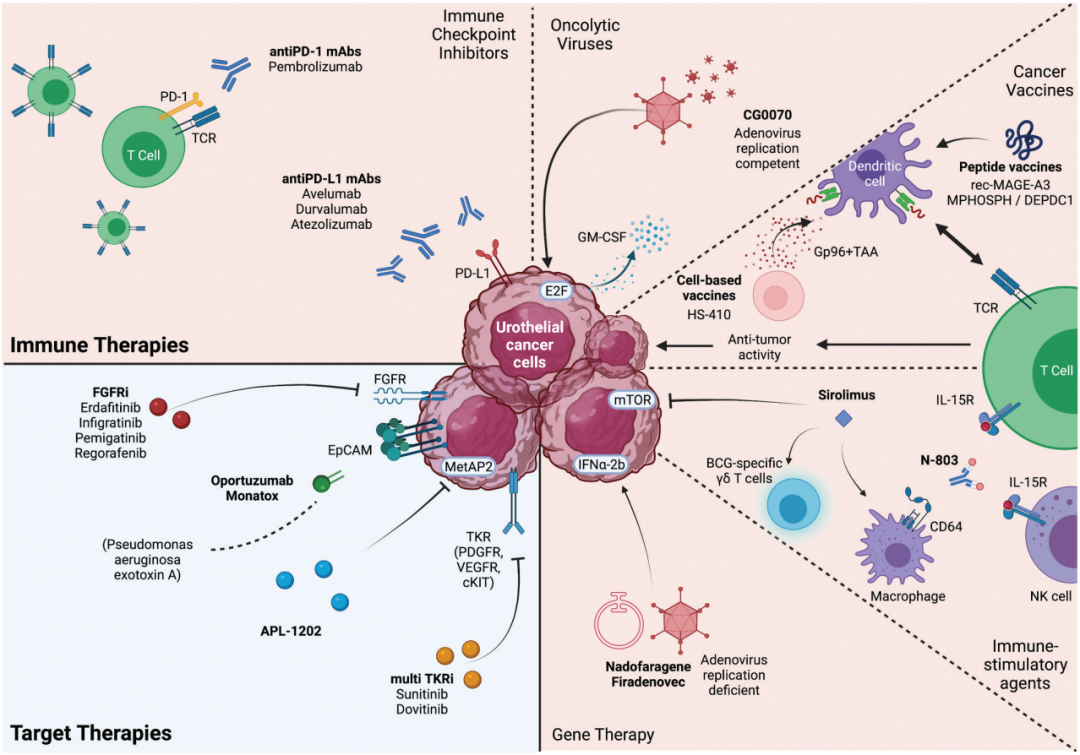
自2016年FDA(美国食品和药物管理局)批准首个免疫检查点抑制剂(CPI)后,免疫治疗已在非肌层浸润性膀胱癌、肌层浸润性膀胱癌以及晚期/转移性膀胱癌治疗中已取得初步成功。此外,随着成纤维细胞生长因子受体(FGFR)抑制剂和抗体偶联药物(ADC)等新型治疗药物的问世,NMIBC治疗领域也迎来了新的希望。因此,本文旨在系统梳理2023年NMIBC治疗的新进展,为NMIBC患者的局部和全身治疗提供新思路,以改善其预后。
1
免疫治疗
对于BCG无反应的NMIBC患者,帕博利珠单抗成为了一个重要的治疗选项。
在KEYNOTE 057 队列 A研究[5]中,研究者评估了帕博利珠单抗在BCG无反应的原位癌(CIS)患者的有效性和安全性。研究共纳入101名不适合根治术、BCG无反应的CIS NMIBC患者,他们接受了帕博利珠单抗静脉治疗。最终疗效分析包括了96例伴有或不伴有乳头状病变的CIS患者,主要终点为完全缓解(CR)。结果表明,在治疗第3个月进行首次评估时,41%的患者达到了CR,且CR的持续中位时间为16.2个月(图4)。
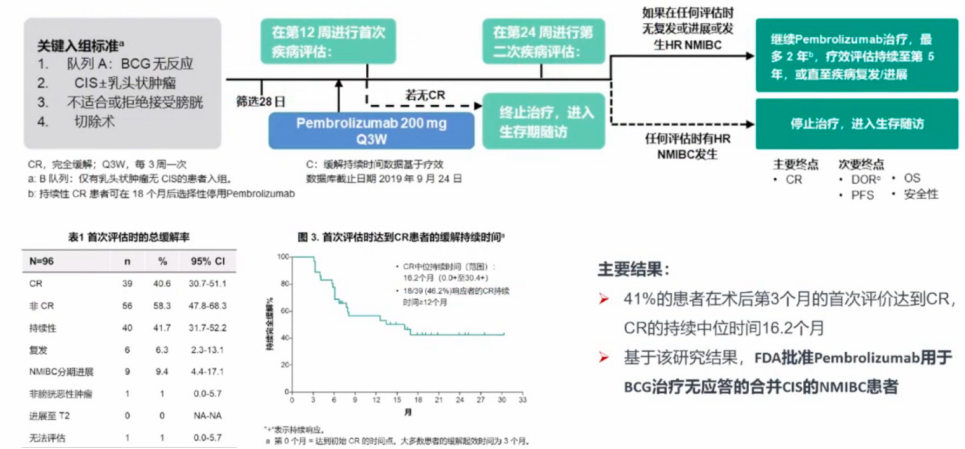
图4-KENOTE-057队列A研究设计及结果
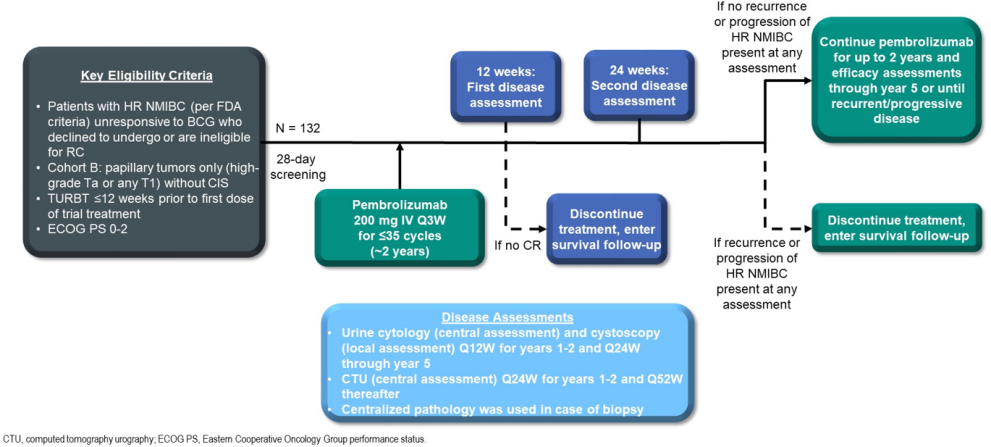
KEYNOTE-057 队列B[5]与队列A类似,同样针对BCG无反应患者,但仅包括乳头状肿瘤患者,排除了CIS患者。该研究共纳入132名患者,接受了免疫单药的静脉治疗。结果显示,高危 NMIBC的无疾病生存期为7.7个月,12个月的OS率为96.2%,总体来看,这些结果是比较亮眼的(图5)。
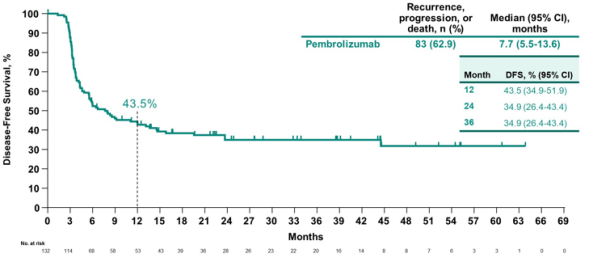
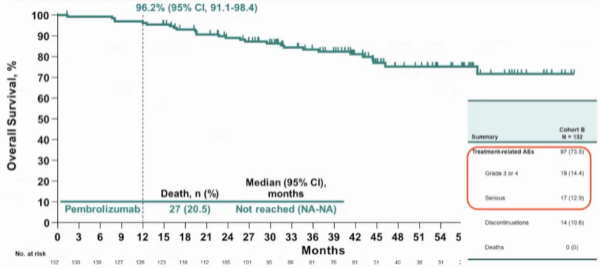
根据KEYNOTE 057 队列 A研究的结果,FDA批准了Pembrolizumab用于治疗BCG无反应且合并CIS的NMIBC患者,为这类患者提供了新的治疗选择。然而,帕博利珠单抗在这类患者群体中的广泛应用效果仍需进一步观察。
SWOG发起的S1605研究[6]也针对相同人群,结果显示,接受阿替利珠单抗治疗的CIS患者中有42%在首次评估时达到CR,6个月的CR率保持在27%(图6)。
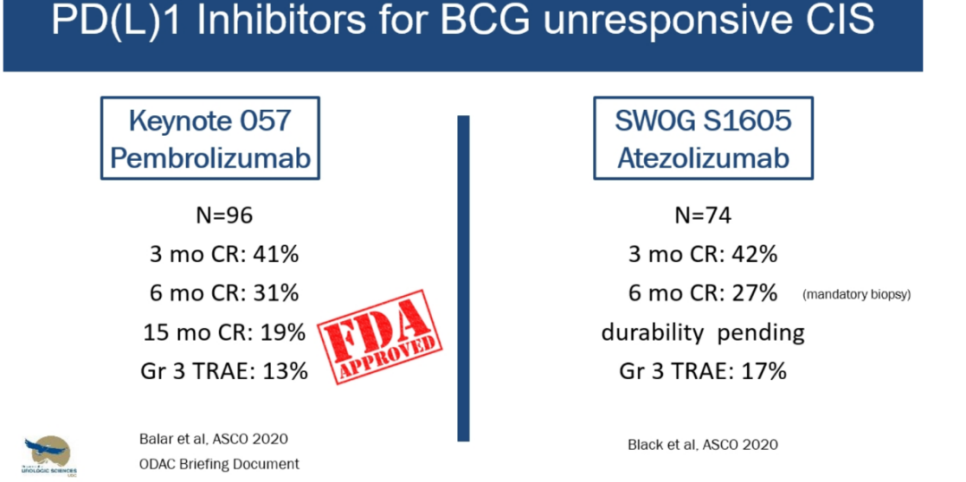
目前,正在进行的一些免疫治疗试验[6]正在招募高危NMIBC患者。这些研究旨在探讨免疫检查点抑制剂在延缓和降低早期NMIBC复发方面的临床价值。
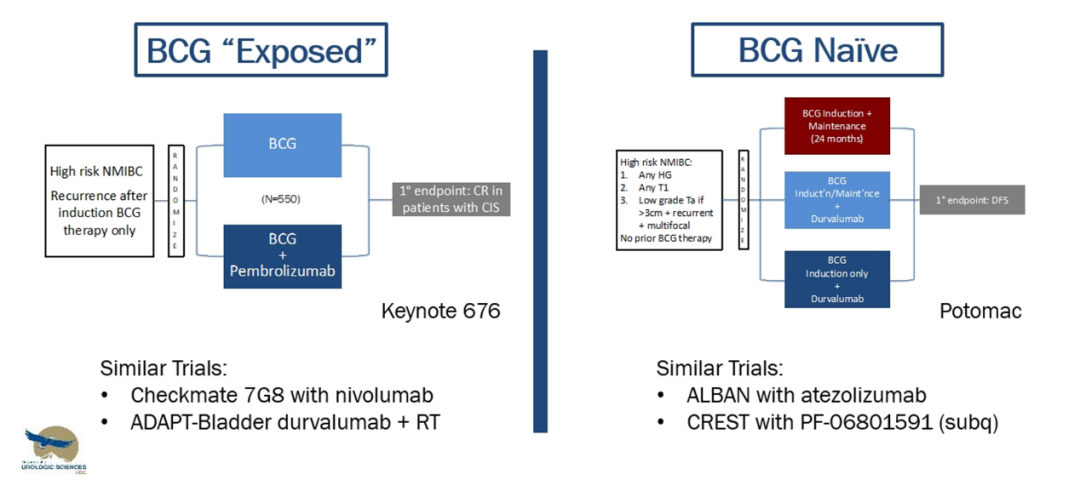
◼ 对于经BCG诱导治疗后复发的高危NMIBC患者,KEYNOTE-676研究是一项III期随机试验。它探索了帕博利珠单抗联合BCG在仍含有高危病灶的患者中的疗效和安全性。类似的研究还包括CheckMate-7G8和ADAPT-Bladder研究。
◼ 针对未经BCG治疗的高危NMIBC患者,POTOMAC研究评估了BCG诱导治疗+维持治疗、BCG诱导治疗/维持治疗+度伐利尤单抗,以及BCG诱导治疗+度伐利尤单抗的疗效,类似研究还包括ALBAN以及CREST研究(见图7)。
口服FGFR抑制剂
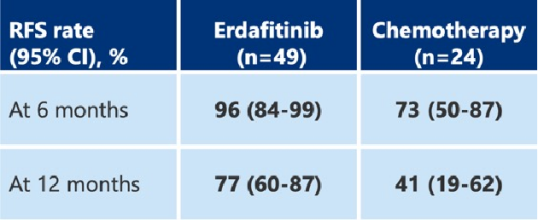
厄达替尼,一种口服FGFR抑制剂,在THOR-2队列1研究[7]中被用于评估该药物与膀胱灌注化疗相比在治疗高危NMIBC的疗效和安全性。入组的是携带FGFR基因突变或融合、在BCG治疗后复发且不适合或拒绝接受根治性膀胱切除术的高危乳头状Ta/T1 NMIBC患者。这是首个针对经BCG治疗后复发且伴有FGFR改变的高危 NMIBC患者群体的随机临床试验。
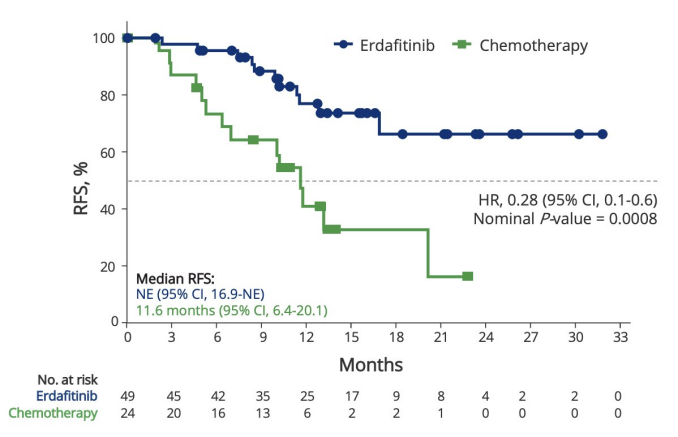
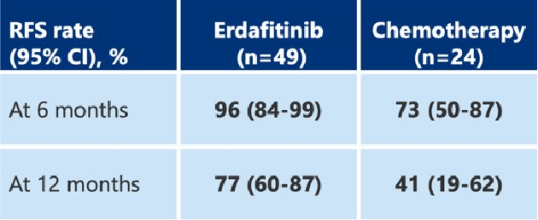
研究表明,与膀胱灌注化疗相比,口服厄达替尼能显著降低疾病复发或死亡风险(降低72%,估算的HR为0.28(95% Cl, 0.1-0.6),两组患者的中位随访时间均为13.4个月,厄达替尼组的中位无复发生存期(RFS)未达到(95% Cl, 16.9-NE),而膀胱灌注化疗组为11.6个月(95% Cl, 6.4-20.1),尽管研究中已降低了厄达替尼的剂量 ,但这些患者对口服厄达替尼的耐受性仍然面临挑战(见图8)。

药械一体
TAR-200
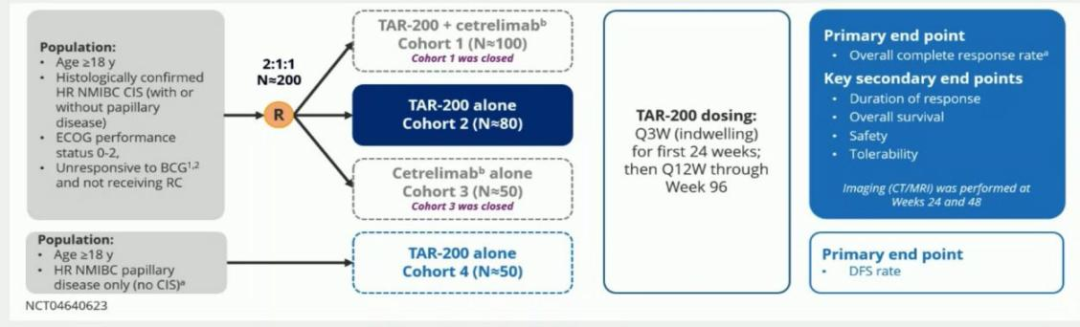
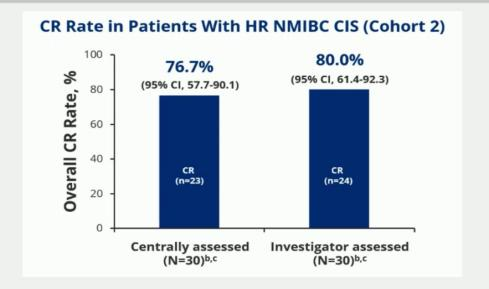
TAR-200 是一种用于在膀胱内持续释放吉西他滨的新型药物递送系统。SunRISe-1(NCT04640623)是一项正在进行的2b期随机入组研究[8],旨在评估在不适合或拒绝进行根治性膀胱切除的 BCG无反应高危 NMIBC患者中, TAR-200+Cetrelimab(抗PD1)(C1)、仅TAR-200(C2)或仅cetrelimab(C3)的疗效和安全性。研究设计如图9所示。研究结果显示,在BCG无反应的高危 NMIBC患者中,TAR-200单药治疗总体CR率达到76.7%。TAR-200的耐受性良好,主要表现为1级或2级不良事件(AE),泌尿系统症状可控。与TAR-200相关严重不良事件(SAE)、≥3级AE和停药情况罕见。SunRISe-1研究的有效性和安全性数据支持继续研究TAR-200在BCG无反应的高危 NMIBC中的应用。
TAR-210
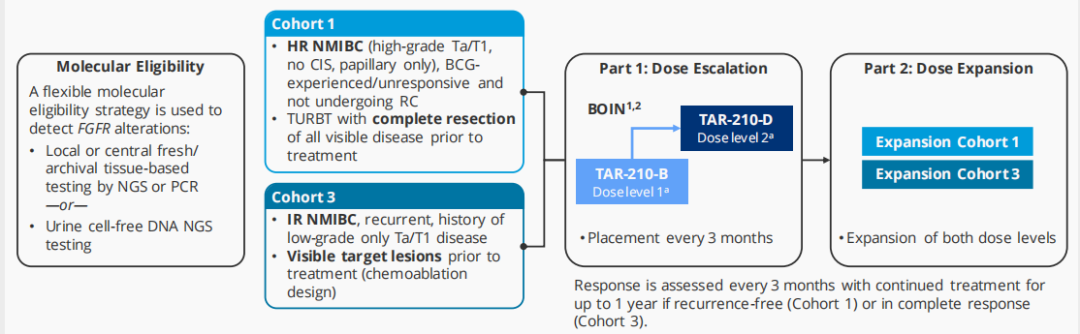
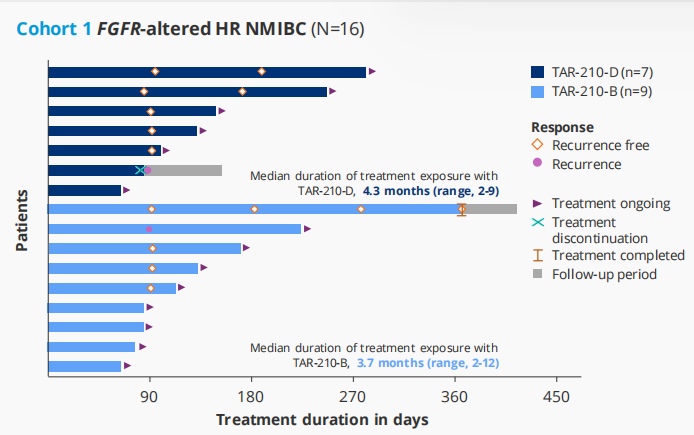
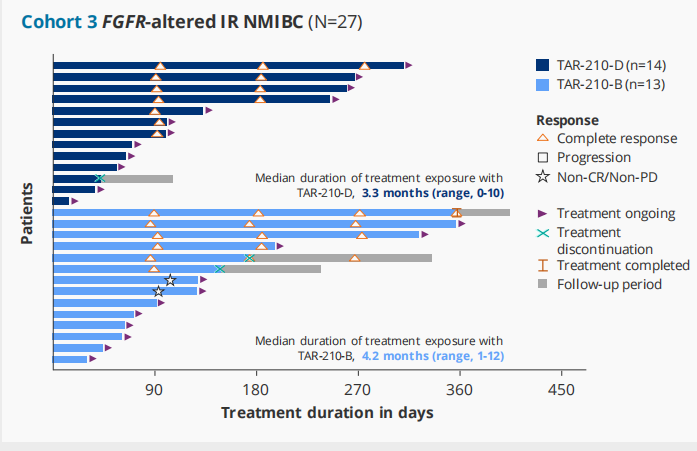
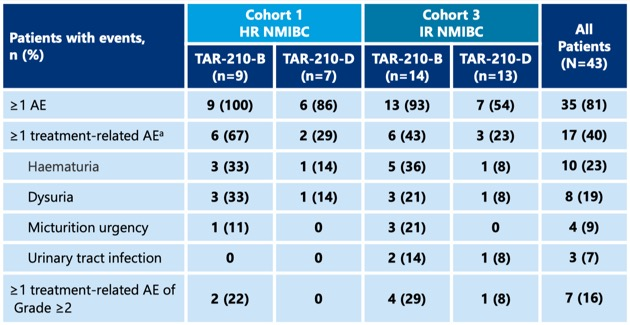
TAR-210是一种新型膀胱内给药系统,能在90天内持续局部释放厄达替尼,降低全身暴露。在针对特定FGFR改变的NMIBC患者的研究[9]中,队列1包括了接受BCG治疗或BCG无反应的高危NMIBC(高级别Ta/T1,仅乳头状)患者,这些患者拒绝或不适合接受根治性膀胱切除术;队列 3包括了复发的中危NMIBC(Ta/T1,仅低级别乳头状)患者;研究结果显示,TAR-210在FGFR改变的高危和中危NMIBC患者中表现出积极的临床活性。在队列1中,82%的经BCG治疗的高危NMIBC患者无复发;在队列3中:87%的中危NMIBC患者获得完全缓解。TAR-210的耐受性良好,与其相关的≥2级不良事件和停药情况少见,主要表现为1级不良反应。这些初步结果支持对FGFR改变的局限性膀胱癌进行TAR-210的3期研究(见图10)。
新型药物
溶瘤病毒
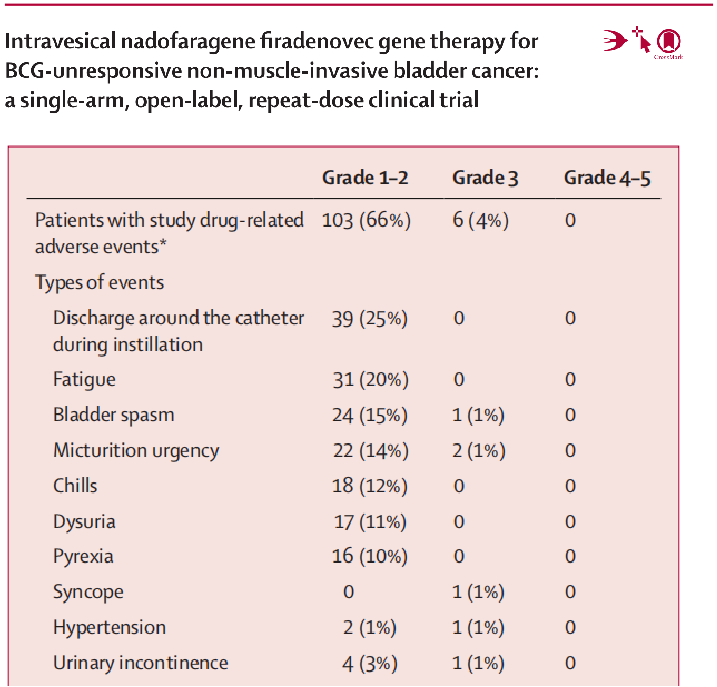
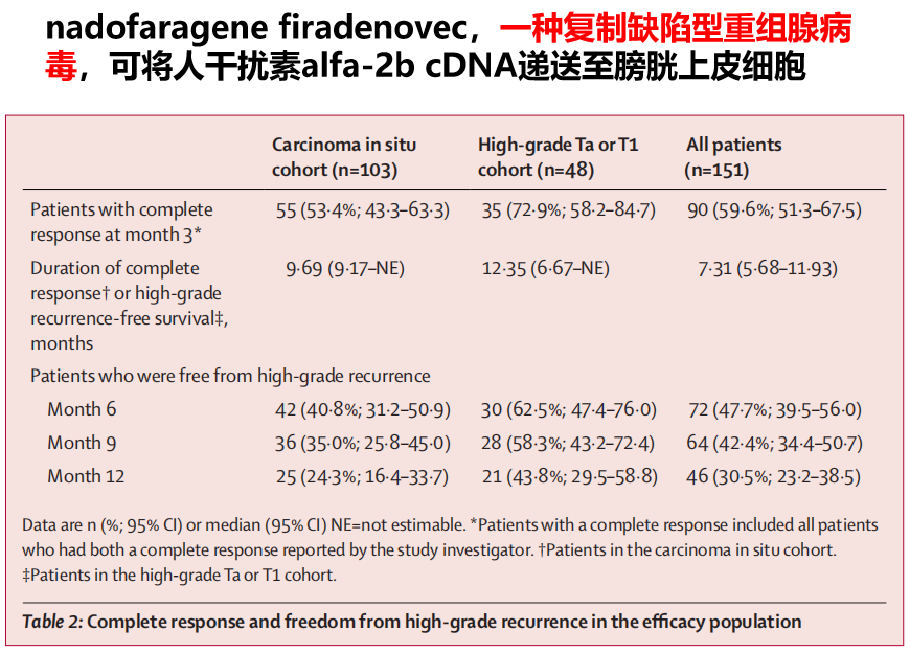
Nadofaragene firadenovec(也称rAd-IFNa/Syn3,一种可将人干扰素α-2b cDNA递送至膀胱上皮细胞的复制缺陷型重组腺病毒)被用于治疗BCG无反应的CIS,伴或不伴乳头状病变。研究结果显示[10],在2016年9月19日至2019年5月24日间,共有198例患者接受了评估。其中41例被排除,最终157例至少接受了一剂研究药物。6例患者因不符合BCG无反应的定义,未被纳入疗效分析; 剩余的151例被纳入疗效分析。在103例CIS患者中(伴或不伴高级别Ta期或T1期肿瘤),55例(53.4%) 在首次给药后的3个月内获得完全缓解,其中25例(45.5%)的缓解维持了12个月。尿急是最常见的3~4级研究药物相关不良事件(2例,1%;均为3级),未发现与治疗相关的死亡(见图11);
N803(IL-15激动剂)
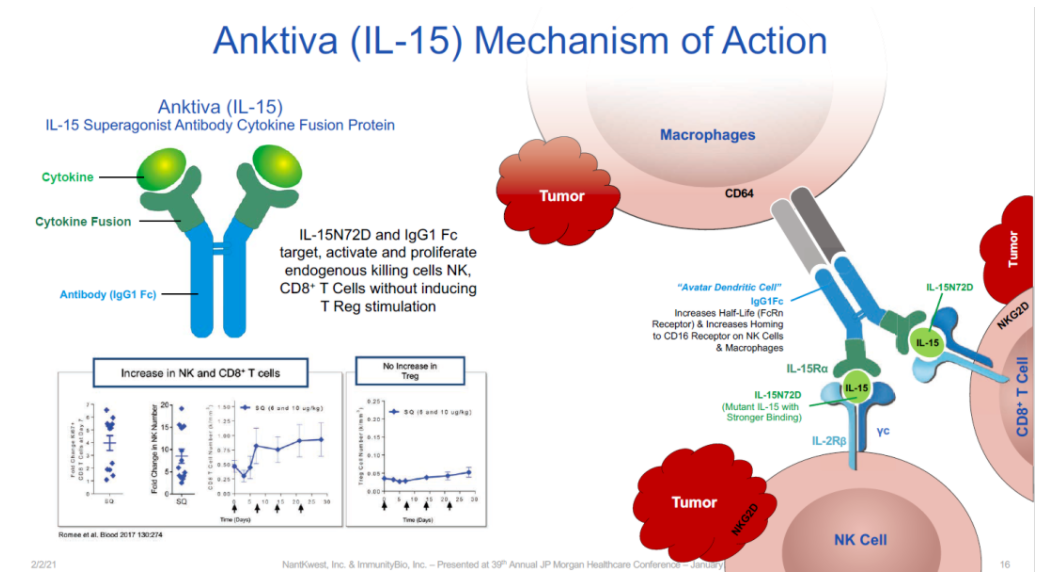
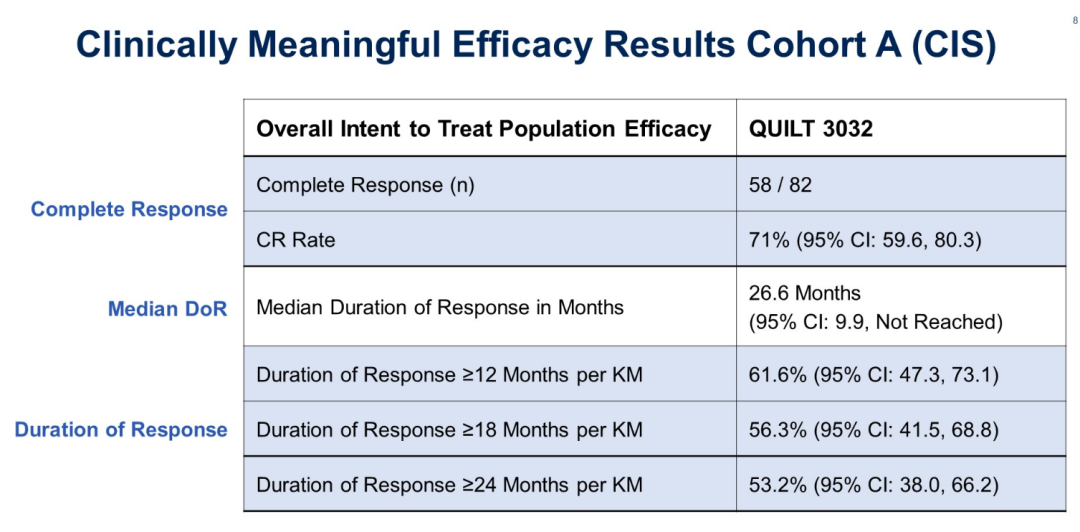
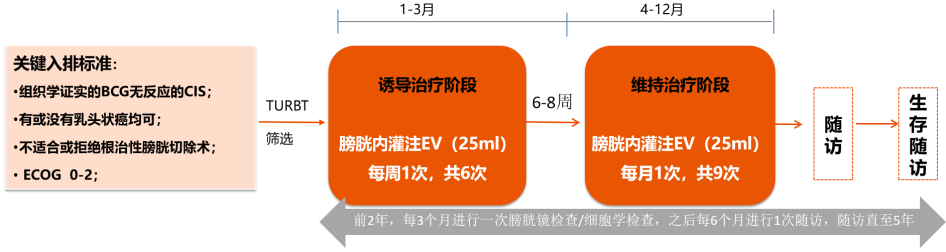
N803(IL-15激动剂)联合BCG治疗BCG无反应患者的QUILT 3.032研究,是一项开放标签、多中心的 3 期研究[11],该研究招募了组织学证实的BCG无反应患者,包括持续或复发性CIS、伴或不伴复发性Ta或T1疾病。入组患者均在接受BCG后的1年内。队列A入组CIS患者,而队列B仅入组乳头状组织学的患者。这些患者接受了50mg膀胱内BCG联合400μg N-803的治疗。研究的主要终点是任何时间点的CR,次要终点包括CR持续时间、避免膀胱切除术和膀胱切除术时间。试验结果显示,71%的BCG无反应的NMIBC患者实现了CR,12个月CR率达62%,24个月的CR率为52%。在安全性方面,队列A中未有患者出现治疗相关的4级和5级不良反应、治疗相关的严重不良反应或免疫相关的不良反应。最常见的1/2级不良反应是排尿困难(22%)、多尿症(19%)和血尿(18%)(见图12)。
抗体偶联药物-ADC
Enfortumab Vedotin---EV
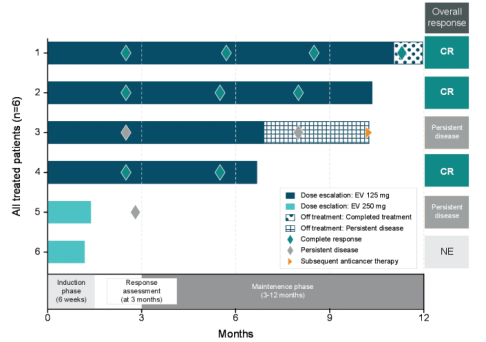
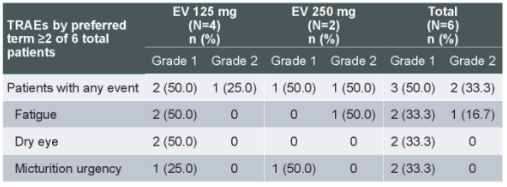
EV-104(NCT05014139)是一项 1 期、开放标签、多中心的临床研究[12],旨在评估膀胱灌注 EV治疗BCG无反应 NMIBC的安全性、耐受性、药代动力学和抗肿瘤活性。初步结果显示,在5例可评估患者中,3例达到CR,且无≥3级治疗相关不良事件(TRAEs)发生(见图13)。
Disitamab Vedotin---DV、维迪西妥单抗、RC48
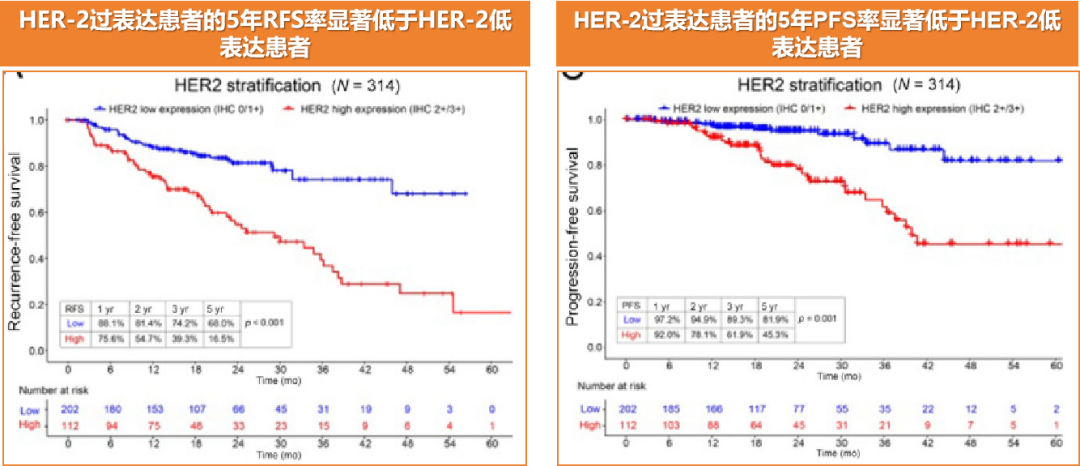
人表皮生长因子受体2(HER2)既是临床治疗的预后的关键指标,也是肿瘤靶向治疗中的重要靶点。最近一篇文章指出,HER-2是预测BCG治疗NMIBC疗效不佳的独立因子[13]。在HER2过表达的高危NMIBC患者中,使用BCG治疗后,疾病复发和进展的风险较高。因此,针对这些患者,考虑采用抗HER2靶向治疗是一种可行的方案。研究显示,35.7%的NMIBC患者存在HER2过表达(IHC 2+/3+),该组患者的5年RFS率仅为16.5%,显著低于HER2低表达患者的68.0%(p < 0.001)。HER2过表达的高危NMIBC患者在BCG治疗失败的风险较高,其5年RFS和无进展生存期(PFS)率分别仅为19.0%和58.2%(见图14)。相反,HER2阴性(IHC 0)的高危NMIBC患者在BCG治疗后能长期获益,其5年RFS和PFS率分别高达80.8%和92.1%。
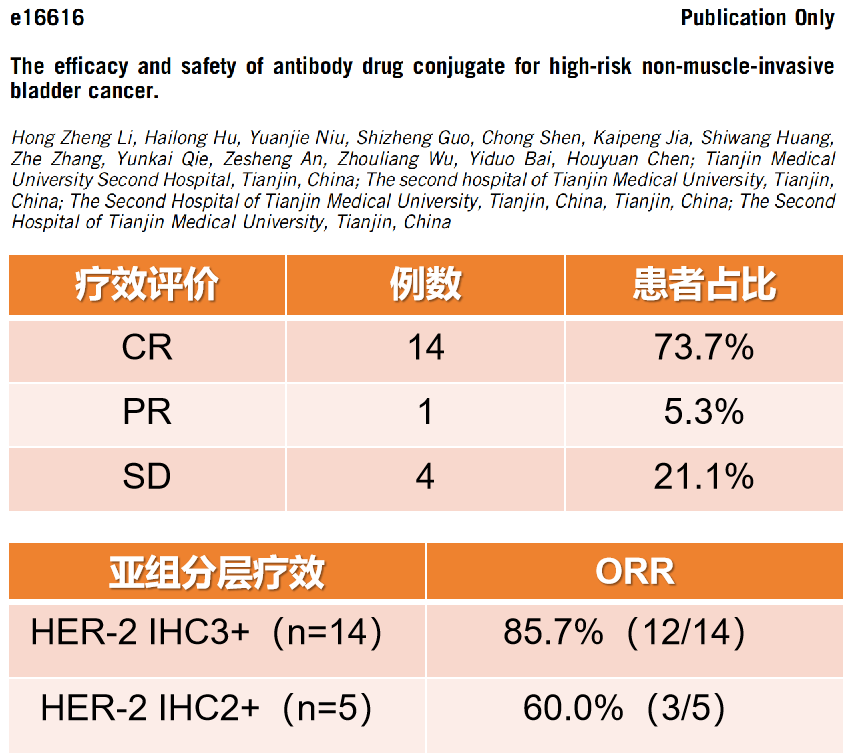
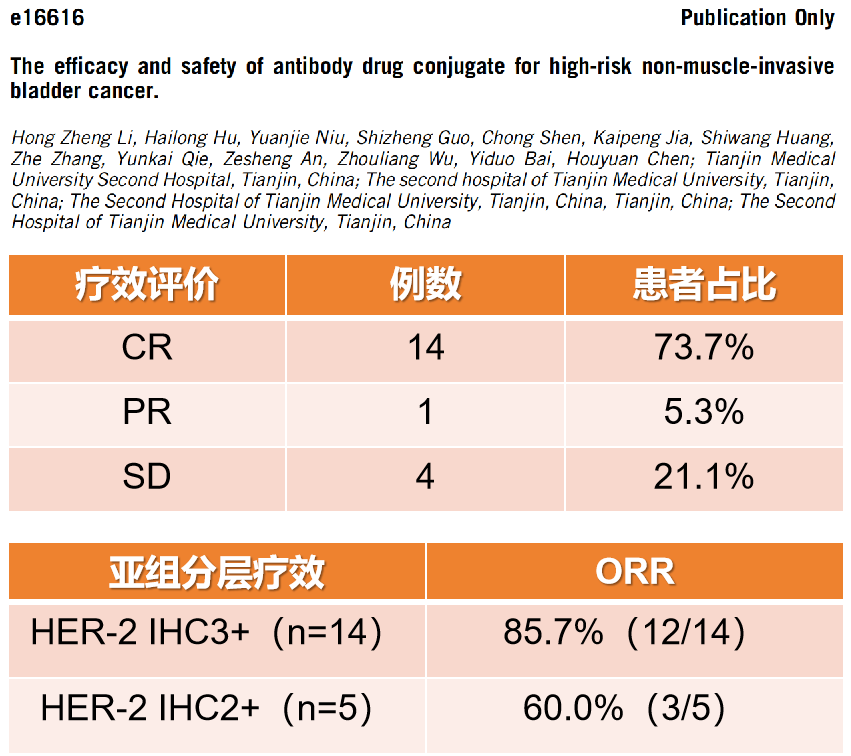
因此,一项回顾性研究,收集了19例接受RC48治疗的高危NMIBC患者的数据[14]。在这些患者中,7例 (36.8%)接受了RC48单药治疗,12例(63.2%)接受了RC48和替雷利珠单抗的联合治疗。其中14例(73.7%)达到CR,1例(5.3%)患者部分缓解(PR),4例(21.1%)患者疾病稳定(SD)。客观缓解率(ORR)为78.9%,在14例HER2 IHC 3+患者中,12例(85.7%)达到ORR。而在5例HER2 IHC 2+患者中,3例(60.0%)达到ORR。另外,在5例既往经免疫治疗失败的患者中,ORR为60.0% ,其中2例达到CR ,占40.0%。有1例患者因非治疗相关原因死亡。治疗反应持续时间(DOR)率达到92.9% ,其中12个月DOR率为61.9%。12个月无膀胱切除术生存率(CFS)为84.2% ,12个月的无事件生存率(EFS)为75.8% 。最常见的1-2级TRAEs包括脱发(36.8%)、皮疹(36.8%)、瘙痒(36.8%)、厌食(31.6%)和疲劳(26.3%)。此外,有3例(6.3%)患者出现3-4级TRAEs,包括皮疹、瘙痒、白细胞减少和中性粒细胞减少。没有5级不良事件的报道。此回顾性研究结果表明,无论是RC48单药治疗还是RC48联合替雷利珠单抗治疗NMIBC均有较好的疗效,安全性可控。对于抗HER-2 ADC药物 RC48,NMIBC相关研究正在进行中(见图15),其结果令人期待。
小结
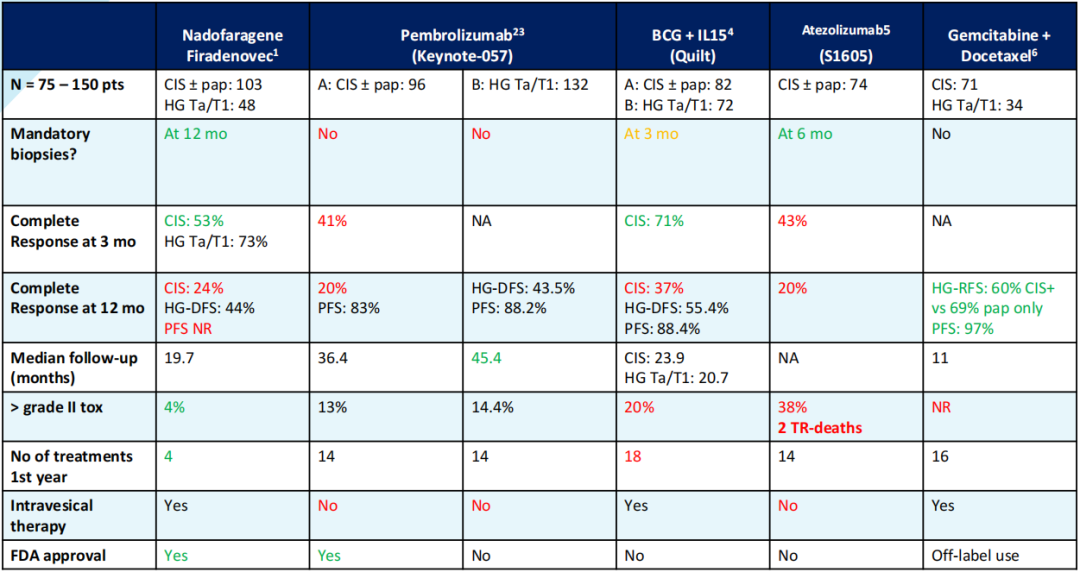
近年来,在BCG无反应的高危NMIBC病人中,已探索了免疫检查点抑制剂、抗HER-2 ADC、抗Nectin-4 ADC和新型膀胱灌注药物 (见图16),其中免疫检查点抑制剂已获国际指南的推荐,显示出有前景的结果。然而,高危NMIBC的复发风险仍然较高。期望在未来,随着医疗技术的进步和对疾病更精准的认识,出现更有效的药物,以进一步降低NMIBC的复发率和进展率,并在保留膀胱的同时提高患者的生活质量,让患者“活得更长,活得更好”。
参考文献
1.Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.
2.Chang SS,Boorjian SA,Chou R,et al.Diagnosis and Treatment of Non-Muscle Invasive Bladder Cancer:AUA/SUO Guideline[J].J Urol,2016,196(4): 1021-9.
3.Tan WS,Rodney S,Lamb B,et al.Management of non-muscle invasive bladder cancer:A comprehensive analysis of guidelines from the United States,Europe and Asia[J].Cancer Treat Rev,2016,47:22-31.
4.国家癌症中心.膀胱癌诊疗指南(2022年版).
5.Balar AV,Kulkarni GS,Uchio EM,et al.Keynote 057:Phase Ⅱ trial of Pembrolizumab (pembro) for patients (pts) with high-risk (HR) nonmuscle invasive bladder cancer (NMIBC) unresponsive to bacillus calmette-guérin (BCG)[EB/OL].J Clin Oncol 37:2019(suppl;abstr 350).
6.Black P.Immunotherapy and beyond:New options for NMIBC[EB/OL].EAU 2020.
7.James W.F. Catto, et al. ESMO 2023; LBA103.
8.Andrea Necchi, et al. ESMO 2023; LBA105.
9.Antoni Vilaseca, et al. ESMO 2023; LBA104.
10.Lancet Oncol .2021;22:107-17.
11.positive efficacy and safety phase 3 results in both CIS and papillary cohorts BCGunresponsive nonmuscle invasive bladder cancer (NMIBC) after IL-15RaFc superagonist N-803 (Anktiva) and BCG infusion. Abstract 431 General
12.Ashish M. Kamat, et al. ASCO 2023; Abstract 4596
13.Tan X, Liu Z, Cai T, Wang Y, Wu Z, Qin Z, Li Z, Liu Z, Yuan G, Zhou Q, Yao K. Prognostic Significance of HER2 Expression in Patients with Bacillus Calmette-Guérin-exposed Non-muscle-invasive Bladder Cancer. Eur Urol Oncol. 2023 Oct 24:S2588-9311(23)00219-5. doi: 10.1016/j.euo.2023.10.003. Epub ahead of print. PMID: 37884420.
14.Hong Zheng Li, Hailong Hu, Yuanjie Niu, et al. The efficacy and safety of antibody drug conjugate for high-risk non-muscle-invasive bladder cancer. Journal of Clinical Oncology 2023 41:16_suppl, e16616.
转自:爱D讯希站
https://mp.weixin.qq.com/s/Etlo_jeOv33ge76ckyHcGg
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论