 三甲
三甲
急性泛发性发疹性脓疱病
急性泛发性发疹性脓疱病( acute generalized exanthematous pustulosis,AGEP) 是一种少见的皮肤病,发病率仅为 1 ~ 5 /1 000 000,于 1980 年由 Beylot 等报道并命名。
一 病因及发病机制
该病可由药物、感染或其他因素诱发,约 90% 的患者发病前有用药史,主要是抗生素( β-内酰胺类最常见)、解热镇痛药、抗癫痫药、降压药、化疗药物、生物制剂等。
甲基强的松龙和地塞米松可用于治疗 AGEP,但也有诱发该病的报道。此外,与 AGEP 有关的诱因还包括: 感染、 紫外线照射、重金属( 如汞、铊等) 、蜘蛛咬伤等。
AGEP的发病机制涉及几种途径,所有这些途径都导致白细胞介素(IL)-8分泌增加以及中性粒细胞迁移和存活。
斑贴试验和体外试验表明,AGEP是一种T细胞介导的对特定药物或其他触发物的迟发型超敏反应。
致病因子( 主要为药物) 与机体接触后,通过抗原递呈细胞,激活特定的 CD4 + 和 CD8 + T 淋巴细胞。被激活的淋巴细胞快速增殖并迁移入真皮和表皮。致敏的 CD8 + T淋巴细胞随后释放穿孔素/颗粒酶 B 并通过 Fas 配体机制诱导表皮角质形成细胞凋亡,致使组织破坏和表皮内水疱形成。在 AGEP 的初期,水疱内主要包含 CD4 + T 淋巴细胞和角质形成细胞。这些细胞释放出大量的中性粒细胞趋化因子 CXCL8,趋化中性粒细胞进入水疱,最终形成无菌性脓疱。CD4 + T 淋巴细胞接受抗原刺激后,在不同的条件下可分化成不同亚型的 T 淋巴细胞,执行不同的功能。通过对药物相关 CD4 + T 淋巴细胞的分析发现,AGEP 患者体内主要的 T 淋巴细胞亚型为 Th1细胞。Th1 细 胞 主 要 分 泌 IL-2、IFN-γ 和 GM-CSF( 粒细胞-巨噬细胞集落刺激因子) 等。这些细胞因子可与 CXCL8 发挥协同作用,促进形成无菌性脓疱。在一部分AGEP 患者中,CXCL8 会诱导CD4 + T 淋巴细胞分化成 Th2 细胞,分泌 Th2 类细胞因子,如 IL-4 和 IL-5。IL-5 是一种能刺激嗜酸性粒细胞生长和分化的强效刺激因子,这就可以解释为何约 30% 的 AGEP 病例会出现外周血嗜酸性粒细胞升高。另外,在 AGEP 的发病过程中,Th17 细胞可能也发挥了一定作用。Th17 细胞释放 IL-17 和 IL-22。IL-17 是一种能够招募中性粒细胞的强效前炎性细胞因子,它也可以与角质形成细胞释放的 CXCL8 产生协同效应,促进脓疱形成。
在分子遗传学研究方面,近年来发现 IL36RN基因突变与部分 AGEP 患者发病有关。IL36RN 负 责 编 码 IL-36 受 体 拮 抗 剂 IL-36Ra( interleukin-36 receptor antagonist) 。IL-36Ra 在包括皮肤在内的上皮组织中高度表达,属于 IL-1 家族。它可以竞争性结合 IL-36 受体 IL-1RL2 ( interleukin-1 receptor-like 2) ,结合后 IL1RL2 不能招募 IL-1 受体辅助蛋白,从而抑制 IL-36α、IL-36β、IL-36γ 对下游促炎症信号通路( MAPKs /NF-κB) 的作用,避免炎症反应的发生。当 IL-36RN 发生突变时,其编码的 IL36Ra 结构发生改变,对 IL-1RL2 的拮抗能力减弱甚至丧失,而 IL-36α、IL-36β、IL-36γ 与 IL-1RL2的结合则相应增加,通过激活下游促炎症信号通路,最终引起皮肤的炎症反应。
二 临床表现
AGEP通常在摄入致病药物后24-48小时内出现,尤其是抗生素的中位时间为24小时。然而,一些药物致病潜伏期长达10-22天。
前驱症状包括发热(>38°C)和全身不适伴白细胞增多,特别是嗜酸性粒细胞增多,高达30%的患者伴有嗜酸性粒细胞增多。
典型皮损表现为在全身皮肤弥漫性潮红、肿胀的基础上出现非毛囊性、浅表性、无菌性小脓疱。皮疹分布以屈侧为主,最初常发生于面部或间擦部位,但很快泛发全身。
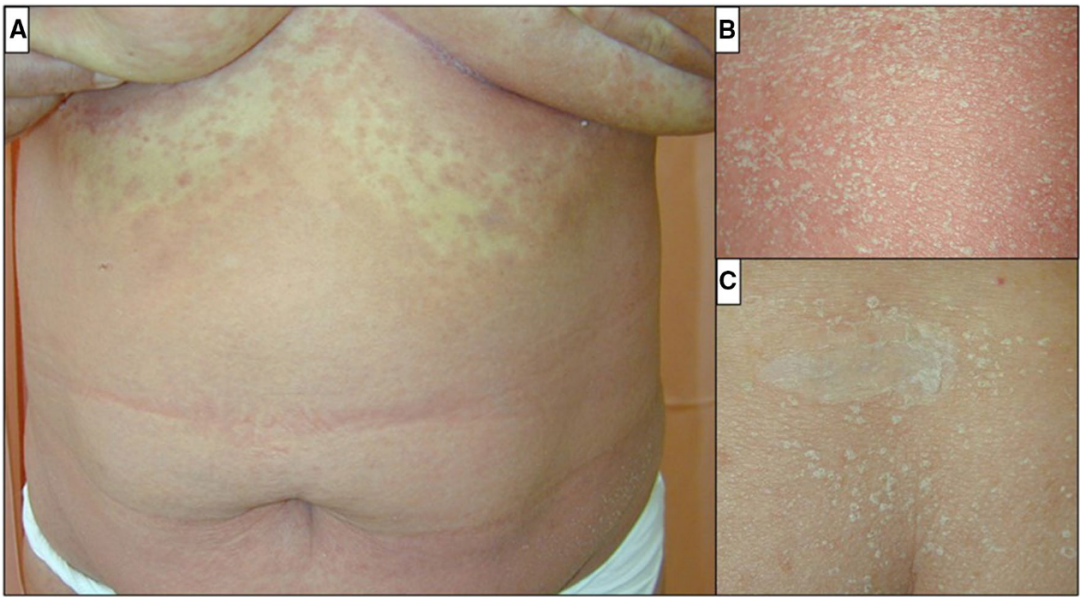
黏膜及掌跖部位很少受累,少数患者有黏膜损害,但症状表现常轻微且局限。其他不常见的皮损尚有颜面水肿、水疱、紫癜或靶形皮损等。
AGEP 患者常伴发热,体温一般在 38℃以上。脓疱和发热一般持续约 1 周左右即迅速消退,继发广泛的脱屑。约 20% 的患者会出现系统受累,多为肝脏、肾脏及肺功能受损。肝脏受累包括肝细胞性损害和胆汁淤积性损害,均表 现为肝酶升高。腹部超声检查显示肝脏肿大或脂肪变性。肾脏受累时常表现为急性肾功能不全( 少尿、血肌酐升高等) ,如伴有血尿、蛋白尿则为器质性肾功能不全。肺受累时可出现双侧胸腔积液,导致呼吸困难、低氧血症。严重的 AGEP 患者可出现多器官功能障碍、弥漫性血管内凝血,甚至死亡。
三 组织病理学
AGEP 组织病理学特征为角层下脓疱或棘层上部的 Kogoj 海绵状微脓肿,角质形成细胞坏死; 真皮乳头水肿,白细胞破碎性血管炎及血管周围炎性细 胞浸润(主要为中性粒细胞及嗜酸性粒细胞)。
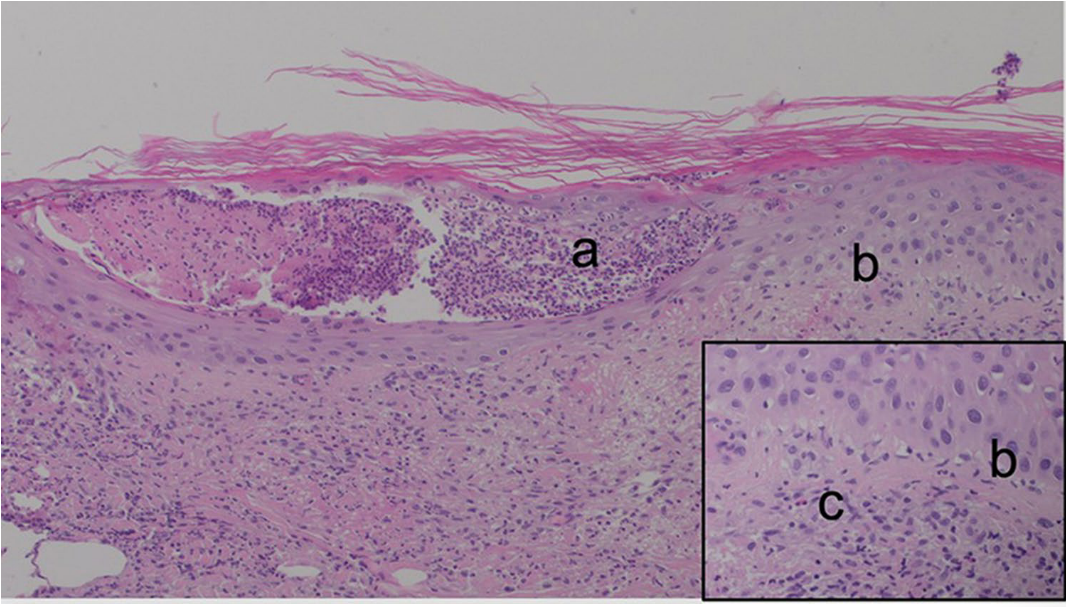
AGEP的HE组织学显示(a)角层下嗜酸性脓疱,(b)相邻表皮中基底角质形成细胞空泡化,伴有(c)上层真皮中由淋巴细胞、组织细胞、中性粒细胞和混合嗜酸性粒细胞组成的混合浸润。放大倍数:40倍,插图100倍。
四 诊断及鉴别诊断
诊断依靠临床及病理表现
斑贴试验可能有助于寻找可疑致敏药物,建议一般在AGEP消退后4周内进行,但在不良反应发生后1年内进行。斑贴试验对AGEP的敏感性估计为50-58%。
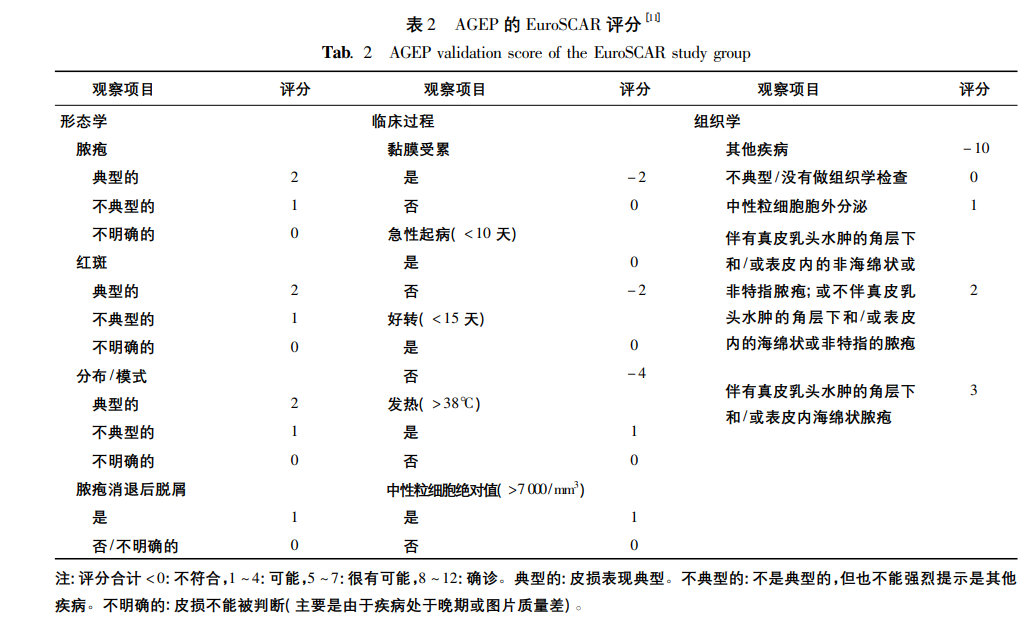
EuroSCAR 评分对本病的诊断有一定帮助。
AGEP 主要需与以下无菌性脓疱病鉴别:
①GPP: 该病常反复发作,在脓疱出现前可有典型银屑病的皮损,在原有斑块或红皮病皮疹上出现脓疱,脓疱可扩大融合形成“脓湖”。部分患者有家族史。组织病理表现为表皮呈银屑病样增生伴角化不全,棘层上部可见 Kogoj 微脓肿,真皮浅层毛细血管扩张、迂曲。
以下可能有助于鉴别:(1)脓疱型银屑病病变通常覆盖鳞状斑块;(2)脓疱型银屑病患者通常有斑块型银屑病的特征性病史;(3)合并症不同,如银屑病关节炎。此外,Shalom等人发现高血压、糖尿病和血脂异常与脓疱性银屑病和药物诱导银屑病的相关性显著高于AGEP。其他差异包括(4)AGEP的组织病理学更可能显示中性和嗜酸性浸润和坏死角质形成细胞,而不是脓疱性银屑病中的单纯中性粒细胞浸润。此外,在脓疱型银屑病中,海绵形成更为突出,脓疱在表皮的水平高于AGEP。最后,脓疱型银屑病通常有乳头瘤状增生和棘层肥厚,以及微脓肿,这在AGEP中是不存在的。然而,即使有这些报道的差异,组织学分化仍具有挑战性。
Vyas等人发现,在真皮炎症浸润中存在浆细胞样树突状细胞标记物CD123和MxA蛋白有助于区分脓疱性银屑病和AGEP。CD161阳性也支持脓疱性银屑病的诊断。
②角层下脓疱病: 该病是一种慢性良性复发性脓疱性皮肤病,中年妇女多见,临床表现为环状或匐形性群集、片状分布的浅表松弛性脓疱,如波纹状,有时可见到液平面。好发于身体皱褶处,如腋窝、腹股沟、乳房下及腹壁。黏膜、面部、头部及肢端很少累及。组织病理改变为位于表皮浅层 的角层下脓疱,脓疱内主要为中性粒细胞,偶有嗜酸性粒细胞。脓疱下方表皮几乎无改变,仅见浸润的中性粒细胞、轻微的细胞间水肿。
③区分AGEP和SJS/TEN的决定性方法是通过皮肤活检。AGEP的组织学将显示角层下或表皮内嗜中性脓疱,而SJS/TEN将显示全层角质形成细胞坏死。
此外还需要与IgA天疱疮、嗜酸性脓疱性毛囊炎(Ofuji病)等进行鉴别。
五 治疗及预后
AGEP的主要治疗方法是停用可疑致敏药物。
在由感染或其他诱因而不是药物引起的病例中,病因治疗是重要部分。
其他情况下,主要是对症/支持,因为AGEP通常是自限性的。
支持性治疗包括外用类固醇、退热药和抗组胺药。
在严重的病例中,可使用口服皮质类固醇,据报道可减少住院时间和发病率。
在极少数情况下,据报告AGEP由口服皮质类固醇诱导。
环孢霉素是重度AGEP的另一种选择,其疗效与口服皮质类固醇相似,可用于类固醇难治性病例或有类固醇治疗禁忌症的患者。
司库奇尤单抗和英夫利昔单抗也被报道用于治疗AGEP。
Spesolimab是一种人源化IgG1单抗,以高亲和力特异性结合IL-36R,并抑制IL-36激动剂的信号传导,可能对伴有IL-36RN基因突变的AGEP患者有效。
在停用致敏药物后,症状(包括皮肤特征)通常在几天至2周内迅速消退。
当AGEP消退时,受累皮肤通常会出现脱屑。
AGEP的死亡率低于5%,在发生死亡的病例中,通常是由于多器官功能障碍、弥散性血管内凝血或院内感染。
AGEP很少出现严重的并发症和后遗症,偶有合并可逆性急性肾功能衰竭的报道。
参考文献:
[1]何永萍,汪盛.急性泛发性发疹性脓疱病研究进展[J].中国皮肤性病学杂志,2018,32(12):1464-1468.
[2]Parisi R, Shah H, Navarini AA, Muehleisen B, Ziv M, Shear NH, Dodiuk-Gad RP. Acute Generalized Exanthematous Pustulosis: Clinical Features, Differential Diagnosis, and Management. Am J Clin Dermatol. 2023 Jul;24(4):557-575.
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论