 三甲
三甲
松果体区肿瘤:优先选择伽玛刀治疗
翻译自 Mathieu D, Iorio-Morin C. Stereotactic Radiosurgery for Pineal Region Tumors. Prog Neurol Surg. 2019;34:173-183. doi: 10.1159/000493062. 作者单位 加拿大 Division of Neurosurgery, Department of Surgery, Université de Sherbrooke
摘要:
松果体区肿瘤是一组不同组织学实体的异质性肿瘤,由于其关键部位和频繁的侵袭行为,治疗可能是一个重大挑战。传统的治疗包括手术切除、分次放疗和化疗。立体定向放射外科(SRS)正越来越多地用于这些肿瘤的治疗。它被用作松果体区的松果体细胞瘤和乳头状肿瘤的主要治疗方法,与松果体母细胞瘤和生殖细胞肿瘤的放疗或化疗相结合,或在肿瘤复发的情况下作为辅助放疗增强剂。报告的发病率很低,在大多数情况下包括短暂的动眼神经障碍。作为显微外科切除术的一种非侵入性替代方法,在讨论这些具有挑战性的病例时,应始终考虑SRS。
松果体实质肿瘤(PPT)
PPT起源于松果体细胞,松果体细胞是松果体分泌褪黑素的特殊细胞。世卫组织将这些肿瘤分为3个亚型,包括松果体细胞瘤(WHO I级)、中分化PPT(PPTID; WHO II、III级)和松果体母细胞瘤( WHO IV级)。正如预期的那样,治疗和预后高度依赖于肿瘤分级。
松果体细胞瘤更常见于年轻至中年成年人。它们是良性病变,完全手术切除可能治愈。然而,对于关键部位的其他良性肿瘤,手术与发病风险显著相关。越来越多的文献支持使用SRS作为切除术的微创替代方案。IGKRF系列报告了26名患者,包括24名作为初始治疗一部分的SRS患者和2名复发患者[2]。20年时,累计局部控制率为81%,生存率为76%。Wilson等人[7]对5例次全切除的松果体细胞瘤患者使用SRS(3例为辅助治疗手段,2例为肿瘤进展)。平均随访65个月后,所有患者均显示局部肿瘤控制,无并发症。Mori等人[3]共治疗了6例松果体细胞瘤患者中的13个肿瘤,5年后的PFS为80%。Reyns等人[8]报告了他们对8例松果体细胞瘤患者进行SRS治疗的经验。6名患者最初仅接受SRS治疗,2名患者接受SRS治疗部分切除后的残余疾病。平均随访32个月后,所有患者均存活,肿瘤消退或稳定。在他们的文章中,Lekovic等人[6]报道了8例松果体细胞瘤患者的SRS结果。所有肿瘤均在最后一次影像学随访中得到控制,随访时间为2至56个月。1名患者在SRS后2个月死于无相关原因的肿瘤,该肿瘤在影像学上表现出严重退化。图1描述了一例由原发性SRS治疗的典型松细胞瘤。
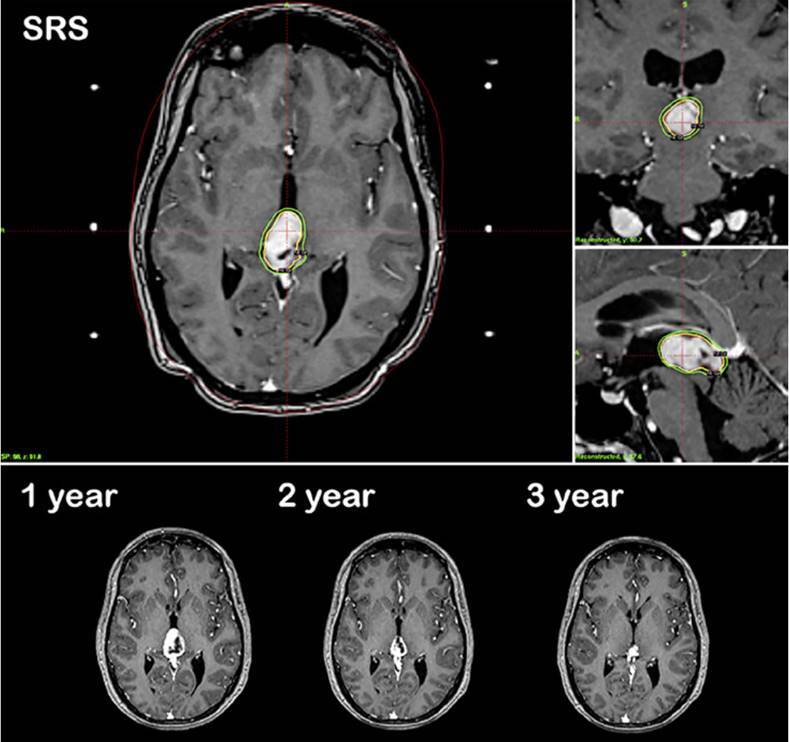
图1。一名38岁女性患者因松果体区肿瘤继发于脑积水,表现为复视。她接受了内镜下第三脑室造瘘术和肿瘤活检。病理证实为松果体细胞瘤。然后,她让SRS担任主要治疗手段。SRS术后3个月,由于短暂的肿瘤扩张,她的复视暂时恶化。在SRS后的最后36个月随访中,肿瘤逐渐消退,临床上保持稳定。
PPTID在2007年修订的WHO CNS肿瘤分类中得到正式认可。它们具有与复发风险增加相关的组织学特征,通常通过手术切除进行治疗。增加分级放射治疗或SRS仍然是一个有争议的问题。在IGKRF系列中,有4名患者在治疗前、3名患者在复发接受SRS治疗[2]。SRS后5年的累计局部控制率和生存率分别为50%和56%。在所有其他研究中,分析没有组织学分层,PPTID的结果与松果体细胞瘤的结果合并在一起,使得比较困难。Park等人[9]报告了9名1级和2级PPT患者的SRS作为主要治疗方法。平均随访79个月后,所有患者均存活,所有肿瘤均显示完全或部分缓解。只有1名2级肿瘤患者最终接受了脑脊液播散。Balossier等人[10]还报告了9例1级或2级松果体细胞瘤患者,作为初始治疗的一部分,他们单独或在部分切除后接受SRS治疗。所有8名接受影像学随访的患者均实现了肿瘤控制,随访时间从5个月到76个月不等。Yianni等人[5]报告了11例PPT患者的SRS治疗结果(包括6例松果体细胞瘤、3例PPTID和2例松果体母细胞瘤)。他们报告SRS后1年PFS为81%,5年PFS为54%。不幸的是,没有按照肿瘤分级进行分析,这使得解释更加困难。据推测,通过包括松果体细胞瘤,这些研究高估了SRS对PPTID的疗效。
松果体母细胞瘤是一种高度恶性的肿瘤,通常发生在儿童和年轻人身上。建议的治疗包括最大限度的手术切除,然后分次放疗和化疗。据报道,SRS主要出现在复发的情况下,或作为初级治疗后的局部增强治疗。IGKRF系列包括13名患者,其中8名患者SRS作为一种加强治疗方式,在5例复发时使用SRS 。局部控制和生存率较差,5年累计率分别为27%和48%。作为多模式管理的一部分,Mori等人[3]对2例松母细胞瘤患者的4个肿瘤进行了SRS。2名患者分别在SRS后3个月和13个月出现肿瘤进展。在Reyns等人[8]的研究中,5例松果体细胞瘤患者在手术切除、分割放疗和化疗的基础上,还接受了SRS治疗。2例患者的病情仍得到控制,2例患者出现局部肿瘤进展延迟,1例局部肿瘤控制患者出现远处脑播散。2名患者死于肿瘤进展。在他们的系列研究中,Lekovic等人[6]治疗了1例复发性松果体母细胞瘤患者。45个月后,患者仍然活着,在影像学上有一个稳定的肿瘤。图2描述了一名患者的情况,作为多模式初始管理的一部分,她接受了SRS治疗。

图2。一名21岁女性患者出现脑积水导致颅内高压综合征。她接受了内镜下第三脑室造瘘术和肿瘤活检。病理结果为松果体母细胞瘤。她接受了伽玛刀放射外科治疗,随后接受了分次放射治疗和化疗。诊断90个月后,她仍无疾病,神经功能正常。
松果体区乳头状肿瘤
2007年修订版将松果体区乳头状肿瘤(PTPR)纳入WHO CNS肿瘤分类。它们被认为是由亚鳃器官的特殊室管膜细胞产生的。它们可以被归类为WHO II级或III级肿瘤,但这两级肿瘤即使在大体全切除后也有很高的局部复发倾向。最优管理仍然是一个有争议的问题。前期放射治疗或化疗尚未证明能降低复发风险[11]。
鉴于局部复发的高风险,许多作者正在研究SRS的作用。IGKRF研究包括6名PTPR患者[2]。5名患者在组织学诊断后接受SRS作为初始治疗的一部分,另1名患者在大体全切除后复发接受治疗。5名患者出现局部复发,导致5年时的累计局部控制率仅为33%。所有这些患者对复发的肿瘤重复SRS,导致4名患者的局部控制时间延长。5年时的累计生存率为100%。Yianni等人[5]的系列研究包括2名PTPR患者。无法进行长期随访,但在SRS后1年,2名患者均显示肿瘤控制。Balossier等人[10]报告了1例部分切除后出现SRS的患者,术后6个月肿瘤稳定。Fauchon等人[11]发表了文献中最大的PTPR回顾性队列,共包括43名患者。只有2名患者在活检和部分切除后接受了SRS检查。2名患者在未指定的时间间隔后均出现肿瘤复发,1名患者最终死亡。Shakir等人[12]报告了1例PTPR患者,在部分切除和替莫唑胺化疗1年后,补充SRS。肿瘤逐渐消退,9年后仍处于控制状态。Riis等人[13]报告的另1名患者在立体定向活检后出现SRS,并在5年后证明肿瘤持续消退。Cardenas等人[14]发表了1例SRS后肿瘤控制7年的患者。当时,他有肿瘤进展,接受了大体全切除术,没有复发。图3显示了一名年轻患者的情况,该患者作为治疗的一部分接受了2次SRS治疗她的PTPR。

图3。一名4岁女性患者因松果体区肿瘤继发脑积水。她接受了部分肿瘤切除术,证实了PTPR的诊断。然后她接受SRS作为残余肿瘤的辅助治疗。在接下来的几个月里,肿瘤立即消退。SRS术后18个月,MRI显示无症状局部肿瘤复发。她对复发的肿瘤进行了重复SRS治疗,随后出现完全的肿瘤反应,在最后一次手术后的88个月的最新随访中仍持续稳定。
其他肿瘤
松果体区可出现脑膜瘤、胶质瘤和转移瘤。由于它们的影像学特征,诊断这些病变通常很简单。SRS通常用于其他部位的肿瘤治疗,具有可预测且众所周知的反应特征。SRS治疗这些肿瘤的主要考虑因素是限制对邻近脑干的剂量,以降低辐射诱发毒性的风险。
讨论
关于SRS在松果体区肿瘤中的应用的文献仍然有限,并且很难从现有发表的研究中得出有意义的结论。其中一个主要原因是,为了补偿有限的患者数量,作者必须将不同的肿瘤组织学亚组汇总在一起,从而得出可能不适用于所有特定肿瘤的局部控制和生存数据[3,5,6,15]。IGKRF最近发表的研究试图通过组织学分层分析来缓解这一事实,从而提供更好的质量数据来指导患者管理[2]。
然而,现有的文献已经证明,SRS对于某些松果体区患者是一种有用的治疗方式肿瘤。
对于生殖细胞瘤,SRS的主要兴趣在于它能够为肿瘤床提供适形放射增强,从而允许使用低剂量的分次放射治疗,或在复发时使用。
在非生殖细胞瘤的生殖细胞肿瘤(NGGCT)的情况下,SRS可作为局部增强剂,用于切除术后残余肿瘤,结合分次放疗和化疗,或在复发的情况下。
这似乎也是松果体母细胞瘤患者的主要适应症。
在大多数已发表的研究中,对于松果体细胞瘤,SRS似乎可以诱导长期的肿瘤生长控制。因此,将预先SRS作为肿瘤切除的替代方案作为主要管理方式似乎是合理的。
这可能也适用于PPTID,尽管在许多研究中,由于其与WHO I级肿瘤的分组,这些病变的文献很难分析。可以考虑增加分级放射治疗,尤其是在III级肿瘤中。
最后,对于PTPR患者,SRS似乎是一种合理的主要治疗选择,因为即使是患有各种组织学肿瘤的患者,SRS也有局部复发的趋势。图4给出了一个建议的SRS整合算法,用于松果体区肿瘤的治疗。
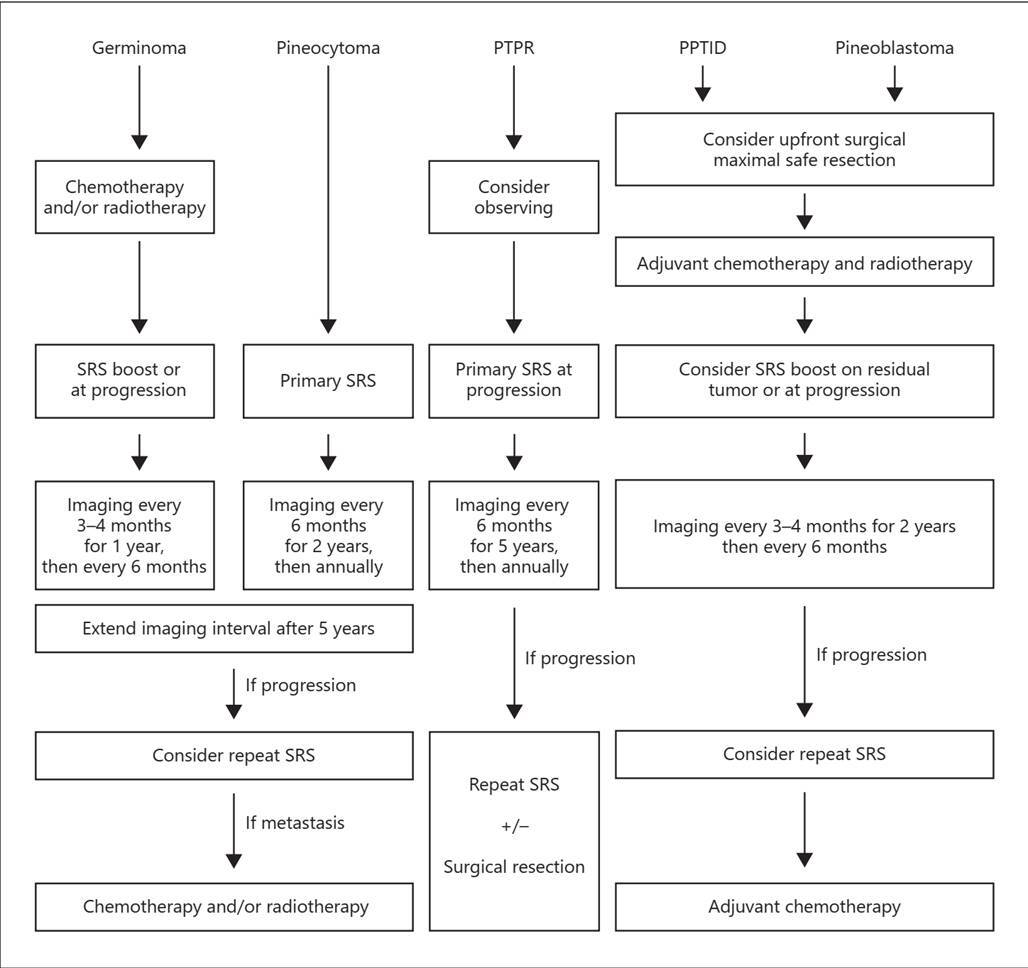
图4。针对组织学证实为松果体区肿瘤的患者提出的管理流程。
在大多数研究中,与SRS相关的并发症是合理的,与手术切除相比是有利的。在IGKRF研究中,28%的病例出现了影像学上辐射引起的变化[2]。15%的患者出现临床恶化,其中9%出现新的局灶性缺损,7%出现新的Parinaud?综合征,3%出现脑积水。Park等人[9]报告,接受SRS治疗的9名PPT患者中有1名出现暂时性记忆障碍。Yianni等人[5]在他们的44名不同组织学肿瘤患者队列中,只有一例SRS后出现短暂性复视。
在使用SRS治疗的13例PPT中,Reyns等人[8]报告了3名患者出现了新的暂时性复视,只有1名患者出现了新的永久性复视。Amendola等人[15]报告,在20名患有各种松果体肿瘤的患者队列中,没有SRS相关的并发症。在另一组17例不同组织学诊断的患者中,未发现与SRS手术相关的并发症[6]。由于事件数量和接受治疗的患者总数较少,没有变量与发病风险增加相关。在大多数研究中,肿瘤的边缘剂量在10-20Gy之间变化。根据有限的可用文献,无法提出正式的剂量建议。由于SRS通常用于辅助治疗或之前的分次放疗后,因此建议相应地调整剂量,并将脑干的剂量保持在可耐受的范围内似乎是合理的。
如前所述,松果体区肿瘤的治疗,包括SRS的使用,应根据具体的组织学诊断进行调整。因此,只要可行,应尽一切努力获取肿瘤组织。然而,这可能并非在所有情况下都可行,因为患者共病、拒绝手术或手术后可用组织有限。IGKRF研究包括10名仅基于影像学诊断的SRS患者,无组织学证实[2]。累计局部控制率和5年生存率分别为61%和67%,与整个系列的汇总结果相似。Li等人[16]报道了一个大系列,包括147名仅基于影像学和临床诊断的松果体病变SRS患者。他们报告了69%的病例出现了最初的肿瘤消退,在SRS术后1年、3年和5年仍然存活的患者中,局部控制率分别为97%、94%和91%。1年、3年和5年的生存率分别为80%、72%和67%。这些结果似乎支持在选定的患者中使用SRS,即使没有病理证实。在这些情况下,管理应基于基于所有其他特定患者信息的最有可能的诊断,如果认为必要,应提供适当的辅助治疗(在这种情况下,建议的管理流程见图5)

图5。针对组织学未知的松果体区肿瘤患者提出的管理流程
结论
鉴于松果体区肿瘤的罕见性,可用于指导治疗的证据水平较低。在现有研究的范围内,SRS似乎是一种安全的方式,其有效性和作用取决于组织学。对于松果体细胞瘤和PTPR的主要治疗,SRS可以作为手术的合理替代方案,后者更容易复发。对于生殖细胞肿瘤和松果体母细胞瘤,SRS可以在复发时使用,也可以作为多模式初级治疗的一部分,作为一种辅助手段,减少分次放射治疗的剂量。作为显微外科切除术的一种非侵入性替代方法,在讨论这些具有挑战性的病例时,应始终考虑SRS。
(图:山东大学第二医院 神经外科配置的?Leksell Gamma Knife Perfexion)
本文是王成伟版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论