 三甲
三甲
2023CSCO诊疗指南:非小细胞肺癌之IV期无驱动基因非鳞癌非小细胞肺癌的治疗
注释:
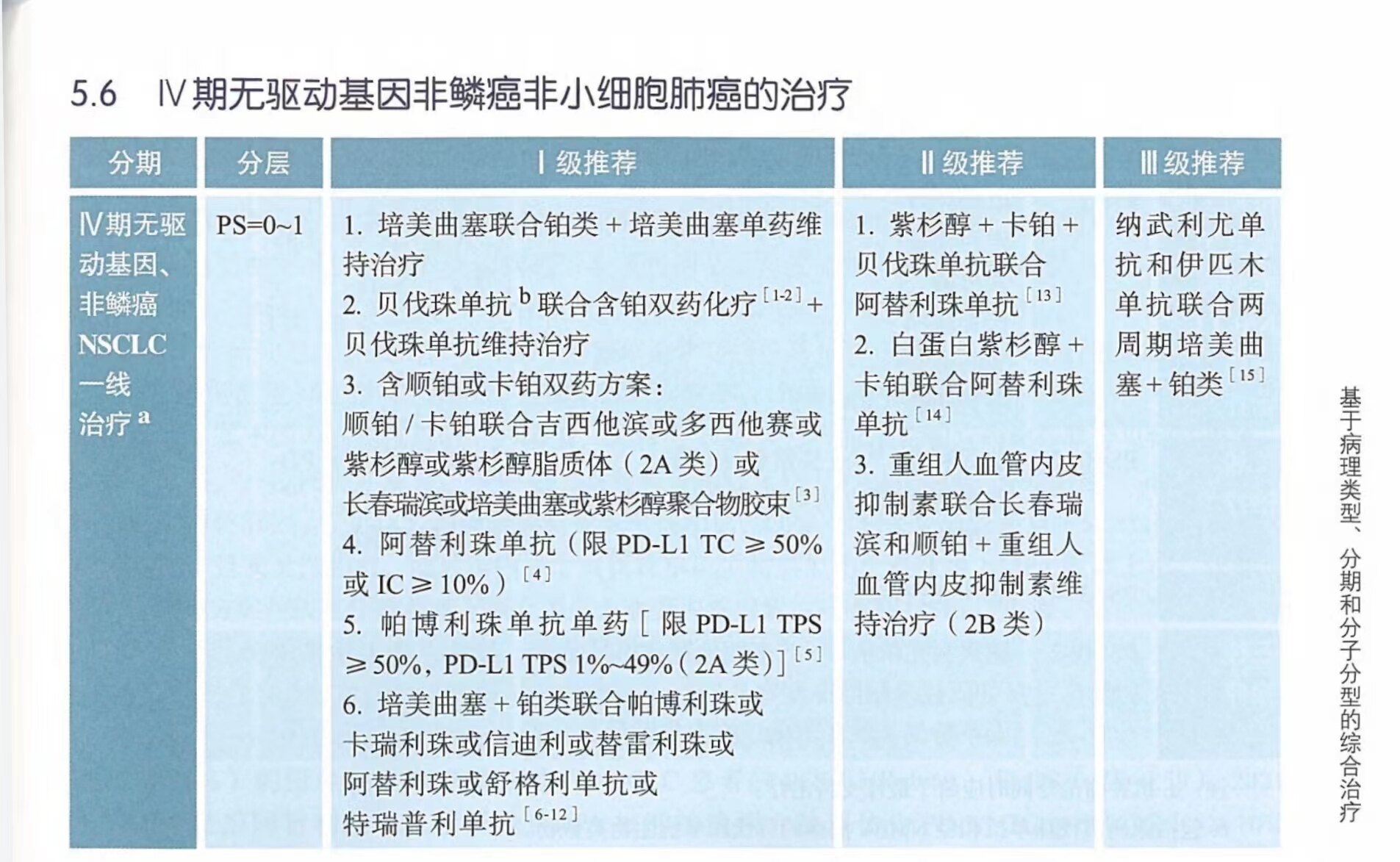
无驱动基因,PS=0-1分的非鳞非小细胞肺癌患者一线经典方案为含铂双药化疗,ECOG1594研究提示第三代新药联合铂类(顺铂/卡铂)疗效达到瓶颈。PARAMOUNT研究证实,培美曲塞联合顺铂4个周期后,无进展者继续接受培美曲塞维持治疗直到疾病进展或不可耐受,与安慰剂相比能显著延长PS评分为0-1分患者的PFS(中位,4.1个月vs.2.8个月)及OS(中位,13.9个月vs.11.0个月)。在中国人群开展的BEYOND研究显示,贝伐珠单抗联合组较单纯化疗组显著延长中位PFS,疾病进展风险下降,中位OS显著延长至24.3个月。并显著提高了ORR和DCR,不良反应可以接受。基于国内真实世界研究的结果,2018年NMPA已经批准含铂双药化疗联合贝伐珠单抗一线治疗方案。一项随机、双盲、多中心、头对头III期临床研究QL1101-002研究结果显示,贝伐珠单抗生物类似物(安可达)与原研药贝伐珠单抗相比,ORR达到主要研究终点(52.8%vs.56.8%,HR=0.93),且安全性相似,随后国内多个贝伐珠单抗类似物已经获得NMPA批准上市。长春瑞滨联合顺铂方案一线治疗的基础上联合血管内皮抑素治疗晚期NSCLC患者,能显著提高ORR并延长疾病进展时间。
PD-1/PD-L1抑制剂目前已经成为IV 期无驱动基因突变非鳞非小细胞肺癌一线标准治疗方案。III期临床研究IMpower110结果显示,对比化疗,阿替利珠单抗显著改善PD-L1高表达(TC≥50%或IC≥10%)的野生型IV期非鳞或鳞状NSCLC患者的PFS(HR=0.63)和OS(HR=0.59)。2021年NMPA批准阿替利珠单抗用于经NMPA批准的检测方法评估为PD-L1 TC≥50%或IC≥10%的EGFR/ALK阴性的转移性NSCLC一线单药治疗。KEYNOTE-024研究纳入了305例PD-L1 TPS均≥50%且EGFR/ALK野生型晚期NSCLC(包括鳞癌和腺癌)患者,帕博利珠单抗较化疗显著延长PFS(HR=0.50)和OS(HR=0.63),且不良反应发生率低于化疗组。KEYNOTE-042研究进一步将入组标准扩大至PD-L1 TPS≥1%,结果提示与化疗相比,帕博利珠单抗显著降低死亡风险19%,但亚组分析提示主要获益人群为PD-L1 TPS均≥50%的患者。NMPA已于2019年批准其一线适应症,适用于PD-L1 TPS≥1%患者。本指南将帕博利珠单抗一线治疗作为I级推荐,其中PD-L1 TPS≥50%为1A类证据,PD-L1 TPS≥1%为2A类证据。
免疫联合治疗方面,KEYNOTE-189研究显示帕博利珠单抗联合培美曲塞和铂类较单纯化疗治疗晚期EGFR/ALK野生型晚期NSCLC患者,联合治疗组ORR(47.6%vs.18.9%,P<0.0001)、PFS(HR=0.52)均有显著获益,且在各个PD-L1表达亚组均能获益,NMPA已批准帕博利珠单抗联合培美曲塞和铂类作为驱动基因阴性晚期非鳞NSCLC一线治疗。我国自主研发的PD-1单抗卡瑞丽珠单抗联合化疗(培美曲塞+卡铂)对比化疗一线治疗晚期/转移性非小细胞肺癌的CAMEL III期临床研究显示,卡瑞丽珠单抗+化疗组相比化疗组显著延长PFS(HR=0.60)和OS(中位,27.9个月vs.20.5个月,P=0.0117)。另一个我国自主研发的PD-1单抗信迪利单抗的III期ORIENT-11研究显示,信迪利单抗联合化疗组相比化疗组显著延长PFS。此外,RATIONALE 304研究结果显示,相较于单纯标准化疗,替雷利珠单抗联合铂类+培美曲塞达到主要研究终点,显著延长PFS。GEMSTONE-302研究结果显示,国产PD-L1单抗舒格利单抗联合铂类+培美曲塞治疗EGFR/ALK阴性的转移性NSCLC对比单纯标准化疗,显著延长PFS(中位,9.0个月vs.4.9个月,HR=0.48,P<0.0001),ORR提升至63.4%(63.4%vs.40.3%)。CHOICE-01研究结果显示,国产PD-1单抗特瑞普利单抗联合铂类+培美曲塞治疗EGFR/ALK阴性的转移性NSCLC对比单纯标准化疗,显著延长PFS(中位,9.7个月vs.5.5个月,HR=0.48,P<0.0001)和OS(未达到vs.17.0个月,HR=0.48,P=0.0002),NMPA于2022年9月批准了特瑞普利单抗联合标准化疗用于晚期驱动基因阴性非鳞NSCLC患者一线治疗的适应证,因此本指南将其从II级推荐上升为I级推荐。IMpower132研究结果显示与单纯化疗相比,阿替利珠单抗+铂类+培美曲塞治疗显著延长PFS2.5个月(中位,7.7个月vs.5.2个月,HR=0.56,P<0.0001)。NMPA于2021年批准阿替利珠单抗联合培美曲塞和铂类用于EGFR/ALK阴性的转移性非鳞NSCLC患者的一线治疗。
IMpower150研究总计纳入1202例患者(含EGFR或ALK突变患者),随机分至阿替利珠单抗+卡铂+紫杉醇组(402例,arm A),阿替利珠单抗+贝伐珠单抗+卡铂+紫杉醇(400例,arm B)及贝伐珠单抗+卡铂+紫杉醇(400例,arm C)。与arm C相比,arm B中阿替利珠单抗的加入显著延长PFS1.5个月(中位,8.3个月vs.6.8个月,HR=0.62,P<0.001);延长OS4.5个月(中位,19.2个月vs.14.7个月,HR=0.78,P=0.02);ORR提升至63.5%(63.5%vs.48.0%),亚组分析显示,EGFR/ALK突变及肝转移人群中更具优势。美国FDA和EMA批准阿替利珠单抗联合贝伐珠单抗及紫杉醇+卡铂一线治疗的适应症。此外,IMpower130研究显示,阿替利珠单抗联合化疗一线治疗无EGFR及ALK突变的晚期NSCLC患者,相比于单纯化疗可显著延长PFS(中位,7.0个月vs.5.5个月,HR=0.64,P<0.0001)和OS(中位,18.6个月vs.13.9个月,HR=0.79,P=0.033),美国FDA也批准白蛋白紫衫醇+卡铂联合阿替利珠单抗用于无EGFR及ALK突变的转移性NSCLC一线治疗。CHOICE-01研究显示,特瑞普利单抗联合培美曲塞和铂类一线治疗肺鳞状NSCLC,显著延长PFS 2.7个月(中位,8.3个月vs.5.6个月,HR=0.58,P=0.0001),OS表现临床获益趋势,ORR提升为58.6%(58.6%vs.26.5%),中位DoR为8.6个月vs.5.1个月,但上述方案均未获NMPA批准,将其纳入驱动基因阴性的晚期NSCLC一线治疗的II级推荐。
双免疫联合治疗(PD-1抑制剂联合CTLA-4抑制剂)一线治疗也报道了阳性结果。CheckMate-9LA研究是探索纳武利尤单抗+伊匹木单抗+2个周期的化疗对比单纯化疗治疗未曾接受系统治疗的晚期NSCLC的疗效和安全性的III期临床研究,结果显示中位随访13.2个月时,双免疫联合化疗治疗组较化疗组显著延长PFS(中位,6.7个月vs.5.0个月,HR=0.68)和OS(中位,15.6个月vs.10.9个月,HR=0.66),无论PD-L1表达水平和肿瘤组织学类型(鳞癌或非鳞癌)如何,双免疫+2周期化疗组据显示出临床获益。2020年美国FDA据此批准纳武利尤单抗+伊匹木单抗+化疗(2周期)一线用于晚期或复发的NSCLC,但中国暂未批准其适应症咸亨,因此本指南将其作为一线治疗的III级推荐。CheckMate-227研究Part1结果显示,与化疗相比,纳武利尤单抗联合伊匹木单抗治疗在PD-L1 TPS≥1%的患者中OS 获益显著(中位,17.1个月vs.14.9个月,HR=0.79,P=0.007),CR率显著提高至5.8%,中位DoR长达23.2个月。在PD-L1 TPS<1%的患者中OS也获益显著(中位,17.2个月vs.12.2个月,HR=0.62)。但该研究主要终点为PD-L1 TPS≥1%人群的OS,因此2020年美国FDA仅批准纳武利尤单抗联合伊匹木单抗用于PD-L1 TPS≥1%的EGFR/ALK阴性的转移性NSCLC一线治疗。未来需要更多的证据支持CheckMate-227研究方案的疗效,因此本指南暂时将其写入文字注释部分。
一项关于紫杉醇聚合物胶束的国内III期随机对照临床试验,将448例IIIB-IV期NSCLC患者随机分为紫杉醇聚合物胶束+顺铂组(300例)和紫杉醇+顺铂组(148例),与对照组相比,实验组的OS虽无显著延长,但ORR有显著改善(50%vs.26%,P<0.0001),中位PFS有显著获益(6.4个月vs.5.3个月,HR=0.63,P=0.0001),与治疗相关的严重不良反应发生率显著降低(9%vs.18%,P=0.0090)。 NMPA于2021年10月批准紫杉醇聚合物胶束联合铂类用于驱动基因阴性晚期NSCLC患者的一线治疗。因此本指南新增上述方案为一线治疗并作为I级推荐。
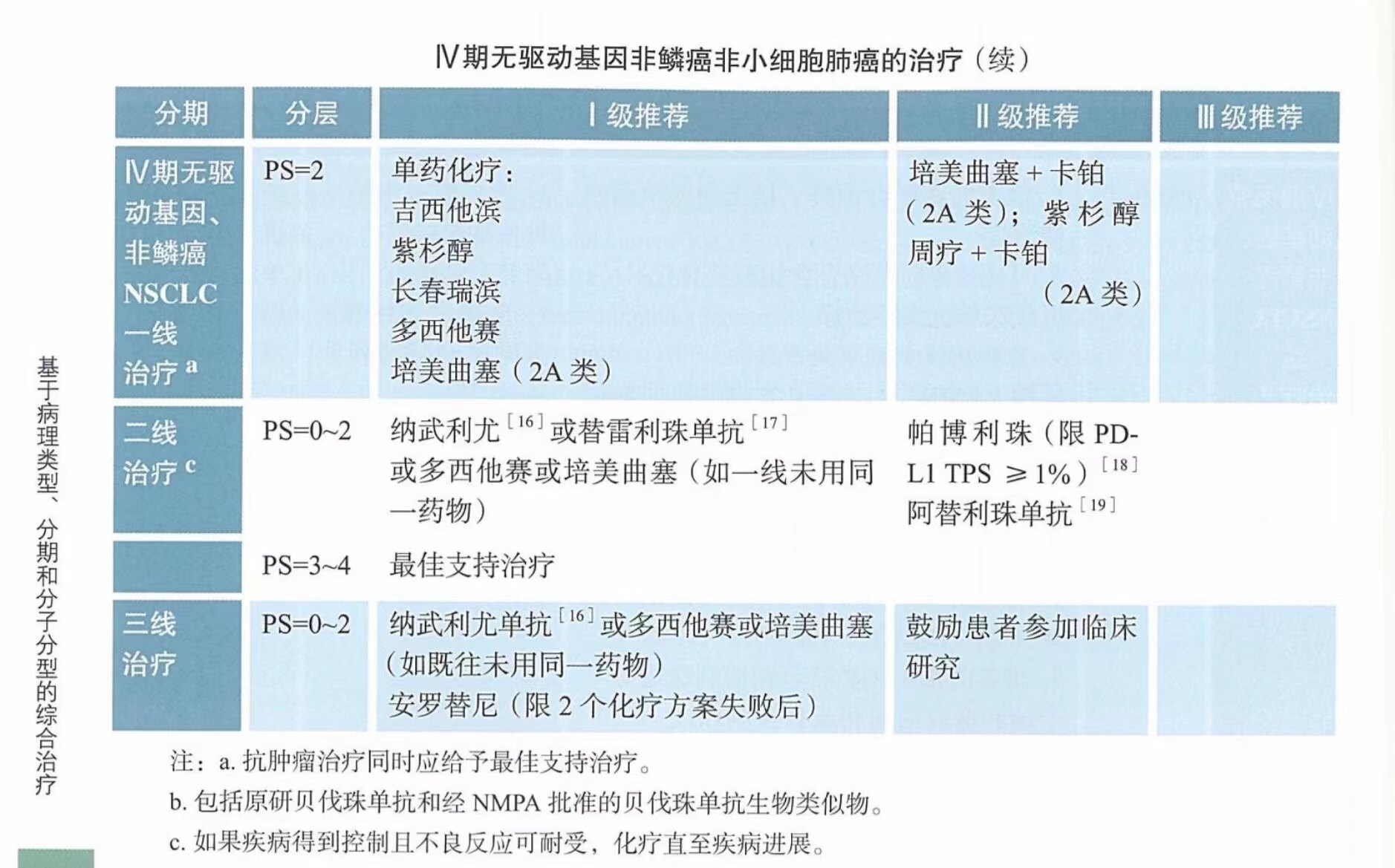
对PS评分为2分的患者,多项临床研究证实,单药化疗较最佳支持治疗(BSC)能延长生存期并提高生活质量。可选的单药化疗方案包括吉西他滨、长春瑞滨、紫杉醇、多西他赛或培美曲塞。IPSOS是一项随机对照III期临床研究,旨在比较阿特珠单抗和单药化疗在无驱动基因突变、PS较差(≥2)或70岁以上有并发症不适合接受含铂双药化疗局部晚期/转移性NSCLC中的疗效与安全性。结果显示:与单药化疗相比,阿替利珠单抗显著延长了患者OS(10.3个月vs.9.2个月,HR=0.78,P=0.028),ORR分别为16.9%和7.9%,两组中位DoR分别为14个月和7.8个月。目前NMPA及美国FDA均尚未批准阿特珠单抗在此类人群中的应用,故本次指南暂时将其写入文字注释部分。PS评分≥3分的患者不建议化疗,建议最佳支持治疗。
PD-1/PD-L1抑制剂免疫治疗已成为NSCLC(包括鳞癌和非鳞癌)二线治疗新标准。中国人群开展的纳武利尤单抗二线治疗CheckMate-078研究显示,纳武利尤单抗教多西他赛显著延长OS,提高ORR,且不良反应更优,NMPA已于2018年批准纳武利尤单抗二线适应症。我国自主研发的PD-1单抗替雷利珠单抗对比多西他赛二线/三线治疗晚期或者转移性NSCLC(包括鳞癌和非鳞癌)的RATIONALE 303III期临床研究结果显示替雷利珠单抗组相比化疗组显著延长OS(中位,17.2个月vs.11.9个月,HR=0.64,P<0.0001)。NMPA已批准替雷利珠单抗单药二线治疗非鳞状NSCLC,故本指南上调替雷利珠单抗的推荐等级至I级推荐。此外,KEYNOTE-010研究显示,在PD-L1表达阳性(PD-L1 YPS≥1%)晚期NSCLC中,帕博利珠单抗教多西他赛具有更好的OS 生存获益;OAK研究亚组分析显示,阿替利珠单抗二线治疗晚期NSCLC患者教多西他赛可以显著地延长OS。基于该两项研究结果,FDA批准了帕博利珠单抗用于PD-L1表达阳性(PD-L1 YPS≥1%)的晚期NSCLC的二线治疗;也批准了阿替利珠单抗用于转移性NSCLC含铂方案化疗后/敏感突变患者EGFR/ALK-TKI治疗后的二线治疗。帕博利珠单抗和阿替利珠单抗国内尚未批准肺癌二线治疗适应症,因此,本指南将其均作为II级推荐二线治疗晚期非鳞癌患者。此外,卡瑞丽珠单抗二线治疗晚期/转移性NSCLC的II期研究结果显示,整体的ORR达18.5%,中位PFS为3.2个月,中位OS为19.4个月,疗效与PD-L1表达具有一定的相关性。卡瑞丽珠单抗联合阿帕替尼在II期研究中显示出肿瘤活性,ORR为30.9%,中位PFS为5.7个月,中位OS为15.5个月。
PS评分为0-2分患者给予二线治疗。在二线治疗中,两药方案化疗较单药化疗未显示出生存获益。单药化疗可以改善疾病相关症状及OS。二线治疗可选方案包括多西他赛及培美曲塞。
盐酸安罗替尼三线治疗的III期临床研究(ALTER0303)纳入437例至少经两线治疗的IIIB/IV期NSCLC患者,分别给予安罗替尼(n=296)或安慰剂(n=143),结果显示,安罗替尼组能够显著延长PFS(中位,5.4个月vs.1.4个月,P<0.0001)和OS(中位,9.6个月vs.6.3个月,P=0.0018)。NMPA已于2018年5月批准安罗替尼的三线适应症,用于既往至少接受过2种系统化疗后出现进展或复发的局部晚期或转移性非小细胞肺癌患者的治疗。对于PS评分为0-2分的患者,积极的三线治疗或可带来获益,但需综合评估潜在的治疗风险与获益。推荐三线治疗可给予其二线未用的治疗方案,如纳武利尤单抗或多西他赛或培美曲塞治疗。
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论