 三甲
三甲
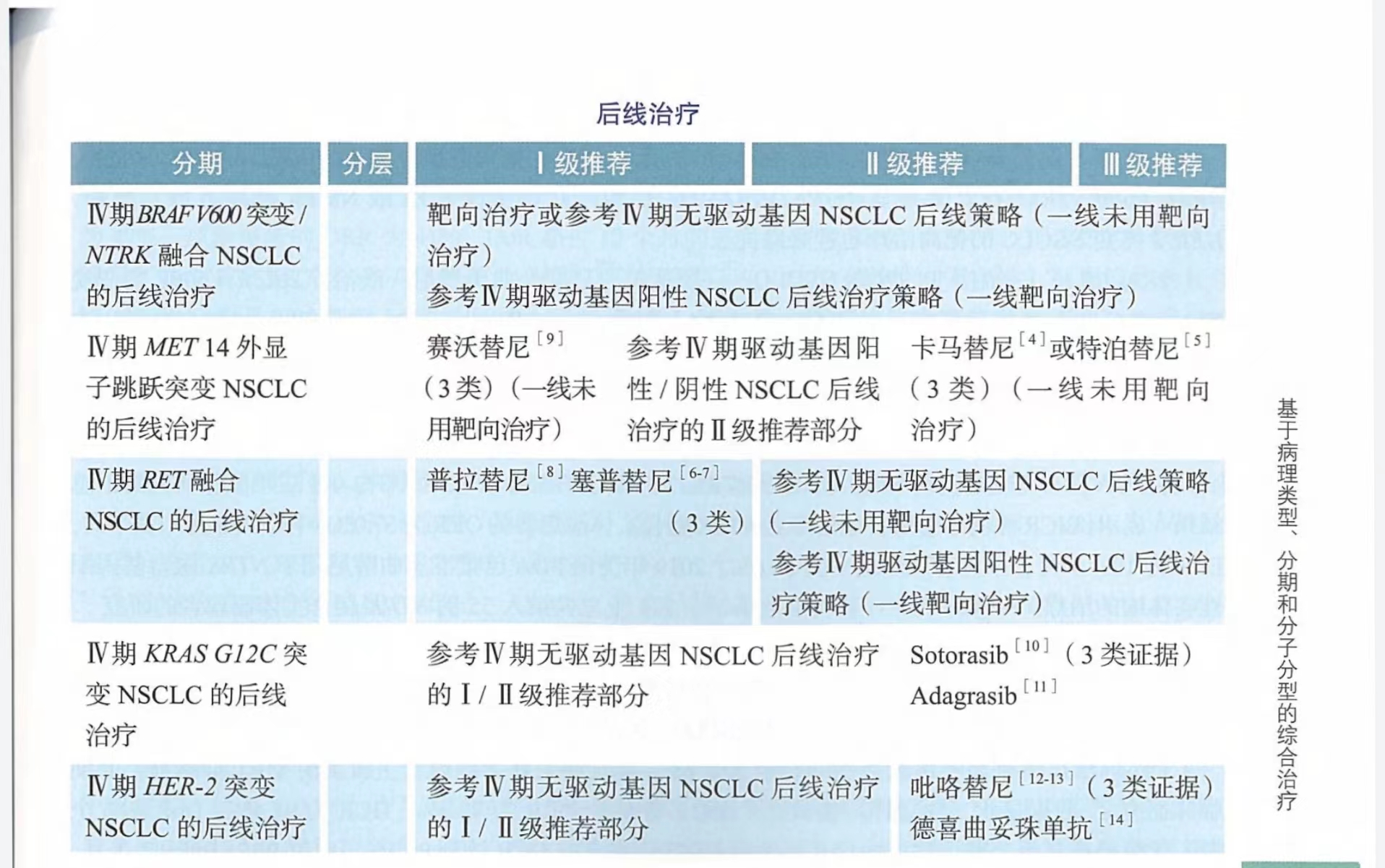
2023CSCO诊疗指南:IV期BRAF V600等少见突变非小细胞肺癌的治疗

注释:
近年来,国内外针对少见驱动基因靶点的临床研究产生重大突破,除EGFR/ALK/ROS1突变外,BRAF V600/NTRK/MET 14外显子/RET/KRAS G12C均已获得美国FDA或NMPA批准上市,此外,HER-2突变NSCLC的靶向治疗也迎来曙光。
针对BRAF V600突变的晚期NSCLC,一项达拉非尼联合曲美替尼一线治疗BRAF V600E突变晚期NSCLC的II期临床研究(NCT01336634)结果显示ORR为64%,中位PFS为10.9个月,中位DoR为10.4个月。美国FDA已批准达拉非尼联合曲美替尼用于BRAF V600突变转移性NSCLC的一线治疗。若联合治疗不耐受,可单用达拉非尼。目前,NMPA已批准达拉非尼联合曲美替尼治疗BRAF V600突变晚期NSCLC并纳入医保,因此本指南将其上调为I级推荐。
针对NTRK突变的晚期NSCLC,STARTRK-2、STARTRK-1和ALKA-372-001三项临床研究的汇总结果显示,BICK评估的恩曲替尼治疗后NTRK融合实体瘤患者的ORR为57.0%,中位PFS为11.2个月,DoR为10.4个月,颅内客观反应率为50.0%。2019年美国FDA已批准恩曲替尼用于NTRK融合基因阳性实体瘤的治疗。一项发表在《新英格兰医学杂志》上总共纳入55例NTRK融合实体瘤患者的研究显示拉罗替尼治疗ORR为75%,在1年时研究者评估,71%的患者应答持续,55%的患者保持无进展。因此美国FDA批准拉罗替尼用于无已知获得性耐药突变的NTRK融合肿瘤患者。目前,NMPA已批准恩曲替尼和拉罗替尼治疗NTRK融合晚期NSCLC,因此本指南将其上调为I级推荐。
针对MET 14外显子跳跃突变的晚期NSCLC,赛沃替尼作为国内自主研发的MET抑制剂,II期临床研究数据显示,独立评审委员会(IRC)评估的ORR为49.2%,DCR为93.4%,DoR达6个月。亚组分析显示,赛沃替尼治疗其他类型NSCLC患者的DCR达到95.1%,中位PFS达到9.7个月。基于此,NMPA已批准赛沃替尼用于治疗MET外显子14跳跃突变的后线治疗并纳入医保。故本指南将其上调为I级推荐。II期临床研究GEOMETRY mono-1研究针对卡马替尼治疗MET外显子14跳突的NSCLC患者,结果显示卡马替尼对初治患者的ORR为68%,DoR超过12个月的患者比例为47%;经治患者的ORR为41%,DoR超过12个月的患者比例为32%.此外另一项VISION研究揭示了特泊替尼治疗含MET外显子14跳突的晚期NSCLC的有效性和安全性。根据液体活检或组织活检确定是否检测到MET外显子14跳跃突变,结果显示特泊替尼在血液+组织联合活检组的有效率为46%,mDoR达11.1个月,液体活检组66例,有效率为48%,组织活检组60例,有效率为50%。基于此,美国FDA已批准卡马替尼和特泊替尼用于一线和后线治疗局部晚期或转移性MET外显子14跳突的NSCLC患者,但国内尚未批准上市,因此本指南仅将两者作为III级推荐。谷美替尼是国产的新型MET抑制剂,单臂II期GLORY研究评估了谷美替尼治疗携带METex14跳突的局部晚期或转移性NSCLC的有效性和安全性。结果显示:总体ORR为60.9%;在初治患者中,ORR为66.7%;在经治患者中,ORR为51.9%。总体人群PFS为7.6个月。
针对RET融合的晚期NSCLC,ARROW研究结果显示,RET抑制剂普拉替尼(BLU-667)在接受或未接受治疗的RET融合阳性NSCLC患者中均显示出临床获益,经治患者ORR为62%,PFS为16.5个月;初治患者ORR为79%,PFS为13.0个月。基于ARROW研究阳性结果,普拉替尼于2021年被NMPA批准上市,用于既往接受过含铂化疗的RET融合基因阳性晚期NSCLC患者,因RET融合基因为罕见突变,开展随机对照研究难,经专家组投票后决议,本次指南将其上调为I级推荐。鉴于2022年10月NMPA已受理普拉替尼治疗晚期RET融合阳性NSCLC一线治疗申请,且美国FDA已批准普拉替尼一线治疗RET融合阳性晚期NSCLC。经专家组投票,本次指南新增“普拉替尼一线治疗RET融合阳性晚期NSCLC”并作为II级推荐。LIBRETTO-001研究探索了赛普替尼(LOXO-292)在RET融合患者中的疗效和安全性,结果显示ORR为64%,DoR达17.5个月,DoR超过6个月的患者比例为81%。NMPA已批准赛普替尼用于RET融合阳性晚期NSCLC,因此本指南将其上调为I级推荐。
针对KRAS G12C突变的晚期NSCLC,CodeBreak 100 II期临床研究结果显示,Sotorasib(AMG 510)治疗KRAS突变NSCLC的ORR为37.1%,DCR为80.6%,中位PFS为6.8个月。此外,Adagasib(MRTX849)在KRAS G12C突变的晚期NSCLC中也显示出了良好的抗肿瘤活性,KRYSTAL 01临床研究结果显示,Adagasib(MRTX849)的ORR为43%,DCR为80.0%,中位PFS为6.5个月,中位OS为12.6个月。2022年FDA已批准Adagasib上市,用于携带KRAS G12C突变的NSCLC患者的后线治疗,但国内尚未上市,因此本指南将其作为III级推荐。
针对HER2突变的晚期NSCLC,吡咯替尼作为一种广泛ErbB受体络氨酸激酶抑制剂,显示出良好的疗效。目前关于吡咯替尼治疗HER2突变型铂类化疗后晚期肺腺癌的II期临床研究(NCT02834936)结果显示,经IRC评估的ORR为30.0%,DoR为6.9个月,中位PFS为6.9个月,中位OS为14.4个月,且安全性良好。NMPA已批准吡咯替尼联合卡培他滨应用于HER2阳性晚期乳腺癌,但尚未批准NSCLC适应症。因此本指南将其作为HER2突变NSCLC后线治疗的III级推荐。此外,德喜曲妥珠单抗(DS-8201a)在HER2突变的晚期NSCLC也显示出良好的抗肿瘤活性,客观缓解率、中位无进展生存期、中位总生存期分别为55%、8.2个月、17.8个月,目前FDA已批准德喜曲妥珠单抗用于后线治疗HER2突变晚期NSCLC,且中国于2023年2月获批其乳腺癌适应症,经专家组投票,上调其为III级推荐。
本文为转载文章,如有侵权请联系作者删除。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论