
WAO过敏白皮书:2013年更新(第8版)之七: 过敏原、过敏原防护、过敏性疾病的预防
一、 过敏原
(一) 关键声明
•高达40%的人群对环境外来蛋白质敏感(IgE抗体)。
•这种敏感与接触来自花粉、霉菌、尘螨和蟑螂的蛋白质密切相关。
•对于哮喘、鼻炎和特应性湿疹,疾病和致敏之间存在着强烈而一致的联系。
•对草花粉的敏感性与草花粉季节出现的花粉热症状之间的联系为草花粉在疾病中的因果作用提供了有力的证据。
(二)介绍
主要的常年性过敏原对鼻炎、哮喘和特应性皮炎等疾病的影响是慢性的,通常对患者或医生来说并不明显。因此,因果关系的论点必须是间接的,目前过敏原暴露与这些疾病及其管理的相关性仍然存在重要问题。
在西方国家,“过敏性疾病”影响10-30%的人口,并可能导致严重症状,严重影响生活质量。最常见的过敏性疾病,即鼻炎、哮喘和特应性皮炎,其特征是对社区1-5中常见的过敏原的高致敏率。这种致敏作用可以通过皮肤试验或IgE抗体的体外测定来检测。术语过敏性(或特应性)不仅意味着患者被致敏,而且过敏原也会导致疾病。因此,过敏原暴露或致敏都可以被称为过敏性疾病的风险因素。然而,过敏原暴露与疾病之间的关系绝非简单(图1)。
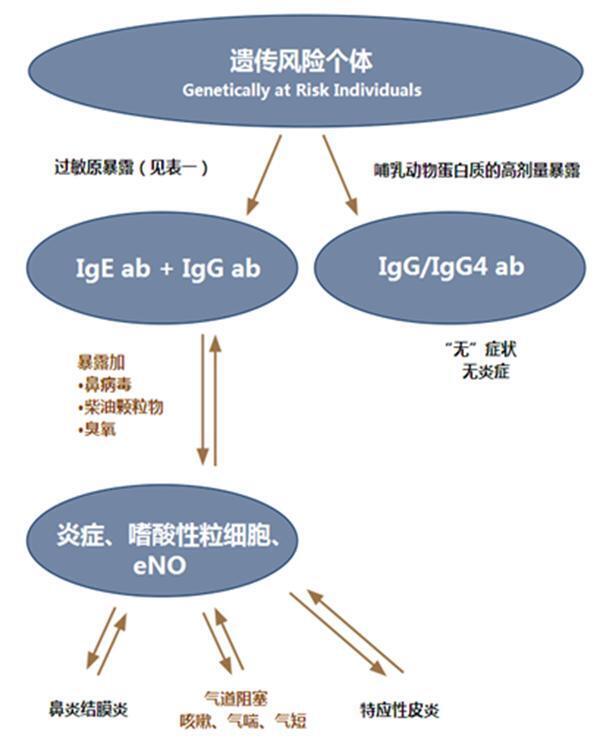
图1 过敏原暴露和致敏是过敏性疾病的危险因素
不同的因素可以影响IgE抗体反应,包括遗传学、过敏原剂量和可能抑制或增强反应的早期暴露6。在过敏受试者中,炎症的发展(鼻子、肺或皮肤)很常见,但这也受到多种因素的影响。最后,即使是在个人中,谁i)是敏感的;ii)持续接触;和iii)已经出现炎症——症状的严重程度存在重大的个体和时间差异。
当考虑不同的吸入性过敏原时,最重要的区别是室外过敏原(如花粉和霉菌)和室内过敏原(例如猫、狗、螨、蟑螂和霉菌)之间的区别(表1)[参见www.allergen.org获取过敏原来源和纯化过敏原的完整列表]。
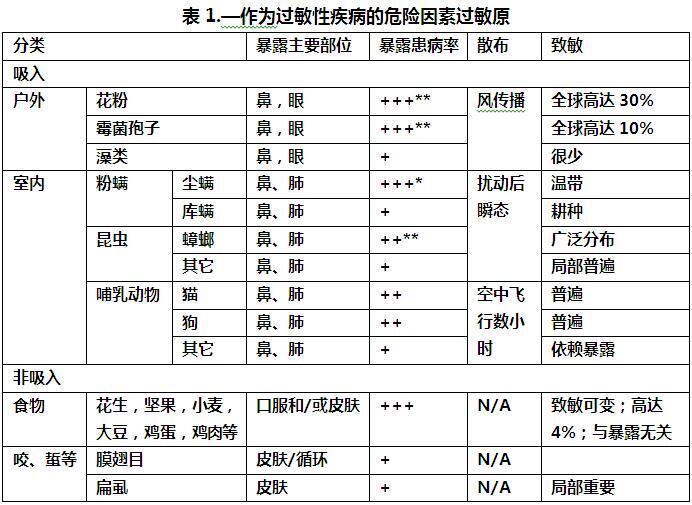
(三)户外过敏原
从1870年到1940年的70年间,季节性花粉热在北欧和美国变得很常见。这是一个发生了若干变化的时期;卫生状况有了重大改善,人口越来越城市化,黑麦草和豚草等大量授粉植物也有所增加。除了症状的独特且通常严格的季节性模式外,花粉热与常年性鼻炎的区别还在于结膜炎的存在。这反映了过敏原颗粒以足够的速度“吹”进眼睛的条件下的暴露,而这种情况在室内不太常见。最常见的户外过敏原是草、树或杂草的花粉,每种花粉都有特定的季节7-9。特征性地,接触花粉的次数越多:i)IgE抗体的流行率越高;ii)IgE抗体的滴度越高;以及iii)季节性症状的严重程度越大。花粉粒释放出物种特异性蛋白质,从而触发花粉管的形成。因此,蛋白质的快速释放是花粉粒的主要功能。大多数(但不是所有)花粉都可以在显微镜下分辨出来。
霉菌过敏原也是致敏的一个重要原因7,10,11。然而,霉菌和花粉之间存在显著差异。霉菌的季节没有严格定义,此外,霉菌孢子的“设计”是为了在长时间的干旱期内存活。因此,在许多情况下,霉菌不会快速释放蛋白质,并且在某些情况下,蛋白质仅在孢子发芽后表达。真菌孢子的大小也有很大差异,从链格孢属的典型14x10µm到曲霉或青霉孢子的典型直径2µm。许多霉菌属的孢子都可以确定,但物种定义不太可靠。当将花粉粒与真菌孢子进行比较时,重要的是要认识到,大多数花粉粒的直径是小真菌孢子的十倍(即,20µm与2µm直径相比),是后者的体积约1000倍。从数量上看,花粉粒是致敏的更有效原因,但如果根据吸入的蛋白质量来判断接触情况,评估可能会大不相同12。
暴露于室外过敏原取决于空气中颗粒物的数量、在室外度过的时间以及室内环境与室外隔离的效率。在过去的40年里,家庭和办公室的空调和供暖逐渐“改善”,因此在一些国家,一年中有好几个月都关着窗户是正常的。对于花粉热患者和儿童来说,这意味着可以有效地躲避暴露。
(四)室内过敏原
直到1985年,从房屋灰尘中提取的提取物被常规用于皮肤测试和免疫治疗。室内存在的任何外来物种都可能导致房屋灰尘提取物中的过敏原。大多数过敏专科医生放弃了用室内灰尘进行皮肤测试,原因有两个。首先,有一种感觉是,我们对室内过敏原的主要来源有了更好的了解(有争议),其次,因为似乎不可能将“房屋灰尘”标准化(没错)。室内过敏原的大多数主要来源都已确定,即尘螨、猫、狗、啮齿动物、蟑螂和各种霉菌1,13。此外,对于其中的许多,有敏感的免疫测定法可以测量房子里过敏原的数量。虽然免疫测定存在一些问题,包括进行免疫测定的技术问题及其详细的特异性,但在“室内花粉计数”方面没有其他选择14。携带螨虫、蟑螂、猫或狗过敏原的颗粒没有足够的区别,无法在显微镜下计数。室内空气传播的颗粒物计数也是不可能的,因为携带螨和蟑螂过敏原的颗粒物在受到干扰后不会在空气中停留超过几分钟。猫和狗的过敏原在空气中停留的时间更长,与较小的空气动力学尺寸15保持一致。然而,仍然无法用显微镜计数猫或狗的皮屑颗粒。
对猫或狗过敏原的耐受性:在多项致敏研究中,研究表明,与动物一起饲养的儿童对该动物致敏的可能性较小或不太可能。虽然这种“耐受”的机制尚不清楚,但有证据表明,儿童对猫过敏原16、17产生IgG和IgG 4抗体。同样清楚的是,有IgG和IgG 4抗体而没有IgE抗体的儿童没有哮喘的风险(图1)。
暴露于室内过敏原的评估:房屋灰尘中蛋白质的测量值通常表示为微克/克灰尘。这允许在房屋之间和国家之间进行比较。然而,在个体家庭中使用测量假设,对室内过敏原的主要接触或唯一显著接触发生在个体自己的家中。有大量证据表明,对猫和狗过敏原的致敏可能发生在儿童自己家之外18。同样,在其他家庭中接触尘螨过敏原的可能性越来越大。已经使用各种不同的技术对吸入的过敏原的数量进行了估计。对于猫或狗的过敏原,吸入过敏原的估计值高达1微克/天,相比之下,大多数螨或蟑螂暴露的估计值为5-20纳克/天,即低50倍1,13。比较空气中暴露于猫过敏原的家庭和动物;没有动物;或者在学校是可靠的。相比之下,由于难以“标准化”干扰水平,在不同环境下对螨的空气传播测量进行比较变得非常困难(表1)。
被提议作为致敏或疾病的风险因素或阈值的值需要谨慎解释。化学品的阈值基于化学品的已知毒性水平。吸入的过敏原是无毒的,除非个人变得敏感。因此,可以提出致敏个体的过敏原暴露阈值和哮喘症状的单独阈值。然而,也有一些人出现了远低于这些阈值的致敏或症状。同样,也有大量非特应性个体(占总人口的50-70%)既没有致敏,也没有症状,即使暴露在高于阈值50倍的室内或室外过敏原水平下。尽管风险因素的概念可用于许多不同形式的暴露,但该术语最常用于室内过敏原暴露或作为哮喘风险因素的对室内过敏原的致敏。
(五)其它过敏原:食物、真菌定植、毒液等
不被吸入的过敏原可以在传统的吸入性疾病中发挥作用,并产生自己独特的疾病模式。在某些情况下,如食物过敏,症状主要是口腔、胃肠道或荨麻疹。然而,食物过敏原可能具有显著的区域性19。食物过敏原在特应性皮炎中起着重要作用,在所有严重病例中都应该考虑它们20。然而,相关食物无处不在,因此这些食物不能被视为疾病的风险因素。如果暴露是普遍的,那么是免疫反应造成了风险。
有刺昆虫毒液也是一种强效过敏原,毒液暴露显然是IgE反应和随后anaphylactic的风险因素。易引起吸入反应的因素和易引起毒液反应的因素之间只有很小的重叠。
在哮喘和/或鼻窦炎的病例中,肺部或脚部的真菌定植已被判定。在肺部曲霉菌感染的情况下,真菌导致肺部疾病的机制相对明显。此外,越来越多的证据表明,抗真菌治疗可以帮助这些病例21。另一方面,目前尚不清楚定植是否与暴露增加有关。事实上,(曲霉菌和毛霉菌毒素)暴露可能是普遍的,也是免疫反应造成了风险10,11,22。
(六)过敏原和其它危险因素之间的相互作用
广泛的环境和生活方式因素会导致“过敏性”疾病(图1)。此外,这些因素很可能相互作用,导致疾病的症状或恶化。化学物质和颗粒物空气污染可能在世界某些地区发挥重要作用,有充分证据表明,这些影响在过敏患者中被夸大了。对于空气污染,其影响似乎与剂量直接相关,但在一些研究中,最大影响似乎是在最大暴露后24至48小时23。很少有证据表明,个人对污染的免疫反应会改变空气污染的影响。
人类鼻病毒(HRV):人类鼻病毒是一个特殊的例子,病毒与先前存在的过敏性炎症之间可能存在重大的积极相互作用24。从自然发生和实验性感染的经验来看,HRV会导致感冒,但对非过敏个体的肺部几乎没有影响。相反,当过敏性哮喘患者受到HRV攻击时,嗜酸性粒细胞显著上调,咳嗽加剧,在5-10%的病例中,哮喘恶化。
(七)蠕虫和体外寄生虫是IgE抗体反应的原因,而不是过敏症状的风险
在传统的热带村庄,哮喘和过敏性疾病仍然很罕见,但尽管如此,许多或大多数儿童的血清总IgE显著升高。虽然人们认为这种IgE主要是由蠕虫感染引起的,但IgE的详细特异性尚不清楚。因此,存在一个悬而未决的问题,即总IgE的升高是否与过敏性疾病无关,或者它是否干扰过敏性疾病的风险25。
有趣的是,在热带厄瓜多尔进行的一项病例对照研究结果显示,抗蛔虫IgE的存在是近期喘息的一个重要风险因素,这种关联似乎独立于对螨虫和蟑螂的特异性IgE 26。最近的证据表明,蜱虫叮咬也会导致血清总IgE升高27。有趣的是,在这种情况下,IgE抗体反应可能包括对寡糖半乳糖α-1,3-半乳糖的高滴度IgE抗体28。这种IgE抗体可能会对猫和狗的过敏原产生“假阳性”血清IgE抗体反应,但皮肤测试非常差,接触猫时没有症状。这些结果表明,至少在某些情况下,寄生虫诱导的IgE实际上可以“阻断”过敏反应。同样,似乎通过肠道或皮肤暴露于寄生虫可以诱导对碳水化合物或蛋白质表位的IgE抗体反应,当食用或吸入可溶性蛋白质时,这些表位不会诱导IgE抗体响应。
(八)当前和未来需求
在过去的二十年里,已经确定了与吸入剂过敏相关的主要过敏原(www.allergen.org)。此外,还可以通过测定来测量环境中的许多主要过敏原。现在需要的是更好地了解这些过敏原对过敏性疾病的发展和这些疾病症状的影响。尽管有大量关于哮喘的证据,但对于过敏原特异性治疗与哮喘管理的相关性仍存在分歧。对于严重的特应性皮炎,情况更令人困惑,因为尽管这些患者是我们所看到的最过敏的受试者,但仍有许多医生不认识过敏原暴露在疾病中的作用。
(九)研究需求
越来越多的最有趣的问题涉及治疗应该如何受到有问题哮喘患者表型的影响。为了理解这一点,我们需要更好地了解哮喘的过敏基础如何影响其他细胞向呼吸道的募集,包括嗜酸性粒细胞和T细胞。此外,还有关于IgE抗体如何影响肺部发生的生化事件的研究问题,最明显的标志物是呼出的NO和pH。同样,我们需要更好地了解包括eNO、嗜酸性粒细胞和BHR在内的肺部炎症如何影响对鼻病毒的反应。
(十)未满足的需求
随着IgE抗体的准确定量测量和环境过敏原检测的可用性,我们应该进入一个不同的研究阶段。这将侧重于了解过敏原暴露对皮肤、鼻子或肺部的影响。此外,专注于使用成分建立对吸入物和食物过敏原的IgE反应谱的研究正在进行中,目的是改进诊断,识别特定表型,并帮助预测临床结果和对治疗的反应29-32。此外,我们迫切需要更好地了解过敏性炎症与细菌和真菌定殖之间的相互作用。这似乎与哮喘和特应性皮炎有关,但对理解慢性鼻窦炎也可能很重要。最重要的是,我们需要了解通常为轻度或中度的过敏性疾病易患严重疾病的方式。
参考文献
1. Platts-Mills TA, Vervloet D, Thomas WR, Aalberse RC, Chapman MD: Indoor allergens and asthma: Report of the third international workshop. J Allergy Clin Immunol 1997; 100:S2-24.
2. Sporik R, Holgate ST, Platts-Mills TA, Cogswell JJ: Exposure to house-dust mite allergen (der p i) and the development of asthma in childhood. A prospective study. N Engl J Med 1990; 323:502-507.
3. Illi S, von Mutius E, Lau S, Niggemann B, Gruber C, Wahn U: Perennial allergen sensitisation early in life and chronic asthma in children: A birth cohort study. Lancet 2006; 368:763-770.
4. Rullo V, Rizzo M, Arruda L, Sole D, Naspitz C: Daycare centres and schools as sources of exposure to mites, cockroach, and endotoxin in the city of Sao Paulo, Brazil. J Allergy Clin Immunol 2002; 110: 582-8.
5. Zhang L, Chew FT, Soh SY, Yi FC, Law SY, Goh DY, Lee BW: Prevalence and distribution of indoor allergens in Singapore. Clin Exp Allergy 1997; 27:876-885.
6. Andiappan AK, Wang de Y, Anantharaman R, Suri BK, Lee BT, Rotzschke O, Liu J, Chew FT. Replication of genome-wide association study loci for allergic rhinitis and house dust mite sensitization in an Asian population of ethnic Chinese in Singapore. J Allergy Clin Immunol 2013; 131:1431-1433
7. Chew FT, Lim SH, Shang HS, Dahlia MD, Goh DY, Lee BW, Tan HT, Tan TK: Evaluation of the allergenicity of tropical pollen and airborne spores in Singapore. Allergy 2000; 55:340-347.
8. Sears MR, Herbison GP, Holdaway MD, Hewitt CJ, Flannery EM, Silva PA: The relative risks of sensitivity to grass pollen, house dust mite and cat dander in the development of childhood asthma. Clin Exp Allergy 1989; 19:419-424.
9. Thommen A: Hay Fever. in A.F. Coca, M. Waltzer, and A.A. Thommen (eds). Asthma and hay fever in theory and practice. Sprinfield, iee. Thomas, 1931,
10. Halonen M, Stern DA, Wright AL, Taussig LM, Martinez FD: Alternaria as a major allergen for asthma in children raised in a desert environment. Am J Respir Crit Care Med 1997; 155:1356-1361.
11. O’Hollaren MT, Yunginger JW, Offord KP, Somers MJ, O’Connell EJ, Ballard DJ, Sachs MI: Exposure to an aeroallergen as a possible precipitating factor in respiratory arrest in young patients with asthma. N Engl J Med 1991; 324:359-363.
12. Esch R BR: Esch R, bush R: Aerobiology of outdoor allergens in Middleton’s Allergy Principles & Practice (seventh edition) by Elsevier, inc., 2009, pp 509-537.
13. Arruda LK: Cockroach allergens. Curr Allergy Asthma Rep 2005; 5:411-416.
14. van Ree R, Chapman MD, Ferreira F, Vieths S, Bryan D, Cromwell O, Villalba M, Durham SR, Becker WM, Cistero Bahima A, Custovic A, et al: The create project: Development of certified reference materials for allergenic products and validation of methods for their quantification. Allergy 2008; 63:310-326.
15. Luczynska CM, Li Y, Chapman MD, Platts-Mills TA: Airborne concentrations and particle size distribution of allergen derived from domestic cats (felis domesticus). Measurements using cascade impactor, liquid impinger, and a two-site monoclonal antibody assay for fel d i. Am Rev Respir Dis 1990; 141:361-367.
16. Hesselmar B, Aberg B, Eriksson B, Bjorksten B, Aberg N: High-dose exposure to cat is associated with clinical tolerance - a modified th2 immune response? Clin Exp Allergy 2003; 33:1681-1685.
17. Platts-Mills T, Vaughan J, Squillace S, Woodfolk J, Sporik R: Sensitisation, asthma, and a modified th2 response in children exposed to cat allergen: A population-based cross-sectional study. Lancet 2001; 357:752-756.
18. Almqvist C, Egmar A, Hedlin G, Lundqvist M, Nordvall S, Pershagen G, Svartengren M, van Hage-Hamstein M, Wickman M: Direct and indirect exposure to pets-risk of sensitization and asthma at 4 years in a birth cohort. Clin Exp Allergy 2003; 33: 1190-1197.
19. Lim DL, Neo KH, Yi FC, Chua KY, Goh DL, Shek LP, Giam YC, Van Bever HP, Lee BW: Parvalbumin--the major tropical fish allergen. Pediatr Allergy Immunol 2008; 19:399-407.
20. Han Y, Chung SJ, Kim J, Ahn K, Lee SI: High sensitization rate to food allergens in breastfed infants with atopic dermatitis. Ann Allergy Asthma Immunol 2009;103:332-336.
21. Denning DW, O’Driscoll BR, Powell G, Chew F, Atherton GT, Vyas A, Miles J, Morris J, Niven RM: Randomized controlled trial of oral antifungal treatment for severe asthma with fungal sensitization: The fungal asthma sensitization trial (fast) study. Am J Respir Crit Care Med 2009;179:11-18.
22. Ward GW, Jr., Woodfolk JA, Hayden ML, Jackson S, Platts-Mills TA: Treatment of late-onset asthma with fluconazole. J Allergy Clin Immunol 1999; 104:541-546.
23. Chew FT, Goh DY, Ooi BC, Saharom R, Hui JK, Lee BW: Association of ambient air-pollution levels with acute asthma exacerbation among children in Singapore. Allergy 1999; 54:320-329.
24. Heymann PW, Carper HT, Murphy DD, Platts-Mills TA, Patrie J, McLaughlin AP, Erwin EA, Shaker MS, Hellems M, Peerzada J, Hayden FG, Hatley TK, Chamberlain R: Viral infections in relation to age, atopy, and season of admission among children hospitalized for wheezing. J Allergy Clin Immunol 2004; 114:239-247.
25. Soto-Quiros M, Avila L, Platts-Mills TA, Hunt JF, Erdman DD, Carper H, Murphy DD, Odio S, James HR, Patrie JT, Hunt W, O’Rourke AK, Davis MD, Steinke JW, Lu X, Kennedy J, Heymann PW. High titers of IgE antibody to dust mite allergen and risk for wheezing among asthmatic children infected with rhinovirus. J Allergy Clin Immunol 2012; 129:1499-1505.
26. Cooper PJ: Interactions between helminth parasites and allergy. Curr Opin Allergy Clin Immunol 2009; 9:29-37.
27. Moncayo AL, Vaca M, Oviedo G, Workman LJ, Chico ME, Platts-Mills TA, Rodrigues LC, Barreto ML, Cooper PJ: Effects of geohelminth infection and age on the associations between allergen-specific IgE, skin test reactivity and wheeze: a case-control study. Clin Exp Allergy 2013; 43: 60-72.
28. Commins S, Platts-Mills TAE: Anaphylaxis syndromes related to a new mammalian cross-reactive carbohydrate determinant. J Allergy Clin Immunol 2009; 124: 652-657.
29. Chung CH, Mirakhur B, Chan E, Le QT, Berlin J, Morse M, Murphy BA, Satinover SM, Hosen J, Mauro D, Slebos RJ, Zhou Q, Gold D, Hatley T, Hicklin DJ, Platts-Mills TA: Cetuximab-induced anaphylaxis and IgE specific for galactose-alpha-1,3-galactose. N Engl J Med 2008;358: 1109-1117.
30. Kidon MI, Chiang WC, Liew WK, Ong TC, Tiong YS, Wong KN, Angus AC, Ong ST, Gao YF, Reginald K, Bi XZ, Shang HS, Chew FT. Mite component-specific IgE repertoire and phenotypes of allergic disease in childhood: the tropical perspective. Pediatr Allergy Immunol 2011;22:202-10.
31. Barbosa MC, Santos AB, Ferriani VP, Pomés A, Chapman MD, Arruda LK. Efficacy of recombinant allergens for diagnosis of cockroach allergy in patients with asthma and/or rhinitis. Int Arch Allergy Immunol 2013;161:213-9.
32. Yang AC, Arruda LK, Santos AB, Barbosa MC, Chapman MD, Galvão CE, Kalil J, Morato-Castro FF. Measurement of IgE antibodies to shrimp tropomyosin is superior to skin prick testing with commercial extract and measurement of IgE to shrimp for predicting clinically relevant allergic reactions after shrimp ingestion. J Allergy Clin Immunol 2010; 125:872-8.
二、过敏原防护
(一)关键声明
•有效避免过敏原可改善过敏患者的症状。
•几项针对哮喘儿童的综合环境干预研究报告了益处。
•对于成人哮喘,几乎没有证据支持使用简单、单一的干预措施(例如仅覆盖床上用品)来控制尘螨过敏原水平。
•同样,对于患有鼻炎的螨过敏患者,单一的避螨措施也没有益处。
•应使用以下内容来指导避免过敏原的务实方法:
–采用全面的环境干预措施,尽可能最大限度地减少过敏原暴露。
–根据患者的过敏原致敏和暴露状态量身定制干预措施。
–如果无法评估过敏原暴露水平,则使用过敏原特异性IgE抗体水平或皮肤试验风团的大小作为指标。
–在疾病自然史上尽早开始干预。
–应制定和评估旨在消除或减少接触潜在致敏剂的初级预防策略。
(二)介绍
过敏个体暴露于过敏原会导致哮喘和鼻炎恶化1-3。然而,证明家庭过敏原暴露会导致易感个体症状的严重程度,与证明避免过敏原的好处不同4。
(三)避免过敏原有效吗?
花粉热患者在花粉季节以外不接触花粉与症状完全缓解有关。将过敏性哮喘患者从家中转移到医院或高海拔疗养院的低过敏原环境中,可以显著改善哮喘控制5。职业性哮喘是另一种可提供信息的模型;早期诊断并离开发生接触的工作场所与康复有关,而长期接触可能导致哮喘的持续或逐渐恶化(即使最终停止接触)6。这些例子说明完全避免致敏过敏原可以改善过敏患者的症状,并为避免过敏原的益处提供了原理证明。然而,挑战在于通过可在患者家中使用的简单实用的措施来实现同样的结果。
(四)可在患者家中使用的实用过敏原预防措施
1、如何避免螨过敏原:减少螨和螨过敏原可以通过多种方式解决(表7)4,5。减少床上接触的最有效措施是用螨过敏原不可渗透的套子盖住床垫、羽绒被和枕头。由于螨虫会在暴露的床上用品上积聚,因此应在热循环中清洗(高于55°C;低温清洗可以去除过敏原,尘螨可以存活下来)。应移除地毯,并用硬地板(如木地板或乙烯基地板)代替。用皮革或乙烯基覆盖物代替织物覆盖的软垫家具,用百叶窗代替窗帘,可能有助于减少个人暴露。
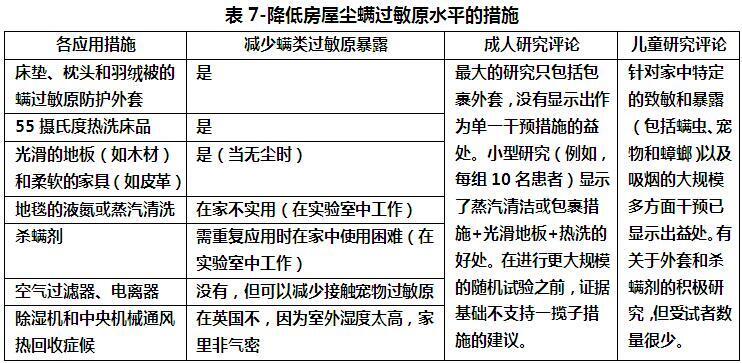
另一种方法是通过控制室内湿度来防止螨虫生长和存活(螨虫需要高湿度才能存活)。这种方法主要取决于气候和住房设计的类型7。
只有通过综合环境控制战略,结合适合患者个人、家庭和地理区域的最有效措施,才能大幅减少接触;简单、单一的措施不太可能达到预期效果。严格的全面环境控制制度可以在很长一段时间内实现并保持低过敏原环境8,但成本高昂,一些患者可能认为这是不可接受的。
2、避免宠物过敏原:有效减少接触猫或狗过敏原的唯一方法是不要在家里有猫或狗;即使将动物从家中永久移走,过敏原储备水平也可能需要数月才能下降9。高效空气过滤器空气净化器、内置高效空气过滤器的真空吸尘器和双层厚的袋子可以实现空气中过敏原的短期和适度减少。当宠物被关在家里时,定期清洗宠物并不能显著减少个人吸入过敏原的暴露。
(五)治疗哮喘和鼻炎中的过敏原避免
关于室内过敏原控制在哮喘和鼻炎中的有效性的证据是相互矛盾的。
1、系统评价:避免尘螨研究11的Cochrane荟萃分析的更新(最近的一项研究涉及54项试验中的3002名患者12)得出结论,目前避免尘螨过敏原的方法不应推荐给对尘螨敏感的哮喘患者(图4)。作者认为,缺乏临床效果的最可能解释是,研究中使用的回避方法没有充分降低螨虫过敏原水平,因为“完全去除主要刺激剂是无效的,这从本质上来说似乎是不可信的”12。此外,考虑到对螨敏感的哮喘患者通常对其他过敏原敏感,只关注螨可能不是正确的方法。
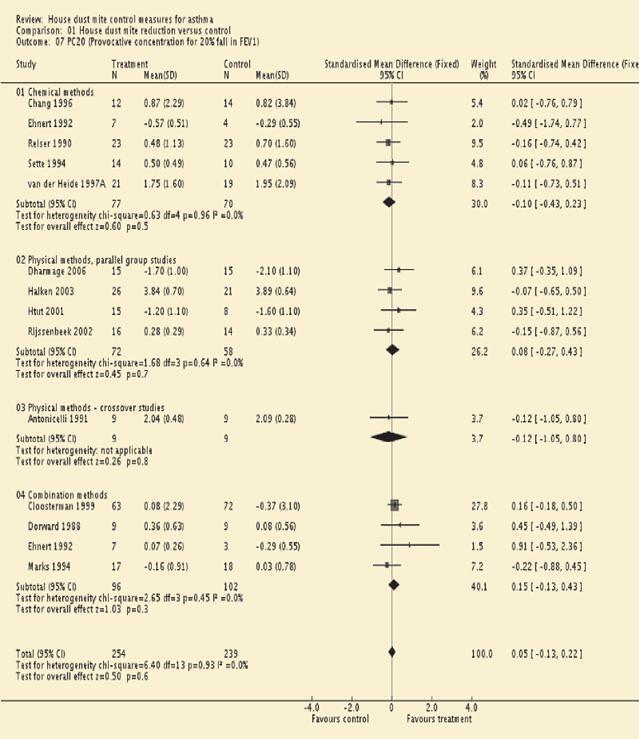
图4。哮喘的室内尘螨控制措施,比较室内尘螨减少与控制:结果指标=PC20(FEV1下降20%的激发浓度)。来自Gotzsche P, Johansen H. House dust mite contr
Cochrane气道组(Airways Group)试图研究家庭除湿对哮喘控制的影响13,但只有一项试验符合纳入标准,反映出该领域的证据质量较差。
Cochrane对常年性过敏性鼻炎防螨措施的系统综述的更新反映了哮喘的研究结果,几乎没有证据表明使用简单、单一的措施可以持续改善疾病控制。上一次更新包括9项试验,涉及501名参与者。7项研究规模较小,质量较差。根据作者的说法,这些研究的结果表明,使用杀螨剂和广泛的卧室环境控制计划可能对减轻鼻炎症状有一定的好处,如果认为合适,这些应该是首选的干预措施。单独使用屋尘螨不可渗透的床上用品不太可能被证明是有效的14。
Cochrane气道组旨在确定宠物过敏原控制措施在宠物过敏性哮喘患者家中的临床疗效的审查得出结论,由于可用数据量有限,不可能进行荟萃分析15。由于将宠物从家中带走的双盲随机研究是不可行的,因此对接触后出现症状的宠物敏感宠物主人的建议是基于常识,而不是循证医学。根据临床经验和观察性研究16,人们普遍认为,在宠物过敏患者中,不与宠物接触会带来临床改善。
2、进一步系统评价——成人研究:两项大型双盲安慰剂对照试验评估了螨类过敏原不可渗透床垫、枕头和羽绒被套作为成人哮喘和鼻炎的单一干预措施的有效性17,18。哮喘研究招募了1000多名患者,他们每天服用常规吸入皮质类固醇(ICS)并使用短效支气管扩张剂17。该试验包括两个阶段,每个阶段持续六个月:第一阶段,患者接受稳定的吸入性皮质类固醇(ICS)治疗,第二阶段,采用控制性治疗渐降方案(ICS的减少持续到所有患者都停止或哮喘控制根据预定标准恶化)。这项研究发现,干预对任何结果(肺功能、治疗要求、症状评分、生活质量等)都没有好处(图5)17。此外,对130名患者的亚组的分析显示,干预组和对照组之间的任何结果都没有差异,这些患者由于具有高的螨特异性IgE和高的基线螨过敏原暴露而有望从干预中受益最大。
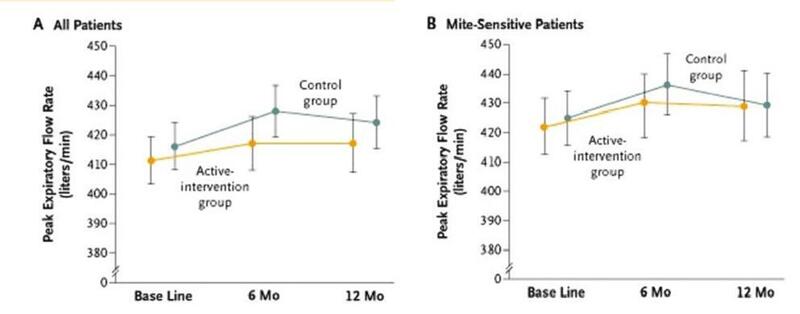
图5 在患有哮喘的成年人中,用不可渗透过敏原的覆盖物覆盖床垫、枕头和被子没有效果。基线、6个月和12个月的主动干预组和对照组所有患者(图A)和螨敏感患者(图B)的平均早高峰呼气流速。
摘自Woodcock et al. N Engl J Med, 2003: 349 (3): 225. With permission.。获得许可。
这项鼻炎研究调查了279名年龄在8-50岁的常年性鼻炎螨过敏患者的螨过敏原不可渗透外壳的有效性,这些患者对螨提取物18的鼻腔激发试验均呈阳性。尽管与对照组相比,活性组的床垫螨过敏原水平显著降低,但在12个月的随访期内18,两组之间的任何与患者相关的主要或次要结果指标都没有差异。
大多数针对成年人的其他研究表明,使用过敏原不可渗透覆盖物作为单一干预措施在哮喘和鼻炎患者的治疗中临床无效。虽然在精心选择的患者亚组中,使用过敏原不可渗透的覆盖物与其他防螨措施相结合仍有可能产生一些效果,但在一项针对成年人的充分设计的研究中,这一问题尚未得到解决。
3、进一步系统评价——儿童研究:与大多数成人研究相比,几项针对哮喘儿童使用的过敏原不透性床罩的精心设计的随机双盲安慰剂对照研究报告了减少ICS剂量或改善症状或气道反应性方面的益处(综述见4,5)。关于避免过敏原有效性的最大规模研究采用了一种更全面的环境控制方法,该研究对来自美国七个贫困程度较高的内城地区的937名儿童进行了研究19。干预措施是根据有关儿童敏感程度和接触状况的信息量身定制的;它侧重于父母/监护人的教育,并在适当的情况下提供减少被动吸烟的建议。床垫和枕头套以及高过滤真空吸尘器被提供给所有家庭,定制干预所需的额外产品(如空气过滤器)被免费提供19。与对照组相比,这种综合干预显著降低了活动组的螨和猫过敏原水平,并在两年内增加了34天无症状天数(图6)19。无症状天数的增加主要发生在过敏原水平下降幅度较大(>50%)的儿童身上。
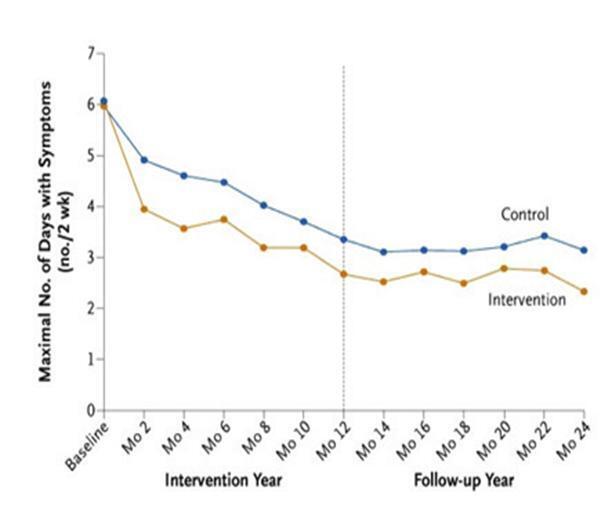
图6 环境控制对哮喘儿童是有效的。研究两年中随访评估前每两周出现症状的平均最大天数。环境干预组与对照组在干预年(P<0.001)和随访年(P>0.001)均有显著性差异。来自Morgan, W. et
与健康相关的益处在两个月内显著,并在整个两年期间持续存在。这项重要的研究表明,在贫穷的市中心家庭中,过敏原水平可以降低,并估计了潜在的有益影响的大小:每名儿童花费2000美元的环境干预与两年内额外的34天无症状相关,这在美国医疗保健系统20的背景下是具有成本效益的。
如何解释儿童避免家庭过敏原的研究与成人研究之间的差异,其中大多数研究表明有一些益处,而成人研究的数据显示症状控制没有改善?
前面提到的职业性哮喘的例子可能会提供一些线索。在这种模型中,早期诊断和离开接触过的工作场所通常与康复有关,而任何导致过敏个体长时间接触的延迟,通常超过18-24个月,都可能导致哮喘的持续性,有时甚至是渐进性恶化,即使接触最终已经停止。人们很容易推测,早期发现和立即停止接触可能是环境控制有利效果的重要预测因素。
(六)结论
完全避免过敏原通常会改善症状。然而,简单的物理或化学方法作为控制螨或宠物过敏原水平的单一干预措施,对患有哮喘的成年人无效。相比之下,过敏原不可渗透的床罩和全面的环境干预对哮喘儿童有好处。在所有年龄组和所有过敏原的最终试验证据可用之前,环境控制的务实方法应采用以下方法:
•单一回避措施无效。
•采用全面的环境干预措施,最大限度地减少个人接触。
•根据患者的致敏和暴露状态量身定制干预措施。
•如果无法评估暴露情况,则使用过敏原特异性IgE抗体水平或皮肤试验风团的大小作为指标。
•在疾病自然史上尽早开始干预。
•需要对所有年龄组和所有过敏原进行避免过敏原的最终试验。
•应前瞻性评估环境干预对哮喘和过敏发展的影响,以评估预防策略的成本效益。
(七)当前和未来需求
•应制定和评估旨在消除或减少接触潜在致敏剂的初级预防策略。
•改善对医生的教育,以便更早地识别过敏性疾病:我们越早开始环境干预,好处就越大。
(八)未满足的需求和研究
•需要对所有年龄组和所有过敏原进行避免过敏原的最终试验。
•应前瞻性评估环境干预对哮喘和过敏发展的影响,以评估预防策略的成本效益。
推荐阅读
1. Custovic A, Wijk RG. The effectiveness of measures to change the indoor environment in the treatment of allergic rhinitis and asthma: ARIA update (in collaboration with GA 2 LEN). Allergy 2005; 60:1112-5. 2. Gotzsche P, Johansen H. House dust mite control measures for asthma. Cochrane Database Syst Rev 2008: CD001187.
3. Woodcock A, Forster L, Matthews E, Martin J, Letley L, Vickers M, Britton J, Strachan D, Howarth P, Altmann D, Frost C, Custovic A. Control of exposure to mite allergen by the use of allergen-impermeable bed covers for adults with asthma. N Engl J Med 2003; 349: 221-232.
4. Terreehorst I, Hak E, Oosting AJ, Tempels-Pavlica Z, de Monchy JG, Bruijnzeel-Koomen CA, Aalberse RC, Gerth van Wijk R. Evaluation of impermeable covers for bedding in patients with allergic rhinitis. N Engl J Med. 2003; 349: 237-46.
5. Morgan WJ, Crain EF, Gruchalla RS, O’Connor GT, Kattan M, Evans R 3rd, Stout J, Malindzak G, Smartt E, Plaut M, Walter M, Vaughn B, Mitchell H; Inner-City Asthma Study Group. Results of a home-based environmental intervention among urban children with asthma. N Engl J Med. 2004; 351: 1068-80
参考资料
1. Murray CS, Poletti G, Kebadze T, Morris J, Woodcock A, Johnston SL, et al. Study of modifiable risk factors for asthma exacerbations: virus infection and allergen exposure increase the risk of asthma hospital admissions in children. Thorax 2006; 61:376-82.
2. Green RM, Custovic A, Sanderson G, Hunter J, Johnston SL, Woodcock A. Synergism between allergens and viruses and risk of hospital admission with asthma: case-control study. BMJ 2002; 324:763.
3. Lowe LA, Woodcock A, Murray CS, Morris J, Simpson A, Custovic A. Lung function at age 3 years: effect of pet ownership and exposure to indoor allergens. Arch Pediatr Adolesc Med 2004; 158:996-1001.
4. Custovic A, Murray CS, Gore RB, Woodcock A. Controlling indoor allergens. Ann Allergy Asthma Immunol 2002; 88:432-41; quiz 42-3, 529.
5. Custovic A, Simpson A, Chapman MD, Woodcock A. Allergen avoidance in the treatment of asthma and atopic disorders. Thorax 1998; 53:63-72.
6. Chan-Yeung M, Malo JL. Occupational asthma N Engl J Med 1995; 333:107-12.
7. Simpson A, Woodcock A, Custovic A. Housing characteristics and mite allergen levels: to humidity and beyond. Clin Exp Allergy 2001; 31:803-5.
8. Simpson A, Simpson B, Custovic A, Craven M, Woodcock A. Stringent environmental control in pregnancy and early life: the long-term effects on mite, cat and dog allergen. Clin Exp Allergy 2003; 33:1183-9.
9. Wood RA, Chapman MD, Adkinson NF, Jr., Eggleston PA. The effect of cat removal on allergen content in household-dust samples. J Allergy Clin Immunol 1989; 83:730-4.
10. Custovic A, Wijk RG. The effectiveness of measures to change the indoor environment in the treatment of allergic rhinitis and asthma: ARIA update (in collaboration with GA 2 LEN). Allergy 2005; 60:1112-5.
11. Gotzsche PC, Johansen HK, Schmidt LM, Burr ML. House dust mite control measures for asthma. Cochrane Database Syst Rev 2004:CD001187.
12. Gotzsche P, Johansen H. House dust mite control measures for asthma. Cochrane Database Syst Rev 2008:CD001187.
13. Singh M, Bara A, Gibson P. Humidity control for chronic asthma. Cochrane Database Syst Rev 2002:CD003563.
14. Sheikh A, Hurwitz B, Nurmatov U, van Schayck CP. House dust mite avoidance measures for perennial allergic rhinitis. Cochrane Database of Systematic Reviews 2010, Issue 7. Art. No.: CD001563. DOI: 10.1002/14651858.CD001563.pub3.
15. Kilburn S, Lasserson TJ, McKean M. Pet allergen control measures for allergic asthma in children and adults. Cochrane Database Syst Rev 2003:CD002989.
16. Shirai T, Matsui T, Suzuki K, Chida K. Effect of pet removal on pet allergic asthma. Chest 2005; 127:1565-71.
17. Woodcock A, Forster L, Matthews E, Martin J, Letley L, Vickers M, et al. Control of exposure to mite allergen and allergen-impermeable bed covers for adults with asthma. N Engl J Med 2003; 349:225-36.
18. Terreehorst I, Hak E, Oosting AJ, Tempels-Pavlica Z, de Monchy JG, Bruijnzeel-Koomen CA, et al. Evaluation of impermeable covers for bedding in patients with allergic rhinitis. N Engl J Med 2003; 349:237-46.
19. Morgan WJ, Crain EF, Gruchalla RS, O’Connor GT, Kattan M, Evans R, 3rd, et al. Results of a home-based environmental intervention among urban children with asthma. N Engl J Med 2004; 351:1068-80.
20. Kattan M, Stearns SC, Crain EF, Stout JW, Gergen PJ, Evans R, 3rd, et al. Cost-effectiveness of a home-based environmental intervention for inner-city children with asthma. J Allergy Clin Immunol 2005; 116:1058-63.
三、过敏性疾病的预防
(一)关键声明
•过敏性疾病患病率在工业化世界持续上升了50多年。
•目前,在校儿童对一种或多种常见过敏原的致敏率接近40-50%。。
•迄今为止,用于解决这些问题的策略是无效的
•初级预防很困难,因为致敏率增加的原因尚不清楚。此外,越来越多的人导致过敏性疾病,其致敏进展的机制尚不完全清楚。哮喘和过敏可能起源于生命早期,甚至在子宫内。
•IgE介导疾病的可靠早期标志物不可用。
•新的研究表明,耐受是预防的关键。应当鼓励对发展耐受的机制进行更多的研究。过敏个体耐受性不足或缺乏似乎与免疫调节网络缺陷有关。
•国家哮喘和过敏计划(如芬兰哮喘计划1994-2004)得出结论,可以减轻这些社区健康问题的负担。随着政府、社区、医生和其他医疗保健专业人员以及患者组织致力于实施一项教育计划,以实施预防和治疗过敏性疾病的最佳实践,实现了更好的转变。
(二)介绍
过敏和哮喘盛行是全世界的一个主要公共卫生问题,在西方国家正在发生,而在其他一些不太富裕的地区,它可能才刚刚开始。越来越多的证据表明,避免过敏原并不是扭转过敏性疾病患病率上升趋势的正确策略。
即便可能,也很难避免吸入性过敏原,哮喘的避免干预结果也不令人鼓舞。为了防止过敏,过度避免食用婴儿早期可能过敏的食物可能是有害的,甚至会损害或削弱调节免疫机制的发展。因此,与其避免过敏原,不如阐明耐受性发展和维持的机制。有症状的患者需要治疗,在其中一些情况下,避免过敏原是必要的,但减少过敏负担的策略应侧重于预防和预防性治疗。本章概述了预防的备选方案。重点是初级预防,即如何加强对过敏原的耐受性,防止致敏和过敏性疾病的发展。
(三)通过避免过敏原进行初级预防
已经进行了7项前瞻性研究,共涉及6700多名儿童,以评估避免过敏原和饮食干预对高危儿童特应性和过敏状况的初级预防效果1。大多数研究使用了多方面的干预措施,包括物理和化学措施,以降低螨类过敏原水平,并避免食用常见的食物和宠物过敏原。结果相互矛盾,令人困惑。一些研究显示了临床益处,即降低哮喘/喘息的发生率,而另一些研究则对哮喘、鼻炎或特应性湿疹没有影响。出乎意料的是,一些研究报告干预组1中特应性和特应性湿疹的发病率增加。由于研究设计、采用的干预措施、研究受试者的人口统计学和结果测量的差异,结果很难解释。不能排除这种干预措施长期有害的可能性。
(四)WAO预防过敏的倡议
2004年,世界过敏组织(WAO)与世界卫生组织(WHO)合作开展了预防过敏和过敏性哮喘倡议。提出的指导方针为当局、卫生保健专业人员、患者组织和患者在国家一级减少过敏性疾病和哮喘负担的实际行动提供了坚实的基础2。该文件的目标是作为制定地方准则的模式,并以科学证据和世界卫生组织证据强度分类为基础。
WAO/ WHO提议的初级预防(定义为预防致敏)和证据强度见表3。最有力的证据表明,母乳喂养的母亲不需要特殊的饮食。令人信服的证据还表明,怀孕期间吸烟和在生命早期接触环境烟草烟雾对过敏是有害的,而母乳喂养4至6个月可能会预防或抑制生命后期特应性疾病的发展,尽管并非所有研究都一致证明了这一点2。关于高危家庭中避免宠物的数据显示,即使是有遗传易感性的儿童,只要有足够的暴露量,也可能对吸入性过敏原产生耐受性3。

WAO倡议中对过敏性疾病致敏进展的二级预防措施和证据的强度如表4所示。到目前为止,证据是模棱两可的,而且在大多数情况下,没有直接的循证数据。建议减少致敏儿童接触室内过敏原,以降低过敏性疾病的发病概率。对室内过敏原的单一致敏被认为是从非特应性到多发性致敏和显性过敏性疾病的中间阶段4,但这不太可能是普遍的。如重复调查5、6和世代分析5所示,特应性疾病和特应性的发生率普遍较低,例如在俄罗斯Karelia,尽管俄罗斯儿童对室内尘螨过敏原的单致敏率相对较高。

预防过敏性疾病的有效手段要么缺乏,要么过于模糊,无法发挥作用。这种预防措施应该有效、易于实施、不会造成伤害,而这是很难实现的。不再建议采取积极的预防措施。给育龄母亲、婴儿和儿童服用益生元和益生菌是一个有益的想法,益生菌研究的第一个结果非常有希望。然而,这个问题已经引起了争议,因为负面的结果也被公布了8,9。微生物、腐生成分以及最重要的空气传播过敏原(如草和桦树花粉;猫和狗的皮屑)对高危婴儿先天免疫的调节可能会带来希望。
为了实用和临床目的,我们建议对初级和次级过敏预防进行简单明了的定义:
1.初级预防可预防过敏性疾病的临床表现,以及
2.二级预防可防止过敏性疾病的进展和恶化。
二级预防和三级预防(疾病治疗)分为两类。
(五)当前和未来方向
1、2008-2018年芬兰过敏计划——一个实例
与许多其他工业化和城市化国家一样,芬兰过敏性疾病的发生率正在增加。这种流行率的上升已经持续了40多年,没有任何变化。芬兰学童对一种或多种常见过敏原的致敏率接近50%5。哮喘的情况严重到足以推动1994年至2004年实施的国家10年哮喘计划。具体、务实的行动计划有着简单的目标,改善了一些成果措施,并表明通过这种公共卫生行动计划11可以实现向更好的方向转变。该国家哮喘计划旨在通过改善患者教育和积极引导自我管理来预防哮喘恶化。因此,主要目的是二级预防,例如阻止疾病进展。当计划哮喘项目时,不知道如何实施哮喘的初级预防,从而降低这种疾病的流行率。
在哮喘项目取得成功后,一个减少过敏负担和费用的国家过敏项目被认为是非常可取的。为了实施一项国家计划,有必要采用普遍的诊断和治疗方法。很明显,过敏性疾病患病率的上升不能通过避免过敏原来逆转,必须提高对过敏原的耐受性。应该制定科学验证的治疗方法,特别是对于那些有记录的严重过敏性疾病的人。芬兰过敏方案于2008年4月启动,从二级预防向初级预防迈出了一步,即从治疗转向预防。该项目以最新的科学数据为基础。它的关键要素是宽容。
2、目标和重点:芬兰过敏计划的目标是:
i.减轻个人和社会的过敏性疾病负担;
ii。减少过敏性疾病造成的费用;以及
iii.改善严重过敏患者的治疗和控制。
它的重点是支持健康和耐受。它包括五个雄心勃勃的目标;实现这些目标的工具;以及评估结果和过程的评估计划12。
3、芬兰过敏计划的主要信息是:
1.支持健康,而不是过敏
2.加强耐受
3.对过敏采取新的态度。只有在必要时才避免过敏原
4.及早发现并治疗严重过敏。防止病情恶化
5.改善空气质量。停止吸烟
过敏不存在“恶化规律”,即轻度过敏通常不会发展为严重过敏;事实上,许多孩子的过敏症已经“长大”了。因此,有必要采取从回避到耐受的新态度。必须比过去更有效地治疗严重疾病患者,因此,芬兰过敏计划强调早期识别和治疗严重过敏患者的重要性。变态反应中一个重要但经常被忽视的问题是心理耐受。想象(伪)过敏是常见的,芬兰过敏计划希望通过教育加强心理宽容来减少这一问题。轻度过敏可以被认为是一种个人特征或特征,而不是一种需要特别关注的疾病。
对于二级预防,芬兰过敏计划提供了简单易用的过敏和哮喘检查计划,包括医生/护士和患者的检查点。例如,成人哮喘检查计划如图8所示。
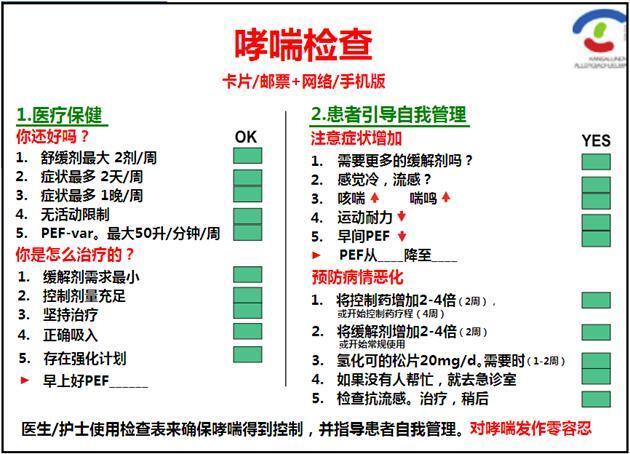
图8 为医生和其他医疗保健专业人员制定哮喘检查计划,以确保患者的病情得到合理控制(图左),并为患者支持自我指导管理(图右)。
(六)研究需求
1、耐受性:耐受问题在各种准则和协商一致报告中几乎没有得到重视,但在解开发展耐受的机制方面取得了巨大进展。新的研究表明,支持耐受性作为预防甚至治疗过敏性疾病的策略的重要性。儿童在生命早期就表现出免疫功能的显著差异,这些儿童最终会在晚年患上过敏性疾病。
2、特异个体与健康个体:暴露于过敏原/生物制品不会导致过敏个体耐受性的发展,反而会导致长期的炎症反应。在小鼠和男性的外周耐受和过敏之间的平衡中,关键因素是调节性T细胞、IL-10和TGF-β细胞因子。耐受性不足或破坏的问题在很大程度上与不同T细胞类型(即Th1、Th2和调节性T细胞)之间的失衡有关。特应性个体中调节性T细胞的比例显著降低或其功能受损13。
3、如何提高人口的耐受性?:世代分析显示,出生队列中哮喘和特应性的发生率逐渐增加,强调了环境暴露变化的作用14,15。越来越多的证据表明,儿童时期富含微生物的环境可以降低日后患特应性疾病的风险16。随着城市化,环境微生物群的数量和多样性急剧下降。共生菌和腐生菌对先天免疫系统的持续刺激对于粘膜稳态和耐受性的正确发展和维持是必要的17,18。
即使是人类智慧型的生活方式也与特应性疾病的风险降低有关,尽管程度低于与农场环境相关的风险降低。人(灵)智学(anthroposophy)的特点是限制使用抗生素、退烧药和疫苗,并经常食用发酵蔬菜。发酵食品,如酸菜和发酵乳,传统上在许多东欧国家被广泛使用,如俄罗斯,那里患过敏性疾病的风险很低。这些国家的此类食品和环境值得进一步研究,以确定可能的免疫调节和增强耐受性的物质。
作者当然不赞同非免疫的概念。疫苗接种计划至关重要,避免或拒绝接种疫苗将给人类带来巨大痛苦,这将比过敏流行病本身更成问题。同样,正确使用抗生素有可能挽救生命。
4、基于微生物的产品:有大量关于益生菌预防和治疗过敏的文献,但结果不一致且没有结论。与许多研究一致的一个问题是干预期短(婴儿通常为6个月)。益生菌的消费可能应该是持续的,以获得更持久的效果。除了益生菌外,环境腐生植物和其他微生物的产品也有助于提高耐受性。2003年,欧洲过敏学和临床免疫学研究所工作组发表了一篇关于微生物产品在过敏预防和治疗中的潜在用途的数据评论19。本报告中提到的微生物产品均未被明确证明可以预防或改变过敏性疾病的进程。
由于过敏预防/增强耐受性的产品仍然是未来的,因此有几种提高耐受性的方法值得考虑。简单的建议包括食用富含微生物(发酵)的产品,在户外环境中呆一段时间,只有在必要时才避免过敏原。表5列出了一些增加耐受性的方法。在几篇综述文章中[例如参考文献18]全面讨论了在过敏个体中使用特异性免疫疗法以潜在地实现相同目标,这超出了本章的范围。

(七)未满足的需求
未来研究需要解决的问题:
•IgE介导疾病的早期标志物的鉴定。迫切需要在高危儿童中鉴定更强大的免疫标志物。
•识别免疫因素,这些因素可以解释发生多发性致敏的个体和只发生单发性致敏感的个体之间的差异。
•确定可以解释个体和不同人群对显性过敏性疾病致敏进展差异的免疫因素;致敏不一定转化为临床疾病。这些疾病的表达/抑制机制尚不清楚。
(八)结论
•城市环境和室内生活方式似乎缺乏适当培养对无害过敏原/生物制品耐受性所需的元素。
•耐受性发展的关键问题可能是在数量和多样性方面充分暴露于环境和共生微生物。
•动物模型提供了令人鼓舞的证据,证明受损的耐受性可以恢复。含有不同微生物成分的新型预防产品可能有望用于初级预防。
•芬兰实施了一项为期10年的过敏方案,通过对卫生专业人员和民众进行教育来减轻过敏负担。重点是预防,特别是对儿童的预防,主要问题将是在生命早期加强容忍。
•对于二级预防,早期发现疾病并使用足够的抗炎和抗过敏药物进行干预,应减少病情恶化、医疗使用和成本。在医疗专业人员的指导下,积极的自我管理是过敏和哮喘患者过上更健康生活的关键。
参考文献
1. Simpson A, Custovic A (2009). Prevention of allergic sensitization by environmental control. Current Allergy and Asthma Reports 9:363-69.
2. Johansson SGO, Haahtela T (2004). World Allergy Organization Guidelines for prevention of allergy and allergic asthma. Int Arch Allergy Immunol 135:83- 92
3. Cullinan P, MacNeill SJ, Harris JM, Moffat S, White C, Mills P, Newman Taylor AJ (2004). Early allergen exposure, skin prick responses, and atopic wheeze at age 5 in English children: a cohort study. Thorax 59:855-61
4. Bousquet J, Anto JM, Bachert C, Bousquet PJ, Colombo P, Crameri R, Daëron M, Fokkens W, Leynaert B, Lahoz C, Maurer M, Passalacqua G, Valenta R, van Hage M, van Ree R. (2006). Factors responsible for differences between asymptomatic subjects and patients presenting an IgE sensitization to allergens. A GA2LEN project. Allergy 61:671-80.
5. von Hertzen LC, Mäkela MJ, Petäys T, Jousilahti P, Kosunen TU, Laatikainen T, Vartiainen E,Haahtela T (2006). Growing disparities in atopy between the Finns and the Russians – a comparison of two generations. J Allergy Clin Immunol 117:151-57.
6. Vartiainen E, Vartiainen E, Petäys T, Haahtela T, Jousilahti P, Pekkanen J (2002) Allergic diseases, skin prick test responses and IgE levels in North Karelia, Finland, and the Republic of Karelia, Russia. J Allergy Clin Immunol 109:643-48.
7. Kalliomäki M, Salminen S, Arvilommi H, Kero P, Koskinen P, Isolauri E (2001) Probiotics in primary prevention of atopic disease: a randomized placebo-controlled trial. Lancet 357:1057-59.
8. Taylor AL, Dunstan JA, Prescott SL. (2008). Probiotic supplementation for the first 6 months of life fails to reduce the risk of atopic dermatitis and increases the risk of allergen sensitization in high-risk children: A randomised controlled trial. J Allergy Clin Immunol 119:184-91.
9. Helin T, Haahtela S, Haahtela T (2002) No effect of oral treatment with an intestinal bacterial strain, Lactobacillus rhamnosus (ATCC53103), on birch-pollen allergy: a placebo-controlled double-blind study. Allergy 57:243-46.
10. Latvala J, von Hertzen L, Lindholm H, Haahtela T (2005) Trends in prevalence of asthma and allergy in Finnish young men: a nationwide study from 1966 to 2003. BMJ 330:1186-87.
11. Haahtela T, Tuomisto LE, Pietinalho A, Klaukka T, Erhola M, Kaila M, Nieminen MM, Kontula E, Laitinen LA (2006) A 10-year asthma programme in Finland: major change for the better. Thorax 61:663-70.
12. Haahtela T, von Hertzen L, Mäkelä M, Hannuksela M, The Allergy Programme Working Group (2008). Finnish Allergy Programme 2008-2018 – time to act and change the course. Allergy 63:634-45.
13. Akdis M, Verhagen J, Taylor A, Karamloo F, Karagiannidis C, Crameri R, Thunberg S, Deniz G, Schmidt-Weber C, Blaser K, Akdis CA (2004) Immune responses in healthy and allergic individuals are characterized by a fine balance between allergen-specific T regulatory 1 and T helper 2 cells. J Exp Med 199;1567-75.
14. Sunyer J, Anto JM, Tobias A, Burney P, for the European Community Respiratory Health Study (ECRHS) (1999) Generational increase of self-reported first attack of asthma in fifteen industrialized countries. Eur Respir J. 14:885-91.
15. Isolauri E, Huurre A, Salminen S, Impivaara O (2004) The allergy epidemic extends beyond the past few decades. Clin Exp Allergy 34:1007-10.
16. von Hertzen L, Haahtela T. (2006) Disconnection of man and the soil – reason for the asthma and atopy epidemic? J Allergy Clin Immunol 117:334-44.
17. Rakoff-Nahoum S, Paglino J, Eslami-Varzaneh F, Edberg S, Medzhitov R (2004) Recognition of commensal microflora by Toll-like receptors is required for intestinal homeostasis. Cell 118:229-41.
18. von Hertzen L, Savolainen J, Hannuksela M, Klaukka T, Lauerma A, Mäkelä MJ, Pekkanen J, Pietinalho A, Vaarala O, Valovirta E, Vartiainen E, Haahtela T (2009) Scientific rationale for the Finnish Allergy Programme 2008-2018: emphasis on prevention and endorsing tolerance. Allergy 64:678-701.
19. Matricardi PM, Björksten B, Bonini S, Bousquet J, Djukanoic R, Dreborg S, Gereda J, Malling HJ, Popov T, Raz E, Renz H, A. Wold for EAACI Task Force 7(2003) Microbial products in allergy prevention and therapy. Allergy 58:461-71.
本文是陈伟成版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论