 三甲
三甲
横纹肌样瘤,靶向治疗能否提高生存?
大多数横纹肌样瘤大多数具有SMARCB1突变。SMARCB1基因是抑癌基因,是编码SWI/SNF染色质重塑复合物的核心亚单位的关键基因。
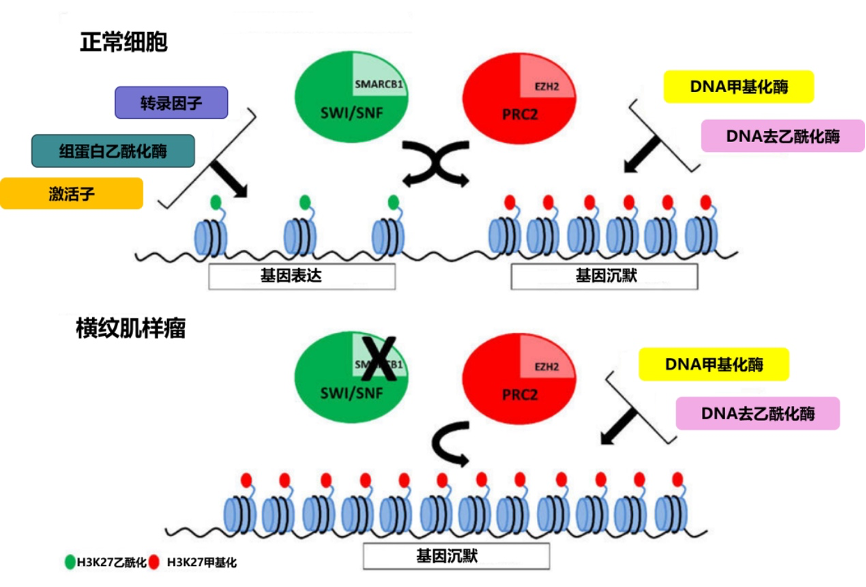
图1: SWI/SNF和PRC2复合物对基因表达的调节
在正常细胞中,SWI/SNF复合物(包括SMARCB1)与转录因子、组蛋白乙酰转移酶和转录调节因子相互作用,激活靶基因的表达。组蛋白H3K27的乙酰化标志着基因被转录激活并表达。与SWI/SNF复合物相反的是PRC2复合物,它包含EZH2。PRC2在DNA甲基转移酶和组蛋白脱乙酰酶相互作用下抑制基因表达。组蛋白H3K27的甲基化标志着基因沉默。在横纹肌样肿瘤中,SMARCB1表达的缺失阻碍了SWI/SNF复合物的正常功能,导致基因表达的改变。
简单来讲,这就是一个正负调节保持平衡的问题,打个比方,SWI/SNF可以比作一个安装工具箱,工具箱里面都是用来使基因表达的元件,而SMARCB1则是其中关键元件之一。PRC2则是一个拆卸的工具箱,里面都是用来使基因沉默的元件。在SMARCB1突变失活下,PRC2的功能则“占上风”,此时抑制一系列基因表达,进而导致肿瘤发生。已有研究表明,EZH2的抑制可阻断由SMARCB1缺失驱动的肿瘤形成。
2023年Dana-Farber/波士顿儿童医院癌症与血液疾病中心与德克萨斯儿童医院癌症与血液学中心联合在国际权威杂志《JNCI: Journal of the National Cancer Institute》发表了针对携带SMARCB1/SMARCA4或EZH2改变的肿瘤的EZH2抑制剂Tazemetostat治疗这项来自NCI-COG儿科MATCH APEC1621C的研究结果。
研究纳入了1-21岁患有难治性实体瘤、脑瘤、淋巴瘤和组织细胞增多症的患者,他们参与了基于预先确定的基因改变检测的分子靶向治疗的II期临床试验。对于通过免疫组织化学检测发现EZH2突变或SMARCB1或SMARCA4缺失的肿瘤患者,并采用EZH2抑制剂tazemetostat进行治疗。
患者以28天为一个周期接受tazemetostat治疗,直至疾病进展或出现无法耐受的毒性反应(最多26个周期)。主要终点是客观缓解率;次要终点包括无进展生存期和tazemetostat的耐受性。
结果表明,共有20名患者(中位年龄5岁)入组,均可评估疗效和毒性反应。最常见的诊断是非典型畸胎样横纹肌样瘤(n=8)和恶性横纹肌样瘤(n=4)。可治疗的改变包括SMARCB1缺失(n=16)、EZH2突变(n=3)和SMARCA4缺失(n=1)。在一名患有非朗格汉斯细胞组织细胞增多症并伴有SMARCA4缺失的患者中观察到了一次客观缓解(26个周期,每次剂量1200 mg/m²,每日两次)。四名SMARCB1缺失的患者获得了最佳的稳定疾病反应:包括上皮样肉瘤(n=2)、非典型畸胎样横纹肌样瘤(n=1)和肾髓质癌(n=1)。6个月无进展生存率为35%(95%置信区间[CI]=15.7%至55.2%),6个月总生存率为45%(95% CI=23.1%至64.7%)。与治疗相关的不良事件与先前的tazemetostat报告一致。
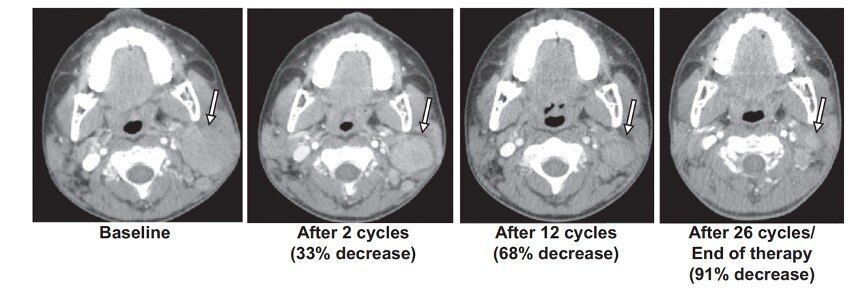
图2. 一名非朗格汉斯细胞组织细胞增多症患者在接受26个周期tazemetostat治疗后的反应。黑色箭头表示病变部位。
这些结果说明,尽管在这组难治性儿童肿瘤患者中,tazemetostat未达到其主要疗效终点(客观缓解率=5%,90% CI=1%至20%),但25%的多组织学诊断患者经历了6个月及以上的长期稳定疾病(范围=9-26个周期),提示tazemetostat对疾病稳定具有潜在作用。本文是阙旖版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论