 三甲
三甲
介入文献第23期——肝硬化背景下门静脉血栓形成
文章摘要:本文就肝硬化患者门静脉血栓形成的病理生理、临床特点、诊断和治疗作一综述。
今日阅读综合介入的一篇文献,来自Journal of Clinical Medicine。
标题是《Portal V ein Thrombosis in the Setting of Cirrhosis: A Comprehensive Review》
《肝硬化背景下门静脉血栓形成:综述》

共同通讯作者,Javier Crespo,来自西班牙瓦尔德基拉侯爵大学医院。

José Ignacio Fortea
Abstract:
门静脉血栓形成是肝硬化患者最常见的血栓形成事件,在晚期肝病的背景下,门静脉血栓形成的发生率增加。尽管门静脉血栓形成是常见的肝硬化并发症,但门静脉血栓形成对肝脏失代偿和总死亡率的影响仍然存在争议。
直接口服抗凝剂和用于门静脉再通的介入技术的出现扩大了我们的治疗手段。
然而,缺乏大型前瞻性观察研究和随机试验导致了当前指南的异质性诊断和治疗建议。
本文就肝硬化患者门静脉血栓形成的病理生理、临床特点、诊断和治疗作一综述。
Text:
1.Introduction
门静脉阻塞可因恶性肿瘤(通常但不恰当地称为恶性血栓形成)而发生,其中阻塞继发于门静脉狭窄,和/或肿瘤直接侵犯门静脉,或由于非恶性门静脉血栓形成(PVT)。后者被定义为发展于门静脉主干和肝内门静脉分支的血栓,也可能涉及脾静脉(SV)或肠系膜上静脉(SMV)。
在没有再通的情况下,门静脉腔被消除,门静脉-门静脉侧支形成,导致门静脉海绵瘤。
非恶性PVT可在两种情况下发生,取决于有无肝硬化。
这种区分是至关重要的,因为病因、表现、自然史和治疗方案不同。
以前的早期文献将这两种情况下的患者合并在一起,应该考虑到这一点以便更好地解释结果。
本文就肝硬化PVT的病理生理、临床特点、诊断和治疗作一综述。
尽管PVT是众所周知的肝硬化并发症,但其对肝功能失代偿和总死亡率的贡献仍然存在争议。因此,对其最佳管理没有共识,临床指南或共识会议中也没有明确的建议。
2.Anatomy of the Venous Portal System
肝脏是一个血管丰富的器官,从双重血液供应中接收高达总心输出量的 25%。肝动脉输送氧合良好的血液,约占肝脏总血流量的 25%,而其余 75% 是由门静脉供应的脱氧血。这两个传入血管系统流入肝脏的改良毛细血管网络,由有孔的窦组成。血液从窦状窦流入中央静脉,再流入肝静脉,然后流入下腔静脉。
肝门静脉系统是体内最著名的门静脉系统,因此得名。后者被定义为一种循环系统,其中静脉连接两个毛细血管床而不首先将血液输送到心脏。
在肝门静脉系统中,来自整个胃肠道(食道上部和直肠远端除外)、胰腺、胆囊和脾的毛细血管血液被输送到肝窦。
门静脉是一条8厘米长的无瓣管道,起始于胰颈后方SMV和SV的汇合处。肠系膜下静脉(IMV)是一种分支血管,通常在SV内引流(高达40%的病例)。然而,在这个静脉的引流中有许多变种。
IMV进入SV与SMV汇合角(30%)或SMV(20%)。其他较不常见的变异(10%)包括进入SV或SMV的肠系膜副静脉。
门静脉在妊娠第二个月和第三个月由两个卵黄静脉发育而成,它们排出卵黄囊。这些静脉彼此之间形成很少的吻合,从而导致门静脉的形成。偏离这些吻合口的正常过程会导致门静脉分支模式的变化。它在肝脏内的分布是节段性的,与肝动脉密切相关。
程勇等人将这些肝内门静脉变异分为五种不同的类型:
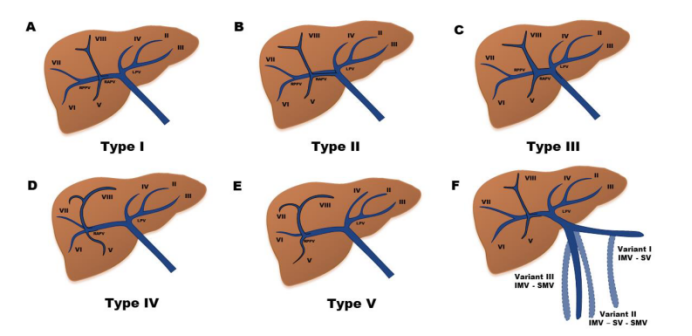
肝内门静脉呈节段性分布,与肝动脉密切相关。
(A) I型(65-80%):门静脉主干(MPV)进入门静脉后分为较大的门静脉右支(RPV)和较小的门静脉左支(LPV)。RPV分为前支(供应V、VIII段)和后支(供应VI、VII段)。LVP水平向左走,然后向内侧走(供应I、II、III、IV段)。
(B) II型(10~15%):MVP三分叉,分为右前支、后支和LPV。
(C) III型(0.3%~7%):门静脉右后支起于门静脉右前支后,为第一支,左门静脉为终末支。
(D) IV型(0.6 ~ 2.7%):RPV分叉,其中VII段分支为RPV的第1支。
(E) V型(1.3-2.4%):右室静脉三分叉,其中VI段的分支作为右室静脉的一个独立分支出现较早。
(F) 肠系膜下静脉(IMV)引流的不同变种。I:脾静脉引流(SV)。II:肠系膜上静脉(SMV)与SV汇合处的引流。III:向SMV引流
3.Classification
在文献中,PVT的术语和分类系统差异很大,大多数仅在肝移植(LT)人群中出现。
表1列出了已出版的四种主要PVT分类系统:
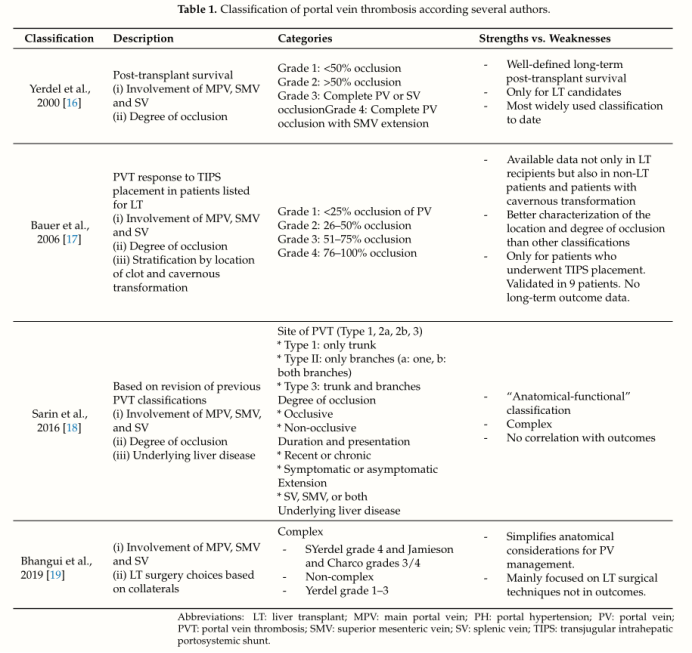
最近,美国肝脏研究学会(American Association for the Study of the Liver, AASLD)关于血管疾病的最新指南和Baveno VII研讨会推动建立描述PVT的标准化术语,以便对未来的研究进行比较和外部验证。他们建议对初始部位、管腔梗阻范围/程度和PVT慢性化进行系统性记录,以便后续评估自发病程和/或对治疗的反应。
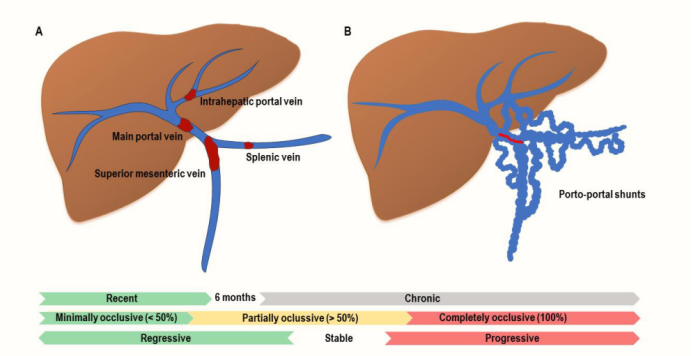
门静脉血栓形成的分类。
(A) 确定门静脉血栓的范围及其与门静脉主干(MPV)的关系至关重要。肠系膜上静脉(SMV)和脾静脉(SV)受累的特点对预后和治疗有重要意义。
(B) 门静脉海绵样变。慢性PVT继发的MPV萎缩(以红色标出)导致门静脉血管肥大,并伴有门静脉-门静脉分流。
与上述一致,PVT的初始描述必须详细说明血栓的位置和范围,明确是否累及肝内分支、门静脉主干、SV和/或SMV。
这些位置的管腔闭塞的百分比被分为完全闭塞(没有持续的管腔)、部分闭塞(血栓阻塞50%的原始血管管腔)和轻微闭塞(血栓阻塞50%的原始血管管腔)。
如果有,则必须报告海绵样变(即未见原始门静脉的大体门静脉-门静脉侧支)。这不仅对于治疗决策和评估治疗反应非常重要,而且对于确定血栓形成部位与PVT临床表现之间的相关性也非常重要。事实上,SMV受累可能导致肠缺血和异位静脉曲张的发生,而SV血栓形成可能导致胃底静脉曲张的出现。
就血栓形成的时间进程而言,如果假定PVT存在少于6个月,则将PVT归类为新近PVT,如果PVT持续时间超过该时间框架,则归类为慢性PVT。术语近期比急性更受欢迎,因为后者意味着临床症状,而PVT通常是无症状和偶然诊断的。这就是为什么在相当大比例的患者中不可能进行精确的年代测定。6个月阈值的选择是基于对102例近期非肝硬化性PVT患者的前瞻性研究的数据。
在这项研究中,尽管持续抗凝,但PVT诊断后6个月内未能再通导致大多数患者发生海绵状转化。在肝硬化组中也观察到类似的结果。当慢性梗阻持续并发生海绵样变时,首选后者。然而,海绵样变不是慢性PVT的同义词,因为这种发现可以在PVT发病后1-3周内表现出来。
最后,根据自发病程和/或对治疗的反应,PVT可分为进行性(血栓增大或完全闭塞)、稳定型(大小和闭塞无变化)或消退型(血栓减小或闭塞程度减小)。
4. Pathophysiology and Risk Factors
与任何其他血栓一样,PVT的发病机制通常是多因素的,目前认为主要由Virchow三联征中的三个生理因素(血流缓慢、高凝状态和内皮损伤)的相互作用决定。然而,这些因素对PVT发展的确切作用尚未完全阐明。
4.1. Reduced Blood Flow
门静脉血流速度下降继发于门静脉侧支循环的“窃血效应”,加上临床上常见的门静脉高压症(CSPH)患者门静脉内径的增加,似乎是肝硬变患者发生门静脉高压症的最重要因素。
具体地说,提出了门脉流速15厘米/秒的阈值来识别发生PVT的高风险患者。这是由Zocco等人在一项对100名肝硬变患者进行为期一年的前瞻性研究中首次报道的。
从那时起,其他回顾和前瞻性研究证实了这一发现。
然而,一项针对肝细胞癌的超声筛查前瞻性试验的大型卫星研究并未证实这一点,并对门静脉血流速度测量的重复性提出了担忧,从而使特定阈值的推广变得不确定。在这方面的进一步间接数据来自确定门静脉内径较大和存在较大的门静脉侧支血管作为发生门静脉血栓的危险因素的研究。
经颈静脉肝内门体分流术(TIPS)通过增加门静脉血流恢复PVT通畅的有效性也支持门静脉血流动力学改变在PVT发展中的这一主要作用。
由于非选择性β阻滞剂(NSBB)可能通过减少心输出量和引起内脏动脉收缩来减少门静脉血流量,因此有人认为它们可能增加门静脉血栓形成的风险。
这一点非常重要,因为NSBB的适应症最近有所扩大,现在不仅被推荐用于静脉曲张出血的一级或二级预防,而且还被推荐用于预防代偿性晚期慢性肝病和CSPH患者的失代偿。
最近的一项系统回顾和荟萃分析显示,接受NSSB治疗的患者发生门静脉血栓形成的风险增加(OR4.62,95%可信区间2.50-8.53;p<0.00001)。
然而,在样本大小、PVT定义和肝病分期方面存在高度的异质性,并且大多数研究没有评估混杂因素的潜在作用。
事实上,在两项大型前瞻性研究中,在调整了与门静脉高压症严重程度相关的变量后,NSBB与门静脉高压症风险增加无关。因此,NSBB的使用不应基于这一担忧而受到限制,考虑到其在肝硬变患者中的更大益处,更应如此。
4.2. Alterations in Coagulation
长期以来,肝硬化被认为是血小板减少和常规凝血试验异常导致的获得性出血性疾病。然而,与遗传性凝血病不同,肝硬化影响凝血级联的整个谱(即促凝和抗凝因子),并且与血小板活性亢进和血管性血友病因子水平升高相关,所有这些都导致“止血再平衡”。
这种新的平衡是脆弱的,很容易倾向于出血前表型或血栓前表型。此外,有人认为这种潜在的血栓前状态与肝病的进展密切相关,也可能与PVT的发生有关。
几项研究已经评估了与肝硬变相关的止血改变是否会增加PVT的风险,并在其他地方进行了广泛的综述。传统的凝血试验(例如凝血酶原时间或部分凝血活酶时间)不能充分反映这种新的止血平衡,因为它们没有考虑抗凝剂因素对凝血酶的抑制。
长期以来,FVIII和蛋白C之间的比值被认为反映了凝血潜能的增加,尽管最近有数据挑战了这一假设,表明尽管可以预测肝硬变并发症的发展,但它与肝硬变患者的凝血状态无关。
关于它在PVT中的作用,发表了相互矛盾的结果。在其他与肝硬变相关的止血变化中也观察到了类似的发现,如因子II与蛋白C的比率、凝血因子水平、血栓调节蛋白抵抗、纤溶标志物、纤溶酶原激活物抑制物1水平或粘弹性参数。
值得注意的是,前述研究评估了全身血液中的凝血因子,很少有研究评估门静脉是否代表高凝的血管床。虽然最初的研究描述了这一区域存在相对高凝状态,但最近的一项研究未能在接受TIPS置入术的肝硬变患者中重复这一发现。它在PVT发生中的假设作用没有得到检验,因为这些研究中没有一项评估了PVT患者。
关于血小板聚集在PVT发生中的作用的数据较少。与先前的研究相反,最近的研究表明,在这些患者中,尤其是在失代偿期和门静脉中,血小板功能亢进。
此外,这种增加的血小板聚集能力与进一步失代偿、死亡和PVT的风险更高相关。
与这些发现一致,最近的一项研究表明,ADAMTS-13/von Willebrand因子比值可预测PVT。这些结果为评价抗血小板药物预防PVT和阻止疾病进展的使用奠定了合理的基础。
其他可能导致肝硬变患者血液高凝的因素是全身性炎症,这是失代偿性肝硬变以及肝细胞癌的公认特征。对前者的研究很少,结果相互矛盾。
最近的一篇论文发现,血清白蛋白与PVT呈负相关,并提示白蛋白通过抑制氧化应激而减少血小板的激活,从而调节止血系统。根据作者的说法,这些发现建立了随机干预研究的理论基础,以调查白蛋白预防肝硬变PVT的有益效果。在长期的白蛋白给药试验中没有提供这方面的信息。
就肝细胞癌而言,越来越多的证据表明,它与血栓前改变(即血小板活化和功能增强、凝血酶生成增强、纤溶功能低下和血栓前微泡水平升高)有关,这些改变可能协同促进高凝状态和血栓形成。
关于遗传性和其他获得性血栓前疾病在PVT发生中的作用,目前的数据是相互矛盾的。现有的有限数量的研究大多是小样本量的病例对照研究。他们的研究设计、目标人群(不同种族和地理位置)、PVT的诊断标准以及对血栓形成情况的评估差异很大,导致结果不一致。
此外,这些研究中没有一项正确评估血栓形成是否会影响疾病的进展速度或治疗反应。
在不同的亲血栓基因缺陷中,因子V Leiden和凝血酶原G20210A突变是研究最多的。三项荟萃分析得出结论,它们增加了肝硬变患者门静脉血栓形成的风险,尽管其中一项研究没有显示出与凝血酶原突变的相关性,而且所有这些研究都受到纳入研究质量的影响。
遗传性蛋白C、蛋白S或抗凝血酶III缺陷因同时存在肝脏合成功能障碍而难以检测。然而,它们的水平似乎与PVT的发展无关。
亚甲基四氢叶酸还原酶C677T和纤溶酶原激活物抑制剂1型4G-4G突变也被认为是PVT的独立预测因素,尽管这些多态性与血栓形成风险增加并无明确关联。
其他获得性血栓前疾病在肝硬化合并PVT患者中的作用较少评估。与非肝硬化PVT相比,骨髓增殖性疾病和抗磷脂综合征的相关性迄今尚无定论。
由于数据相互矛盾,目前的指南并没有强烈建议在PVT诊断前或血栓形成后对这些疾病进行筛查。
总之,并无确凿证据表明肝硬化相关的止血改变或遗传性和其他获得性血栓前疾病导致的高凝状态在PVT的病理生理学中起主要作用。
4.3. Endothelial Damage内皮损伤
在Virchow三联征的三个组成部分中,内皮功能障碍在PVT生成中的假设作用研究最少,部分原因是内脏区域难以进入。因此,我们需要开展更多研究来比较合并或不合并PVT的肝硬化患者汇管区血液中的内皮特异性标志物。
硬化治疗、既往腹部手术史、脾切除和门体分流手术造成的内皮损伤也被认为是PVT的危险因素,尽管其中一些手术引起的门静脉血流改变也促进了血栓的形成。
5. Epidemiology 流行病学
PVT是肝硬化最常见的血栓事件。由于所纳入人群(接受肝移植的患者是研究最多的)、PVT的定义以及用于诊断PVT的检测方面的研究存在异质性,因此很难确定PVT的发病率和患病率。
少数前瞻性研究报告的1年内发病率在1.6%至4.6%之间。
最近的一项荟萃分析显示,一年和三年的累积发病率分别为4.8%和9.3%。
这种发生率在代偿和失代偿患者中有所不同。
在后一项荟萃分析中,Child-Pugh A级和Child-Pugh B-C级PVT的总发生率分别为9.9%和18.3%。肝癌的发生率更高(高达40%)。
发病率也因疾病病因而异,有证据表明PVT更常与非酒精性脂肪性肝病相关。
6. Clinical Manifestations and Prognostic Impact 临床表现和预后影响
PVT的诊断通常是无症状的,通常通过常规的影像检查发现。
PVT的症状是非特异性的,包括恶心、呕吐、轻度腹痛、腹泻和食欲不振。
由于PVT延伸至SMV而导致的肠系膜缺血是很少见的。
晚期肝硬变患者比非肝硬变患者更容易避免这种并发症的发生,这是因为门静脉系统侧支的频繁存在实现了减压。
因此,在PVT特征(病程、闭塞程度和肝病分期)和临床表现之间建立相关性是很重要的。
例如,在急性腹痛的情况下,超声(US)发现部分闭塞的PVT不应推迟进行对比增强计算机断层扫描(CT)或磁共振(MR)扫描,以排除腹痛的其他原因(例如毛囊炎或门静脉恶性浸润),并更好地确定PVT的真正范围。
在其他情况下,PVT的诊断与肝脏失代偿一致,同样,时间关系不应直接解释为因果关系的证据。
事实上,PVT对肝硬变的自然病程和预后的影响是有争议的,PVT是进展性疾病的表现,还是疾病进展的实际原因仍有待阐明。
在患者选择标准(代偿性vs.失代偿性)、血栓形成的程度和范围(闭塞性vs.非闭塞性)、治疗策略(抗凝vs.非抗凝)、样本量和随访时间方面,不同研究之间的差异导致了相互矛盾的数据。
因此,几项前瞻性和回顾性研究表明,PVT不是疾病进展或死亡率增加的原因,而一项随机研究——Villa等人的研究间接提出了相反的观点。
在这项小型对照试验中,Child B-C级(7 ~ 10分)肝硬化患者接受为期12个月的4,000 IU/d依诺肝素治疗不仅预防了PVT,而且改善了生存率和失代偿。
此外,PVT被证明与静脉曲张出血的高风险以及内窥镜下控制出血和再出血的失败独立相关。
在肝移植受者中,门静脉血栓对肝移植术后存活率的影响似乎取决于手术时门静脉血栓的大小和程度。
两个大型移植数据库的分析表明,PVT是移植后存活的一个强有力的独立预测变量,但没有根据PVT的级别对这种风险进行分层。
其他研究和荟萃分析表明,只有完全闭塞的PVT才会增加移植后的死亡率。结果更差的门静脉血栓延长的阈值尚不清楚,但可能与非解剖门静脉重建(肾门静脉吻合、腔静脉半转位或门静脉动脉化)的需要有关。由于增加了技术难度和增加了移植物缺血时间,这些病例的预后更差。
遗憾的是,没有随机对照试验表明PVT治疗可改善移植后生存率。
由于这些不一致的结果和缺乏随机对照试验,指南的建议存在差异。
因此,AASLD关于血管疾病的指南指出,没有足够的数据建议以改善移植后结局为目标的移植前PVT治疗。
Baveno VII共识建议对潜在的肝移植受者进行抗凝治疗,其目的是防止血栓再形成或血栓进展,以促进肝移植中充分的门静脉吻合,降低术后发病率和死亡率。
同样,一些指南只建议在筛查肝细胞癌时对潜在的肝移植候选者进行门静脉血栓的筛查,而其他指南则没有提出任何具体建议。
7. Natural History
PVT在自然病史方面也是一种异质性疾病,这种异质性使得PVT在静脉血栓中显得独特。一方面,PVT的自发性再通被广泛描述。
最近一项比较抗凝与未抗凝的肝硬变门静脉血栓患者的Meta分析显示,自发性门静脉再通率为42%。
这种事件的发生概率在代偿性肝硬变或部分门静脉血栓形成(高达70%)中较高,而在失代偿期肝硬变和肝移植患者中则低得多。
用于分期血栓范围的不同成像技术也导致了所报道的自发再通率或进展率的异质性。
除了这些因素之外,目前尚不清楚PVT自发改善或进展的其他预测因素,因此难以评估用于治疗PVT的不同治疗方法的真实疗效。必须指出的是,虽然PVT可能会自发消退,尤其是在非闭塞性和代偿性肝硬化的情况下,但在未经治疗的患者中,有33%发生了PVT进展。
另一方面,抗凝后的门静脉再通率明显低于其他血栓,特别是在陈旧性血栓中。
Driever等人最近对这一发现提出了解释。在他们的研究中,他们描述了79名患者在肝移植期间收集的非恶性肝硬变PVT的成分和结构。他们观察到,所有的PVT都包括门静脉血管壁内膜增厚,外观类似于内膜纤维化,只有三分之一的血栓含有额外的富含纤维蛋白的血栓。基于这些发现,他们建议将PVT的名称改为门静脉狭窄,并且大多数患者缺乏纤维蛋白可能解释了抗凝治疗再通率低的原因。
8. Diagnosis
门静脉血栓的初步诊断通常用多普勒超声,这种诊断技术是门静脉血栓的首选筛查方法。
支持这种恶性侵袭的发现包括门静脉内径增大、注射造影剂时动脉相血栓强化、新生血管、肿瘤到血栓的距离小于2厘米、肿瘤大小>5厘米。
最近提出的Avena标准综合了所有这些发现,除了肿瘤大小,还包括甲胎蛋白>1000 ng/dL。对于达到以上其中3项的患者,可以准确地做出恶性侵犯的诊断(100%敏感性、94%特异性、80%阳性预测值和100%阴性预测值)。
关于门静脉血栓的“年龄”,近期门静脉血栓的特征包括低回声和低密度血栓,门静脉平扫时门静脉密度增加,门静脉密度增加,增强CT扫描中心透明。相关的肝脏血流灌注改变也可以表现为动脉期肝实质增强,门脉期增强减弱。相反,血栓壁内的钙化和海绵状肿瘤的存在提示慢性(图3)。必须指出的是,前者只能用US或CT发现,而不能用MR检查,而且在PVT发病后1-3周内可发生海绵状改变(图4)。
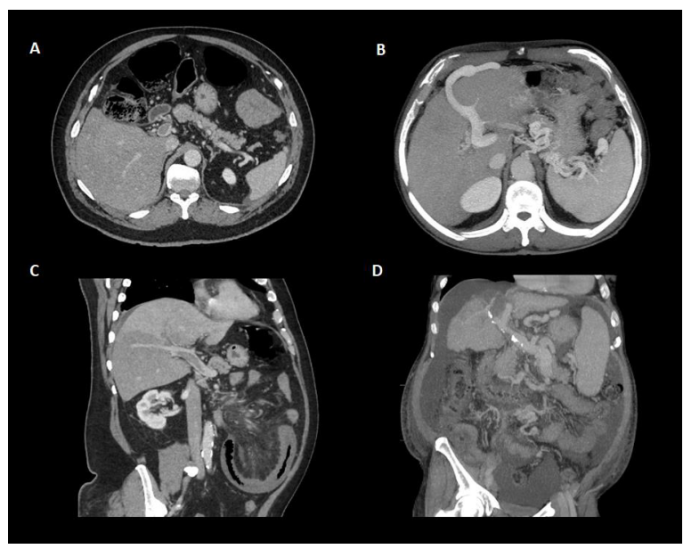
图3.CT增强扫描门静脉血栓形成的不同表现。(A)轴向面显示门脉主干部分闭塞性门静脉血栓形成,无侧支或其他门脉高压间接征象。(B)门静脉血栓形成时出现侧支循环伴脐静脉再开放和脾脏肿大。(C)斜平面示门脉主干部分闭塞性门静脉血栓形成,右叶下段肝灌注缺损。(D)肝硬化患者的慢性门静脉血栓形成。注意门静脉钙化是慢性的间接征象。萎缩性肝伴脾肿大、侧支和腹水常出现在肝硬化的情况下。
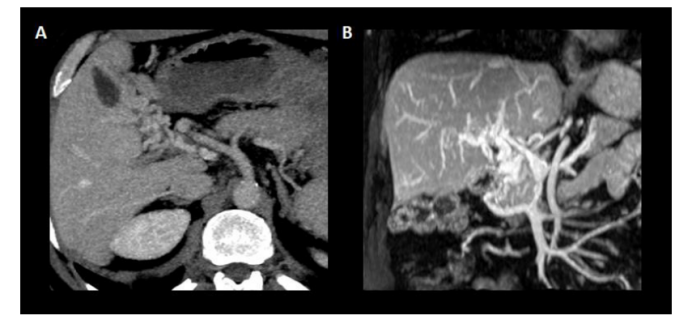
图4.门静脉海绵样变。(A)显示门静脉主干被起源于门静脉血管的门静脉侧支取代的轴位平面。(B)门静脉的冠状面及其海绵样变与构成门静脉侧支的新血管的缠绕。
9. Prophylaxis
只有一项试验评估了抗凝在预防PVT中的作用。在Villa等人的这项研究中,70名肝硬变患者(ChildB7-C10)被随机分成两组,一组接受预防性剂量的依诺肝素(每天4000IU,共48周),另一组不接受治疗。
接受依诺肝素治疗的患者的门静脉血栓发生率较低,失代偿事件的持续减少超出了门静脉血栓减少的预期。作者暗示依诺肝素诱导的肠道屏障功能的改善和减少细菌易位是一个潜在的机制。也有人推测,这些有益的作用也可能与抗凝的抗纤维化作用有关。
事实上,越来越多的证据表明,与肝硬变相关的潜在血栓前状态可能会导致肝纤维化的发展和肝病的进展,可能是通过在肝脏微循环中产生血栓导致实质消退,以及通过凝血酶和凝血因子Xa通过蛋白酶激活的受体激活肝星状细胞。一项使用利巴罗班代替依诺肝素的验证性研究结果令人热切期待。
10. Treatment
在肝硬变的背景下是否治疗门静脉血栓取决于血栓的年龄和范围、症状的存在和患者的移植状态。
对于担心肠缺血的患者,建议尽早开始抗凝,并立即咨询手术、危重护理、介入放射学和血液学。
在没有缺血症状的患者中,现有关于治疗有益效果的薄弱证据以及PVT对肝硬变自然病程的不确定影响解释了当前指南的异质性建议。在这种情况下,治疗的目的是防止血栓扩大,这可能会导致门脉高压的进展,阻碍未来的肝移植,或阻止传统的门静脉端到端吻合,从而降低移植后的发病率和死亡率。
总体而言,尤其是在非LT候选患者中,治疗应在个案基础上加以考虑。
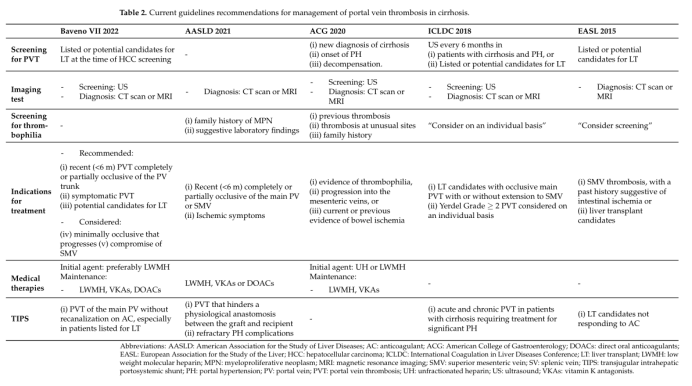
表2显示了关于治疗适应症和其他问题的不同指南的建议。
10.1. No Treatment
对于抗凝治疗的生存获益不确定性较大的无症状非肝移植候选者,通常考虑采用保守方法。在这种情况下,最近的指南建议对小的肝内门静脉分支血栓形成或门静脉微阻塞(管腔阻塞50%)采取保守的方法。如果连续成像出现进展,则应考虑抗凝治疗。
后一种策略也可以应用于门静脉血栓慢性完全闭塞或门静脉海绵样变性的患者,这些患者没有明确的抗凝治疗益处。这些患者抗凝的主要目的是防止血栓复发,并在较小程度上再通。在这种情况下的决策过程应该基于出血风险、SMV受累、是否存在血栓形成、LT候选和患者喜好。因此,美国胃肠病学会关于肝脏和肠系膜循环障碍的指南建议,只有当有(I)遗传性血栓形成倾向的证据,(Ii)血栓的进展,(Iii)由于血栓延伸到肠系膜静脉而导致的肠缺血病史,或(Iv)等待LT的患者有PVT时,慢性PVT患者才能抗凝。
10.2. Anticoagulation
抗凝是PVT治疗的主要手段。大多数评估肝硬变患者抗凝药物安全性和有效性的研究都是小规模的回顾性研究,这些研究在纳入标准、PVT的大小(以部分闭塞的PVT为主)、抗凝的时机和类型以及结果的评估方面各不相同。此外,抗凝决定是基于提供者的判断,而不是基于预定义的方案。
由于这些局限性,这些研究和汇总数据Meta分析的数据表明,抗凝在实现门静脉再通方面是安全有效的,但其对生存期的影响仍不确定。
在有效性方面,后者的Meta分析显示,任何程度的再通的再通率在66.6%至71.5%之间,完全门静脉再通的再通率在40.8%至53%之间。相比之下,尽管抗凝,血栓进展率在5.7%到9%之间。早期应用抗凝药物(一项研究<14天或其他研究<6个月)对于治疗成功至关重要,平均再通时间为5.5至8个月。然而,据报道,即使在治疗一年后也有延迟反应。
与良好应答相关的其他因素包括较低的疾病晚期、较低的广泛血栓形成、SMV闭塞程度< 50%、较低的血小板计数、既往无PHT相关出血以及基线时较低的脾脏厚度。
重要的是,当停止抗凝治疗时,30-40%的患者会复发PVT。从停止抗凝治疗到血栓复发的时间为2 ~ 5个月。
所有这些发现解释了现行指南中关于抗凝治疗至少6个月,以及在肝移植前维持抗凝治疗的建议(表2)。
值得注意的是,无论决定是否开始抗凝治疗,均缺乏证据建议具体的影像学检查时间或类型。AASLD建议每2 ~ 3个月进行1次系列影像学检查,以评估治疗应答情况,如果选择保守治疗,则每3个月进行1次影像学检查,但如果PVT进展,则考虑抗凝治疗。
接受抗凝治疗的患者早期再通率明显高于未接受治疗的患者(总再通率为25%~42%,优势比为2.61~4.8;完全性门静脉再通为33%,优势比为2.14~3.4)。同样,PVT进展在未经治疗的患者中更有可能(33%,优势比在0.06至0.26之间)。
抗凝治疗下这些较高的再通率的影响仍不确定,两项荟萃分析显示静脉曲张出血风险降低,另一项荟萃分析显示总存活率提高。一项未发表的个体患者数据荟萃分析也显示总体存活率增加,并发现抗凝的益处很大程度上取决于门静脉再通。
无论影响如何,抗凝治疗被证明是安全的,与未接受治疗的患者相比,大出血和小出血的发生率相似(10.3 ~ 11%)。此外,在发生上消化道出血的肝硬化患者中,抗凝治疗与5天治疗失败或6周死亡率的增加无关。在接受抗凝治疗的肝硬化PVT患者中,血小板计数低于50 × 109/L是任何部位出血的危险因素。这些患者发生PVT的风险也较高,因此应根据具体情况评估治疗方案。
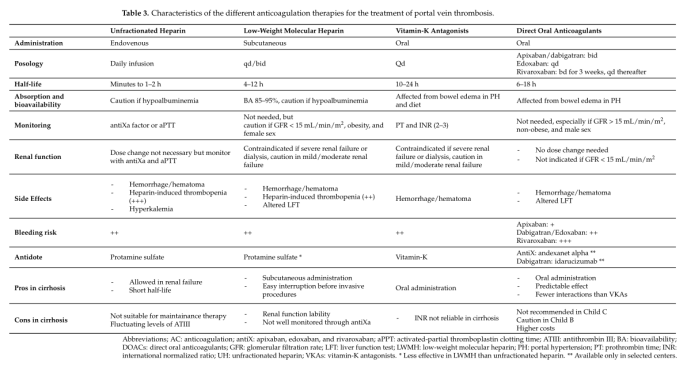
目前的抗凝选择包括维生素K拮抗剂(VKAs)、普通肝素、低分子肝素(LMWH)、磺达肝素和直接口服抗凝剂(DOAC)。表3显示了每种治疗方案的主要特点。
大多数已发表的研究都使用了VKA和LMWH,两者似乎都有类似的效果。
10.2.1. Unfractionated Heparin普通肝素
在存在肾功能不全和/或担心肠缺血的患者中,可以使用普通肝素治疗PVT,因为抗凝作用可能迅速逆转。然而,静脉给药排除了将其用作长期治疗的可能性。
10.2.2. Low Molecular Weight Heparin (LMWH)低分子肝素
低分子肝素传统上被认为是PVT的首选治疗方法。由于其非肠道给药,患者的依从性和生活质量可能会受到影响。
因此,对于最终将接受VKA或DOAC的患者,它通常被用作一种“过渡”疗法。这种“过桥”疗法的持续时间在不同的中心有很大的不同,一些中心同时启动LMWH和VKA(一旦INR达到2-3的治疗范围就停止LMWH),而另一些中心(与我们的中心类似)将口服抗凝推迟一个月。然而,在某些特定的患者中,LMWH可能比VKA更合适,例如对于需要定期穿刺术的顽固性腹水患者或INR延长的患者。
就剂量而言,一项小型研究表明,每天两次服用依诺肝素1毫克/公斤具有类似的疗效,但并发症少于每天1.5毫克/公斤。对于出血风险高的患者(例如,严重的血小板减少症),是否有必要减少剂量尚不清楚,一项小型研究表明,减少剂量与疗效下降无关。在晚期疾病患者中,由于抗凝血酶III(与低分子肝素结合的底物)水平较低,测量抗凝血因子Xa活性以监测低分子肝素的抗凝效果可能会导致治疗过量。因此,尽管有足够的抗凝作用,但肝硬变患者的抗Xa水平显著降低。尽管有这个限制,我们仍然使用抗Xa水平来帮助我们调整LMWH治疗中有出血并发症的患者的剂量,尤其是在存在肾功能障碍和病态肥胖的患者。
10.2.3. Fondaparinux 磺达肝癸钠
磺达肝素通过与抗凝血酶III选择性高亲和力结合来抑制活化因子X。与肝素不同,磺达肝素不直接抑制凝血酶或血小板第四因子。因此,肝素引起的血小板减少的风险要低得多。它每天给药一次,比大多数LMWH更方便。
关于磺达肝素的有效性和安全性,在一项包括124名肝硬化和PVT患者的回顾性研究中,将磺达肝素与低分子肝素进行了比较。磺达肝素在36个月时显示出较高的门静脉血栓消退率(77%对51%;p=0.001),但出血率也较高(27%对13%;p=0.06)。在提出正式建议之前,还需要进行进一步的前瞻性研究。
10.2.4. Vitamin K Antagonists 维生素K拮抗剂
在等候名单和非等候名单队列中,采用上述“过桥”战略的VKA被证明是安全和有效的。与LMWH相比,再通率和不良反应似乎相似。VKA的主要局限性是治疗窗口狭窄,以及由于在晚期肝硬变患者中观察到INR基线升高而导致剂量不足的风险。
10.2.5. Direct Oral Anticoagulants 直接口服抗凝剂
DOAC,包括直接凝血酶抑制剂(Dabigatran)和凝血因子Xa抑制剂(rivaroxaban、apixaban和edoxaban),最近被添加到PVT治疗中。它们的主要优点是固定剂量的口服,与其他药物的相互作用较差。目前可用的数据表明,在Child-Pugh A级患者中使用DOAC没有重大的安全性问题,在Child-Pugh B级患者中应谨慎使用(一些作者不推荐在这些患者中使用利伐沙班,因为它们的血药浓度和药效学效应增加)。在Child-Pugh C级患者中,不推荐使用DOAC。
关于它们在肝硬变中的药代动力学,我们知之甚少。使用失代偿期肝硬变患者血浆进行的体外研究表明,用凝血酶生成试验测定抗凝血酶的效力存在差异。
药物代谢的各个步骤的缺陷,如血浆蛋白结合、细胞色素P450功能、胆汁排泄和潜在的肝硬变引起的肾脏清除的缺陷,可能部分解释了这些结果,尽管还需要更大的体内研究。
几项回顾性研究和荟萃分析观察到,在受心房颤动、静脉血栓栓塞或pvt影响的肝硬化患者中,doac与vka相比,在出血并发症方面具有相似或更好的安全性。Nisly等人进行了一项系统综述和荟萃分析,只考虑根据国际血栓与止血学会(International Society on Thrombosis and Haemostasis)定义,主要安全性结局为大出血的研究。他们发现DOACS和传统抗凝剂在这方面没有重大差异。然而,必须指出的是,晚期肝硬化患者的出血风险增加。在一项回顾性研究中,Semmler等观察到自发性出血与肝病严重程度显著相关。
由于越来越多的证据,它们更容易给药,以及逆转剂(达比加兰的idarucizumab和利伐沙班和apixaban的andexanet alfa)的存在,这些药物的使用越来越多。目前的障碍,除了对晚期肝病患者的安全性问题外,还有它们的高成本和有限的可获得性。
10.3. Transjugular Intrahepatic Porto-Systemic Shunt TIPS术
PVT此前被认为是创建TIPS的禁忌症。然而,新的介入放射学技术的引入使技术成功率提高到86.7-95%。必须强调的是,大多数可用数据来自在纳入标准和采用的处理方法上不同的小型、非受控和回溯性队列。此外,传统治疗难以解决的门脉高压并发症,而不是门脉高压本身,是肝硬变和门静脉高压症患者放置门静脉高压症的最常见的适应症。
两项荟萃分析显示,TIPS术后再通率为81-84.4%,完全再通率为73%。主要并发症发生率为10%。与抗凝相比,TIPS在门静脉再通方面具有更高的有效性。
关于门静脉高压相关并发症,两项随机对照试验评估了TIPS与标准疗法(内镜套扎+普萘洛尔+抗凝)相比,在肝硬化PVT患者中预防静脉曲张再出血的有效性。
两项研究均显示,TIPS在预防再出血和PVT再通方面更有效,且不增加肝性脑病和不良反应的风险。然而,这些有益作用并未转化为生存期的改善。
这两个试验都在TIPS后使用了抗凝,尽管TIPS后的抗凝指征尚不清楚。事实上,目前的证据不支持使用它来进一步提高再通率,尽管在静脉血栓扩大到SMV的情况下可以考虑使用它。
门脉海绵状肿瘤或无可辨认的肝内门脉主干或分支的患者是最具挑战性的。对于这些患者,改良的经脾或被称为门静脉再通-TIPS的方法被证明将技术成功率提高到90%以上(范围为75-100%)。
在这些操作中,门静脉再通是通过血管成形术/支架置入和随后的TIPS置入来确保系统流出。TIPS失败的原因可能是门静脉远端或脾-肠系膜汇合处缺乏锚定区。
根据上述情况,目前的指南建议对有肝硬变和门静脉血栓的患者考虑以下适应症的提示:(1)抗凝反应不充分或禁忌症;(2)慢性门静脉高压相关并发症,难以治疗;(3)阻碍移植物与受体门静脉之间生理性吻合的慢性门静脉高压症。
图5显示了根据最新的Baveno VII共识的治疗算法。
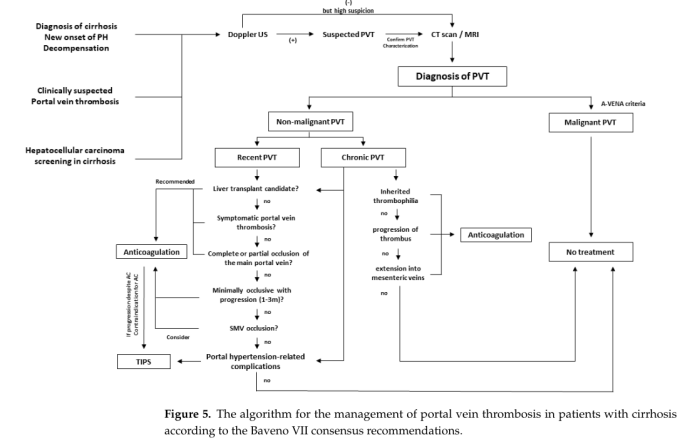
10.4. Thrombolysis 溶栓
局部或全身溶栓被认为是近期PVT抗凝治疗的辅助手段。小病例系列报告的有效率与单用抗凝治疗相似,但具有与手术相关的发病率和死亡率的高风险。基于这些初步观察,目前的指南只建议在专门的中心对尽管抗凝但仍存在肠道缺血的非常特定的患者进行溶栓治疗。
10.5. Other Considerations 其他考虑事项
门静脉高压症并发症的处理不应与其他肝硬变患者不同。必须在实施适当的胃肠道出血预防措施后开始抗凝。
因此,未接受NSBB的失代偿期患者应接受筛查内窥镜检查,而具有明确临床显著门静脉高压症状的代偿性晚期慢性肝病患者可直接开始接受NSBB。
否则,上消化道内窥镜检查应在不符合Baveno VI标准的患者中实施。如果符合这些标准,这一决定应根据PVT的年龄和程度以及是否开始抗凝治疗而个体化。重要的是,最近的数据表明,抗凝不应推迟,直到静脉曲张被根除或β完全阻断。本建议也适用于二级预防措施的设置。
事实上,通过预防性的内窥镜精索静脉曲张结扎术持续低分子肝素治疗不会增加肝硬变患者的出血风险,在非肝硬变的门静脉高压症患者中也有类似的发现。在这方面需要更多的数据。
肝细胞癌侵犯门静脉的患者不能从抗凝中受益。
然而,在少数情况下,最初的“恶性”血栓会导致血流停滞,从而导致血栓形成和症状性门静脉血栓形成(例如,肠缺血)。在这种罕见的情况下,在权衡风险和益处后,可能会考虑抗凝。对于与癌症相关的近期(非肝硬化性)内脏静脉血栓形成,国际血栓和止血学会推荐使用低分子肝素或DOAC。他们建议将低分子肝素应用于腔性胃肠癌、活动性胃肠粘膜异常、泌尿生殖道癌出血风险高的患者,或正在接受与DOAC有潜在相关药物相互作用的现有系统治疗的患者。
最后,我们对肝移植后PVT的预防有几点看法。肝移植前PVT是PVT复发的危险因素,如果进行非解剖吻合术,或者如果肝移植前PVT的程度和范围很大,风险更大。
根据西班牙肝移植学会和西班牙血栓和止血学会最近达成的共识,对于没有凝血障碍、肝移植功能障碍或低血小板计数(<30,000-50,000/微升)的有PVT危险因素的患者,建议在术后24小时内开始治疗性低分子肝素(即1 mg/kg)。危险因素包括肝移植前门静脉血栓形成、门静脉血流缓慢(再通后)<1300毫升/分或<65毫升/分/100克、取栓过程中血栓部分切除或静脉内膜损伤、非生理性门静脉回流重建和受体亲血栓形成障碍。在无并发症的情况下,应在肝移植后至少延长治疗2个月,然后进行个体化治疗。
11. Conclusions
门静脉血栓形成是肝硬变患者最常见的血栓形成事件。最近DOAC的加入和新的门静脉再通放射学技术是治疗这一并发症的重大突破。然而,缺乏大型前瞻性观察研究和随机试验解释了其对肝硬变自然病程的影响的不确定性,以及当前指南中的异质性诊断和治疗建议。因此,需要未来的研究来填补目前的知识空白,并可能需要多中心合作。
本文是杜佳航版权所有,未经授权请勿转载。本文仅供健康科普使用,不能做为诊断、治疗的依据,请谨慎参阅





评论